微创肺叶切除与肺段切除治疗早期肺恶性肿瘤的疗效比较
2022-10-10桑海威孙静王安生黎传奎王祖义
桑海威,孙静,王安生,黎传奎,王祖义
肺部恶性肿瘤是我国[1]乃至全世界危害人类健康的重要因素之一,全世界每年约220万新发肺癌病例,约180万人死于肺癌[2]。得益于肺部CT在体检中的广泛应用,越来越多的肺部恶性肿瘤在早期被发现[3]。目前肺癌的外科治疗以微创肺叶切除为主。对于早期肺恶性肿瘤,目前国际上公认的最有效的治疗方式是手术切除,包括肺楔形切除,肺段切除,联合亚段切除,肺叶切除等。其中微创肺叶切除是肺部恶性肿瘤外科治疗的标准术式,应用最为广泛。近年来,因微创肺段切除术可明显减轻手术创伤、保留更多肺功能,同时可获得较好的远期效果而被大量胸科医生所推崇。然而,临床上关于早期肺癌,尤其是直径≤2 cm的I期肺癌手术方式的选择存在一定的争议[4]。本研究拟通过回顾性分析在本中心接受微创肺叶切除或微创肺段切除的患者的临床资料,比较两种术式在早期肺部恶性肿瘤中的临床效果,以期为临床工作提供指导。
1 资料与方法
1.1 一般资料 选取2018年1月—2019年12月在蚌埠医学院第一附属医院胸外科接受胸腔镜肺叶切除或肺段切除治疗的早期肺癌患者153例为研究对象,其中男71例,女82例。回顾性收集患者的临床资料,并根据手术方式的不同将患者分为微创肺叶组(116例)和微创肺段组(37例),2组患者性别、年龄、术前FEV1%、术前氧分压、手术侧、吸烟史之间比较差异无统计学意义(P>0.05)。见表1。

表1 2组患者一般资料比较
1.2 入组标准 纳入标准:(1)术后病理证实为肺恶性肿瘤;(2)肿瘤直径≤2 cm的患者;(3)无淋巴结及远处转移。排除标准:(1)术中因各种原因导致中转开胸的患者;(2)术中冰冻或术后病理证实为良性病变的患者; (3)无法配合随访和治疗的患者;(4)合并其他部位恶性肿瘤病史的患者;(5)病灶为转移瘤的患者;(6)需要长期激素治疗的患者;(7)术前接受新辅助治疗的患者。
1.3 手术方法 2组患者均采用胸腔镜手术,单肺通气。体位均为健侧卧位,胸部垫高。手术采取单操作孔或单孔法,观察孔位于腋中线或腋后线第6或第7肋间,长约1.0 cm。操作孔位于腋前线或腋中线第4或第5肋间,长约2.5 cm。术中根据患者胸腔粘连和肺裂发育情况决定操作顺序。微创肺段组患者进胸后先探查肿瘤位置,依次按照动脉、支气管、静脉的顺序处理,术中应用改良膨胀萎陷法[5]确定段间平面。最后,在切除靶肺段时应注意保证切缘与肿瘤距离大于2 cm或大于肿瘤直径。微创肺叶组患者同样先确定肿瘤位置,位于外周的病变可先楔形切除,如术中快速冰冻报告为恶性,再行肺叶切除,如术中冰冻报告为良性病变则手术结束,相关病例不纳入研究。位于中央的肺结节则直接行肺叶切除。一般情况,微创肺叶切除依次解剖并处理肺叶动脉、静脉,最后再处理肺叶支气管,术中视肺裂发育情况处理顺序可有所调整,肺门及纵隔淋巴结常规予以系统性清扫。
1.4 观察指标和术后随访 本研究主要观察指标:(1)手术相关指标(术中出血量、手术耗时、术后胸引管引流量、胸引管留置时间、术后疼痛得分),其中手术耗时为刀片切皮至皮肤缝合所用时间,术后胸引管引流量为每日引流量之和,术后疼痛情况采用数字评定量表进行评分,依据患者的主观感受评估疼痛得分,无痛(0分),轻度疼痛(1~3分),中度疼痛(4~6分),重度疼痛(7~10分),其中最高的一次得分作为患者术后疼痛得分;(2)住院相关指标(住院费用、术后住院时间);(3)术后并发症(乳糜胸、肺漏气、胸腔积液、心率失常、肺部感染、喉返神经损伤、呼吸衰竭)发生率;(4)术后随访主要通过患者来院复查、电话询问等方式记录患者的生存状态,通过复查胸部CT、腹部及颈部彩超等检查了解患者疾病进展情况。术后每3个月随访一次,其中微创肺段组术后随访时间为15~30个月,微创肺叶组患者术后随访时间为15~33个月,截止时间为2021年3月31日。

2 结果
2.1 2组患者手术相关指标比较 微创肺叶组和微创肺段组患者术中出血量、手术时间比较差异无统计学意义(P>0.05);与微创肺叶组相比,微创肺段组患者术后胸引管引流量较少、胸引管留置时间短、术后疼痛轻,差异具有统计学意义(P<0.05)。见表2。

表2 2组患者手术相关指标比较
2.2 2组患者住院相关指标比较 微创肺叶组与微创肺段组患者住院费用比较差异无统计学意义(P>0.05);微创肺段组患者术后住院时间短于微创肺叶组(P<0.005)。见表3。

表3 2组患者住院相关情况
2.3 2组患者术后并发症发生率比较 2组患者术后并发症发生率比较,差异无统计学意义(P>0.05)。见表4。
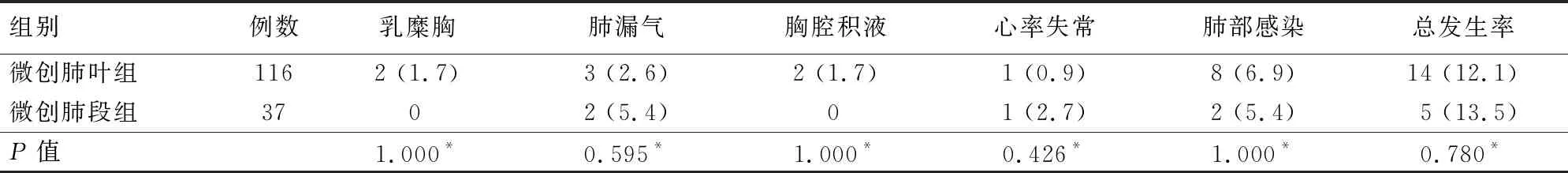
表4 2组患者术后并发症发生率比较
2.4 2组患者术后生存情况比较 截止到随访结束,微创肺叶组有5例患者失访。2组患者在随访过程中均未发现复发、转移的情况,亦无死亡病例。
3 讨论
目前微创手术切除仍是治疗早期肺癌的首选方法。Ginsberg等[6]在1995年进行的一项前瞻性研究显示,接受肺叶切除的患者总体预后优于局限性肺切除的患者,从此,肺叶切除联合肺门及纵隔淋巴结清扫成为肺癌手术治疗的标准术式。然而,随着高分辨率CT的广泛应用,以及人们对健康体检的重视,越来越多的早期肺癌被检出[7]。经典的手术方式对患者创伤较大,为了更多地保留患者肺功能,同时基于肺段在解剖上的独立性,有学者将肺段切除甚至亚段切除应用于早期肺癌并取得了良好的效果[8]。
本研究通过回顾性分析微创肺叶切除与肺段切除的手术相关指标和住院相关指标发现,微创肺段切除术可明显减少患者术后胸引管引流量,减轻术后疼痛,缩短胸腔引流管留置时间和住院时间。这四项指标均与手术造成的创伤相关。这可能与以下原因有关:首先,虽然微创肺段切除术对肺造成的创面较肺叶切除大,但因微创肺段切除术切除肺组织较少,肺损失少,复张快,胸腔内残腔较小,同时肺部创面会与周围肺组织发生粘连,因而渗出会减少。表现为术后引流量明显减少,早期便可将胸引管拔除。其次,本中心在对患者实施肺叶切除时所选择的淋巴结切除方式主要为经典的肺门纵隔淋巴结清扫,而对于微创肺段组患者所选择的淋巴结切除方式主要为淋巴结采样术,淋巴结采样相比较淋巴结清扫对纵隔胸膜造成的损伤较小,因此患者术后疼痛有所减轻。最后,胸腔引流管在胸膜腔内刺激壁层胸膜,也是引起胸疼的一个重要原因,临床中有相当一部分患者拔出胸引管便可明显缓解患者术后疼痛。患者术后胸闷和疼痛的症状减轻,加快了术后康复,从而缩短住院时间。此研究发现接受两种不同术式的患者在术中出血量、手术时间和住院费用等方面差异无统计学意义。
本研究中微创肺段组中共5例(13.5%)出现了并发症,其中2例肺漏气,2例肺部感染,1例术后心率失常。微创肺叶组共14例(12.1%)患者出现了术后并发症,其中术后肺部感染为最常见并发症,1例患者因乳糜胸引起胸腔包裹性积液,1例患者因肺部感染出现包裹性胸腔积液。2组患者术后均未出现喉返神经损伤及呼吸衰竭。本研究发现2组患者术后并发症发生率无统计学差异,这与林善安等[9]报道的结果一致。但是,值得注意的是微创肺段组患者肺漏气的发生概率是微创肺叶组患者的两倍有余(5.4% vs 2.6%),这主要是由于肺段切除术需要对段门及段间平面进行更多的解剖分离,而肺叶切除患者仅需对肺门部进行游离,仅当肺裂发育不全或胸腔内广泛粘连才需进行更广泛的解剖分离。因此,肺段切除可导致肺部创面更大,增加术后肺漏气的发生率。当然,这种漏气一般术后2~5 d可自行愈合[10]。乳糜胸是肺部手术不太常见的并发症[11],本研究中2例乳糜胸患者均出现在微创肺叶组,且均为右侧肺叶切除的患者。这可能与术中清扫纵隔淋巴结密切相关,因此对于早期肺癌是否需要进行广泛淋巴结清扫,仍是一个值得思考的问题。术后并发症的发生除了可能与手术方式相关外,还可能与患者自身身体状况及术前准备的充分程度密切相关。当然,术者操作的熟练程度以及围术期医护团队协作也是重要的因素之一,这些都将是我们后期需要深入研究的内容。
本研究随访结果显示,微创肺段组和微创肺叶组术后均无复发和转移病例。范啸等[12]对IA期肺癌预后进行COX回归分析后认为手术方式不是预后的独立危险因素,肿瘤大小和病理分型对于预后起到决定性作用。近年来,国内外大量文献报道了胸腔镜肺段和肺叶切除的相关研究[13-14]。现有数据显示,对于I期老年肺癌患者或直径≤2 cm且无淋巴结转移的肺癌患者两种手术方式可取得相似的治疗效果[13,15]。当然,也有报道[16]认为,微创肺段切除比肺叶切除局部复发率高。日本的一项前瞻性研究(JCOG0802/WJOG4607l)[17]显示两种术式在围术期的治疗效果相似。基于该研究在2021年美国胸外科年会上公布的远期治疗效果,将患者术后肺功能保存情况与生存情况综合分析,多数学者[18]认为2 cm以下的外周型肺结节应采用胸腔镜肺段切除术或楔形切除术进行治疗。而对于2~3 cm,实性成分小于50%的肺结节实施肺段切除争议较大,我们期待日本的另一项前瞻性研究JCOG1211给我们以启示[19]。
总结以上,对于直径≤2 cm的I期肺癌,微创肺段切除术与微创肺叶切除术在术后并发症及远期效果上均较好,然而微创肺段切除术相较于微创肺叶切除术可明显减少手术创伤,缩短住院时间。本研究仍存在一些不足之处:如微创肺段组患者例数较少;整体随访时间相对较短。针对以上问题,我们下一步将继续增加样本量,延长随访时间,以期获得更加可靠的结论。
