基于网络药理学和分子对接探讨疏风止痉方治疗耐药性癫痫的作用机制*
2022-10-10崔芬戎萍王林
崔芬,戎萍,王林
(天津中医药大学第一附属医院,天津 300381)
癫痫是由遗传、代谢、结构、免疫等不同原因所导致的一种具有持久性的产生癫痫发作倾向为特征的慢性脑部疾病,临床上主要以脑神经元异常放电引起反复痫性发作为主要特征。癫痫是一种常见疾病,发病率为 0.4%~0.8%,其中约有 30%患有耐药性癫痫(DRE)[1]。国际抗癫痫联盟(ILAE)将DRE定义为:按标准化治疗,应用两种或两种以上抗癫痫药物(AEDs)治疗(不论是单药还是多药),12个月内仍有癫痫发作[2]。DRE主要由于其耐药性发生机制涉及多种学说,其中多药转运蛋白学说认为药物转运体的过多表达与癫痫的耐药机制密切相关,有研究认为多药转运蛋白P-gp参与了抗癫痫药物的跨膜转运。有学者提出DRE与生活质量差和不明原因的猝死风险增加有关,也有学者提出DRE与自主神经系统和时间生物学有关,自主生物反馈可作为DRE的潜在治疗靶标。癫痫猝死(SUDEP)是癫痫死亡的重要原因,DRE患者SUDEP的发生率在不断增加[3]。西医治疗主要包括药物治疗、手术治疗、生酮饮食、干细胞治疗。目前DRE的治疗存在许多困难,针对这些困难,首先要了解其耐药机制才能制定个体化方案。DRE属中医学“癫疾”“痫病”范畴,最早见于《黄帝内经》,中药在治疗痫病上具有独特优势。诸多医家认为痫病是由风、火、痰、瘀相互搏结上犯脑窍引起的神志疾病,病理性质本虚标实,中药治疗上常见寒热并用、攻补兼施、升降相因、散收结合等配伍[4]。
DRE是近年癫痫研究邻域中治疗的难点,而《幼幼集成》中记载抗痫药“疏散外感,开通经络,庶后药得以流通故耳”为中药治疗DRE提供思路。马融教授[5]认为要根据患儿症状、体征、体质综合分析,不拘泥于镇静、息风等药物,辨证论治,类似银翘散、沙参麦冬汤也可治疗DRE。药理学研究表明银翘散具有抗炎作用,炎症反应与DRE多药耐药相关,从而推测银翘散治疗DRE的机制可能与控制炎症反应、阻断海马神经元细胞的脱失和小胶质的活化,阻断耐药P糖蛋白的过度表达,增强机体对某些抗痫西药耐药的敏感性,增强与西药联合的协同作用有关[6]。疏风止痉方是马融教授由吴鞠通《温病条辨》银翘散化裁而来,在原方基础上加金果榄、全蝎组成,银翘散其药性轻,具有疏风解表、开通经络之功,方中加入金果榄清热利咽,并以虫类药全蝎加强通络止痉的功效,全方共奏疏风止痉、清热通络之效,突破传统的重镇豁痰息风治痫之法,改从外感风热入手治疗DRE。疏风止痉方在疏风清热银翘散基础上,加金果榄、全蝎加强清热通络止痉之效,全方具有疏风止痉、清热通络的功效。相关动物实验研究表明,疏风止痉方联合抗痫药物可提高脑内抗痫药物浓度,减少癫痫发作次数,还能减轻发作级别,其作用机制是疏风止痉方可以下调 NF-κB 通路上下游细胞因子 IL-1β、TNF-α、Cox-2的水平,抑制NF-κB的激活与表达,进一步降低P-gp的表达与转运功能[7-8]。马茗晗等[9]通过马融教授运用疏风止痉方治疗DRE验案表明该方具有使癫痫发作次数明显减少的临床疗效。
网络药理学是系统网络分析与药理学相结合的一种新方法。网络药理学以生物网络为靶点,分析这些网络中药物、靶点、疾病和途径之间复杂多样的联系[10]。中药复方化学成分复杂,主要是通过多种成分与多个靶点之间相互协同作用来发挥药效,通过分子对接验证其结合活性。本研究旨在通过网络药理学及分子对接的方法,分析疏风止痉方治疗DRE的潜在作用机制。
1 材料与方法
1.1 筛选活性成分及对应靶点 基于中药系统药理学数据库与分析平台(TCMSP,http://tcmspw.com/tcmsp.php)以疏风止痉方12味中药为关键词分别进行检索,并以生物利用度(OB)≥30%和类药性(DL)≥0.18为筛选条件进行筛选,得到疏风止痉方的活性成分及对应靶点。OB是指药物口服后被吸收进入人体循环的速度与程度,DL指化合物与已知药物的相似性,满足两者条件的化合物定为活性成分。
1.2 筛选疾病相关靶点 运用“Drug-resistant epilepsy”为关键词,在预测人类基因的数据库(GeneCards,https://www.genecards.org/)和收录人类孟德尔疾病信息的数据库(OMIM,https://www.omim.org/)检索,得到与DRE相关的靶点。
1.3 筛选靶点并构建PPI网络 运用R 4.0.0语言VennDiagram数据包筛选疏风止痉方潜在靶点和疾病相关靶点的交集,将交集靶点上传至String数据库(https://string-db.org/)中构建 PPI图。
1.4 中药-化学成分-疾病靶点的构建 将中药、化学成分和疾病靶点上传至Cytoscape 3.7.2软件生成中药-化学成分-疾病靶点网络图,并通过Network Analyzer工具进行网络分析得出关键化学成分和关键靶点。
1.5 基因本体(GO)功能和京都基因与基因组百科全书(KEGG)通路富集分析 在R4.0.0语言中安装Bioconductor包,将基因名称转换为基因id,再进行GO功能富集分析和KEGG通路富集分析,运行R4.0.0语言得出前20条GO功能富集分析柱状图及前20条KEGG通路富集分析高级气泡图,并构建KEGG关系网络。
1.6 活性成分-靶点分子对接 选取“中药-化学成分-疾病靶点”所得度值较高的活性成分,在PubChem数据库(http://pubchem.ncbi.nlm.nih.gov/)中寻找其2D结构,利用ChemOffice绘制出3D结构,并对其结构优化,以SDF格式导出。先在Uniprot数据库(https://www.uniprot.org/)找到靶点蛋白的 id,再在PDB 数据库(https://www.rcsb.org/)中寻找靶点蛋白晶体结构并将其导出,利用Pymol 2.4.0将靶点蛋白晶体结构进行删除水分子和小分子配体处理,以pdb格式导出,将靶点蛋白和活性成分均导入AutoDockTools 1.5.6,准备 PDBQT 文件和确定活性口袋,最后利用AutoDock Vina进行分子对接。
2 结果
2.1 筛选活性成分及对应靶点 在TCMSP数据库检索金银花、连翘、荆芥穗、淡豆豉、桔梗、牛蒡子、淡竹叶、生甘草、薄荷、芦根、金果榄、全蝎12味中药的化学成分,共得到1 196个化学成分,阈值设定OB≥30%、DL≥0.18,共筛选出180个化学成分,其中金银花23个、连翘23个、荆芥穗8个、淡豆豉2个、桔梗7个、牛蒡子8个、甘草92个、薄荷10个、芦根1个、金果榄6个,在TCMSP数据库上搜集到化学成分对应靶点3 392个,见表1。映射到Uniprot数据库进行蛋白标准化命名,去重后最终得到255个靶蛋白。
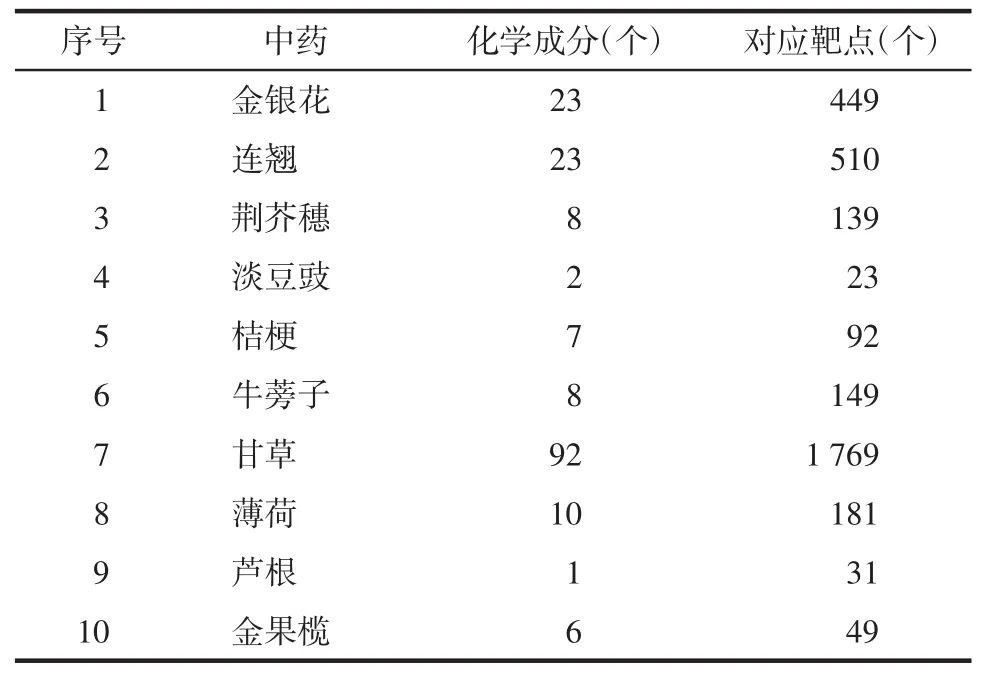
表1 疏风止痉方活性成分基本信息Tab.1 Shufeng Zhijing Prescription active ingredient basic information
2.2 筛选疾病相关靶点 通过GeneCards数据库搜集到DRE的疾病靶点4 018个,在线人类孟德尔遗传OMIM数据库搜集到疾病靶点569个,去重后共计4 471个。
2.3 筛选靶点并构建PPI网络 运用R 4.0.0语言VennDiagram数据包筛选出疏风止痉方潜在靶点和疾病相关靶点交集165个,将这些交集靶点上传至String 数据库(https://string-db.org/)中进行靶点间蛋白互作分析,选定物种为“homo sapiens”,并设定置信度大于0.9,构建PPI图,见图1。图1包含165个节点,639条边,其中节点表示蛋白,节点的大小与节点度值呈正比关系,每条边则表示蛋白与蛋白之间的相互作用关系,线条越多表示关联度越大,靶蛋白平均节点度值为7.75,将前30个度值由高到低排序,如图2所示。其中STAT3、MAPK1、AKT1、MAPK3、JUN的度值排名较靠前。

图1 PPI蛋白互作网络Fig.1 PPI protein interaction network
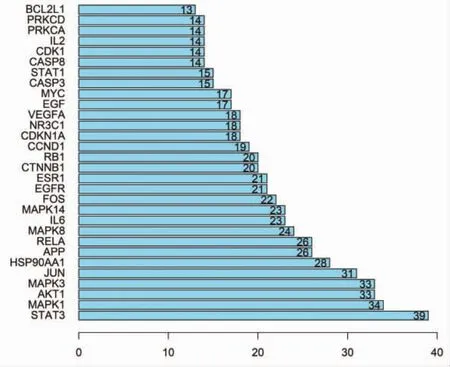
图2 蛋白互作网络节点度值排序Fig.2 Protein interaction network node degree value
2.4 中药-化学成分-疾病靶点的构建 利用Cytoscape3.7.2 软件构建中药-化学成分-疾病靶点网络图,见图3,该网络包含302个节点(128个化学成分节点,9个中药节点,165个疾病靶点节点)和1 699条边,每条边表示化学成分与靶点之间的相互作用关系。图3中红色代表中药,绿色代表中药化学成分,天蓝色代表疾病靶点。图3表明疏风止痉方具有多种化学成分,同一化学成分可以作用于多个靶点,同一靶点也可以对应多个化学成分,体现了复方多成分、多靶点的作用特点。通过Cytoscape 3.7.2 软件中的 NetworkAnalyzer工具进行网络分析得出各节点Degree值,得出Degree值排名前5的化学成分为:槲皮素(quercetin)、木犀草素(luteolin)、山奈酚(kaempferol)、汉黄芩素(wogonin)、柚皮素(naringenin)。Degree值排名前5的靶点为:前列腺素内过氧化物合酶2(PTGS2)、热休克蛋白90α家族 A 类成员 1(HSP90AA1)、钙调蛋白 1(CALM1)、雌激素受体 1(ESR1)、雄激素受体(AR)。
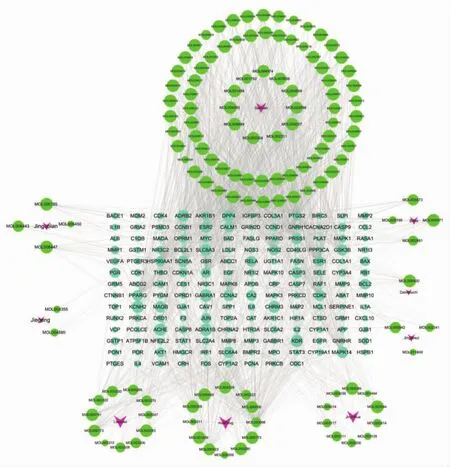
图3 中药-化学成分-疾病靶点网络Fig.3 Chinese medicine-chemical-disease target network
2.5 GO功能富集分析和KEGG通路富集分析 将上述165个靶点基因名称转换为基因id,在R语言中安装Bioconductor包,进行GO功能富集分析,共获得2 584条 GO 功能条目(P<0.05),包括对金属离子的反应、对脂多糖的反应、对细菌源分子的反应等2 235条生物过程(BP),膜筏、膜微域、膜区等117条细胞组成(CC),泛素样蛋白连接酶结合、磷酸酶结合、蛋白磷酸酶结合等196条分子功能(MF),分别绘制出前20条GO富集分析柱状图,见图4、图5、图6。图中纵坐标代表GO名称,横坐标代表富集在每个GO上的基因数目,柱子越长,代表富集在该GO上的基因数目越多,颜色越红代表富集的显著性越高。
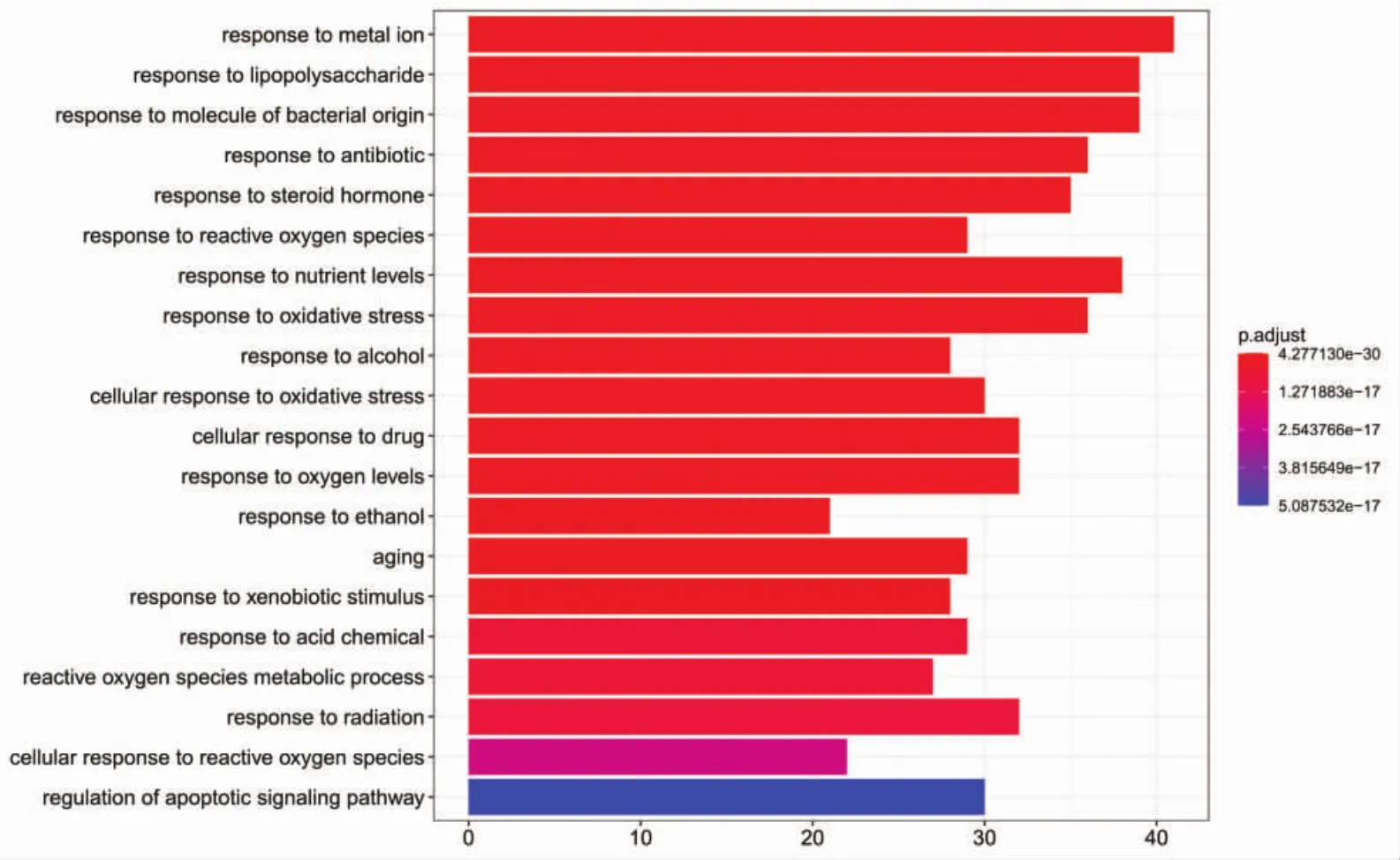
图4 疏风止痉方靶点的GO生物过程富集分析Fig.4 Shufeng Zhijing Prescription targets GO biological enrichment analysis process
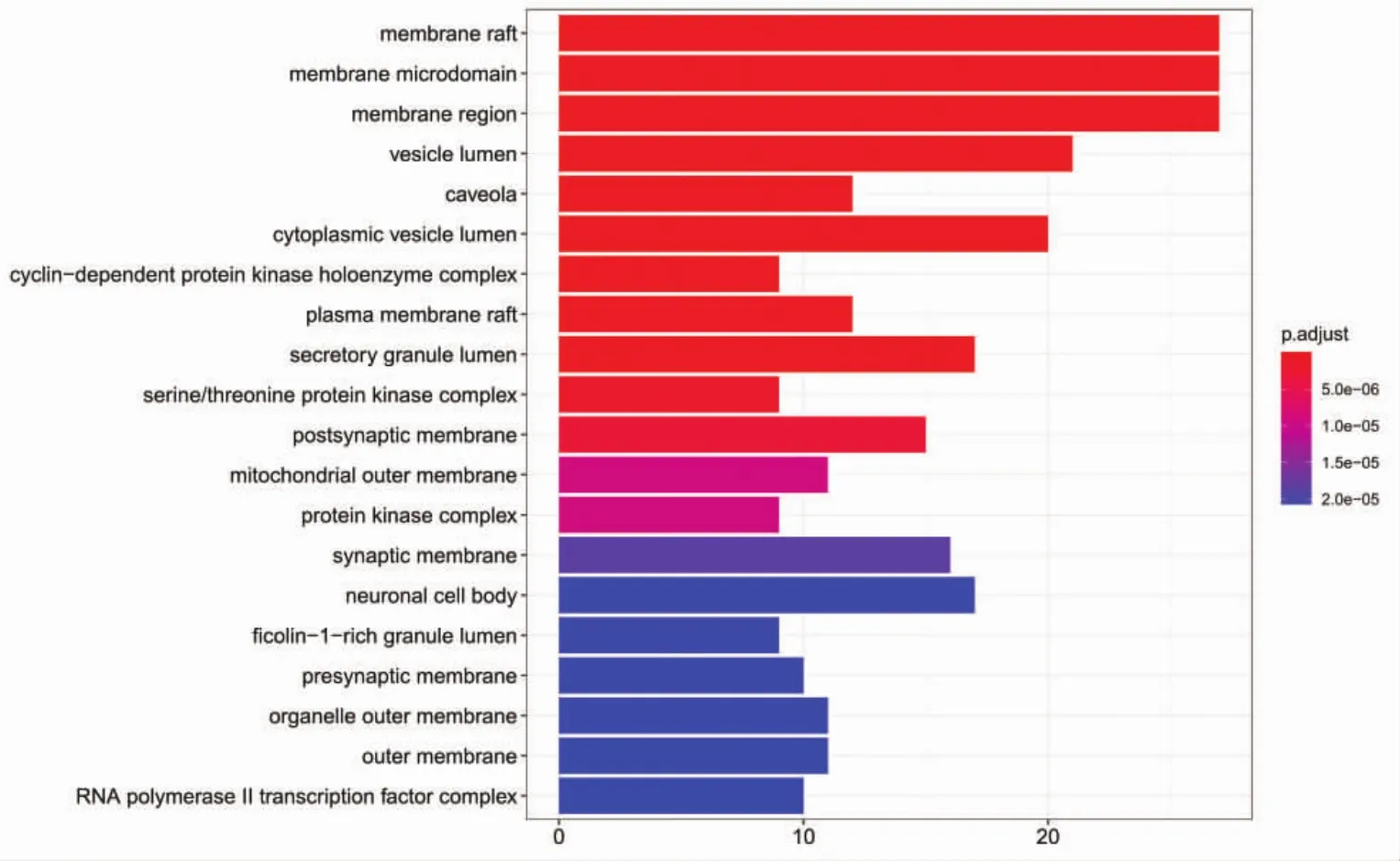
图5 疏风止痉方靶点的GO细胞组成富集分析Fig.5 Shufeng Zhijing Prescription targets GO cells enrichment analysis
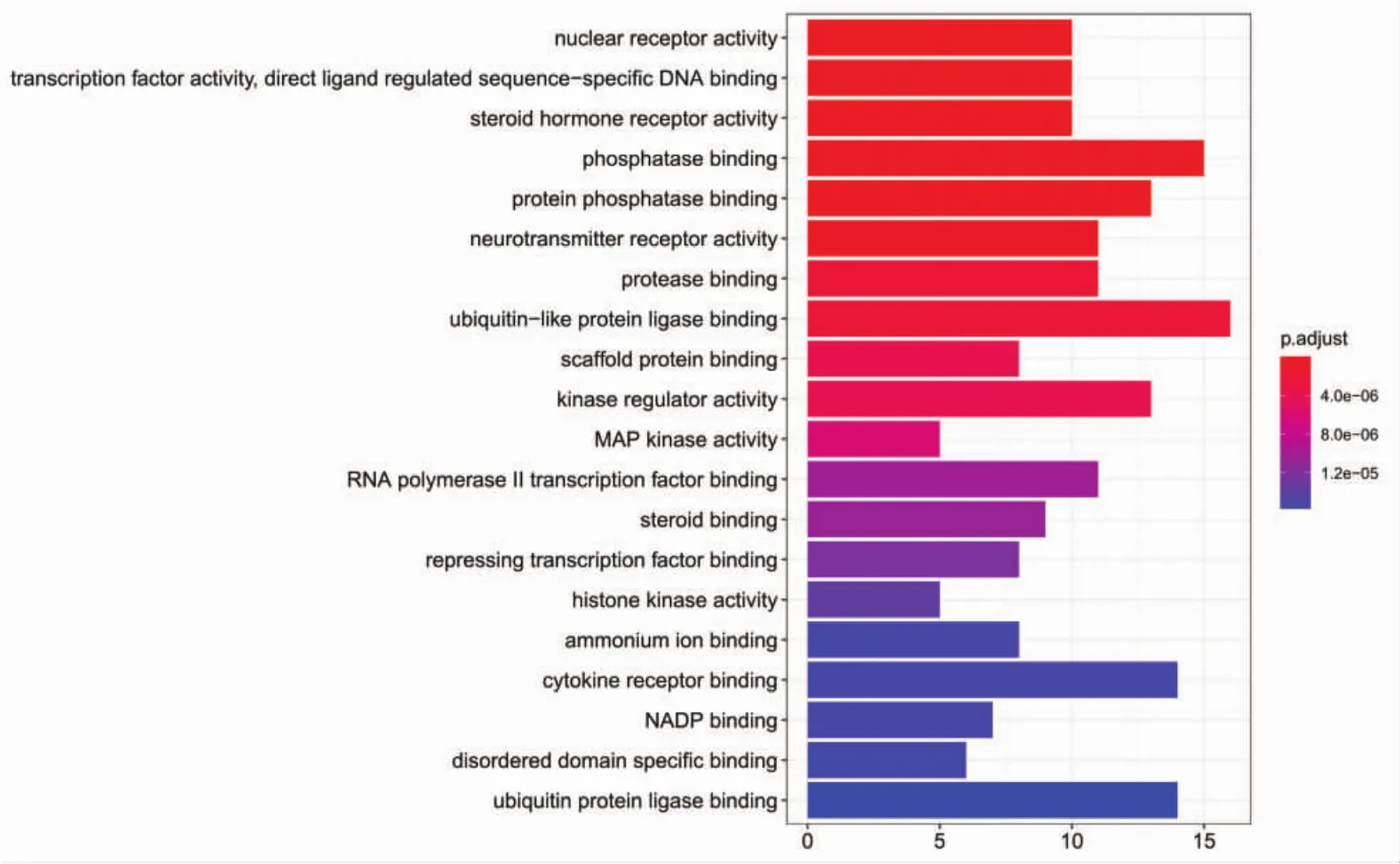
图6 疏风止痉方靶点的GO分子功能富集分析Fig.6 Shufeng Zhijing Prescription party GO enrichment of molecular function analysis of targets
KEGG通路富集分析共获得171条信号通路(P<0.05),包括 AGE-RAGE 信号通路、流体剪应力与动脉粥样硬化、乙型肝炎、卡波西肉瘤相关疱疹病毒感染、前列腺癌、人巨细胞病毒感染等通路。绘制出前20条KEGG通路富集分析高级气泡图,见图7。图中纵坐标代表KEGG通路名称,横坐标代表基因的比例,圆圈大小代表富集在每条通路上基因的数目,颜色代表富集显著性,颜色越红代表富集的显著性越高。KEGG关系网络是由前20条通路和富集在这些通路上的基因构建,如图8所示,该网络包含103个节点(20条通路和83个基因)和464条边。橙色长方形表示基因,红色V形表示KEGG通路,图形大小代表邻接节点的数目,数目越多则图形越大。KEGG关系网络中显示MAPK1、MAPK3、AKT1的邻接节点的数目最多,可能是疏风止痉方治疗DRE的主要目标基因群体。
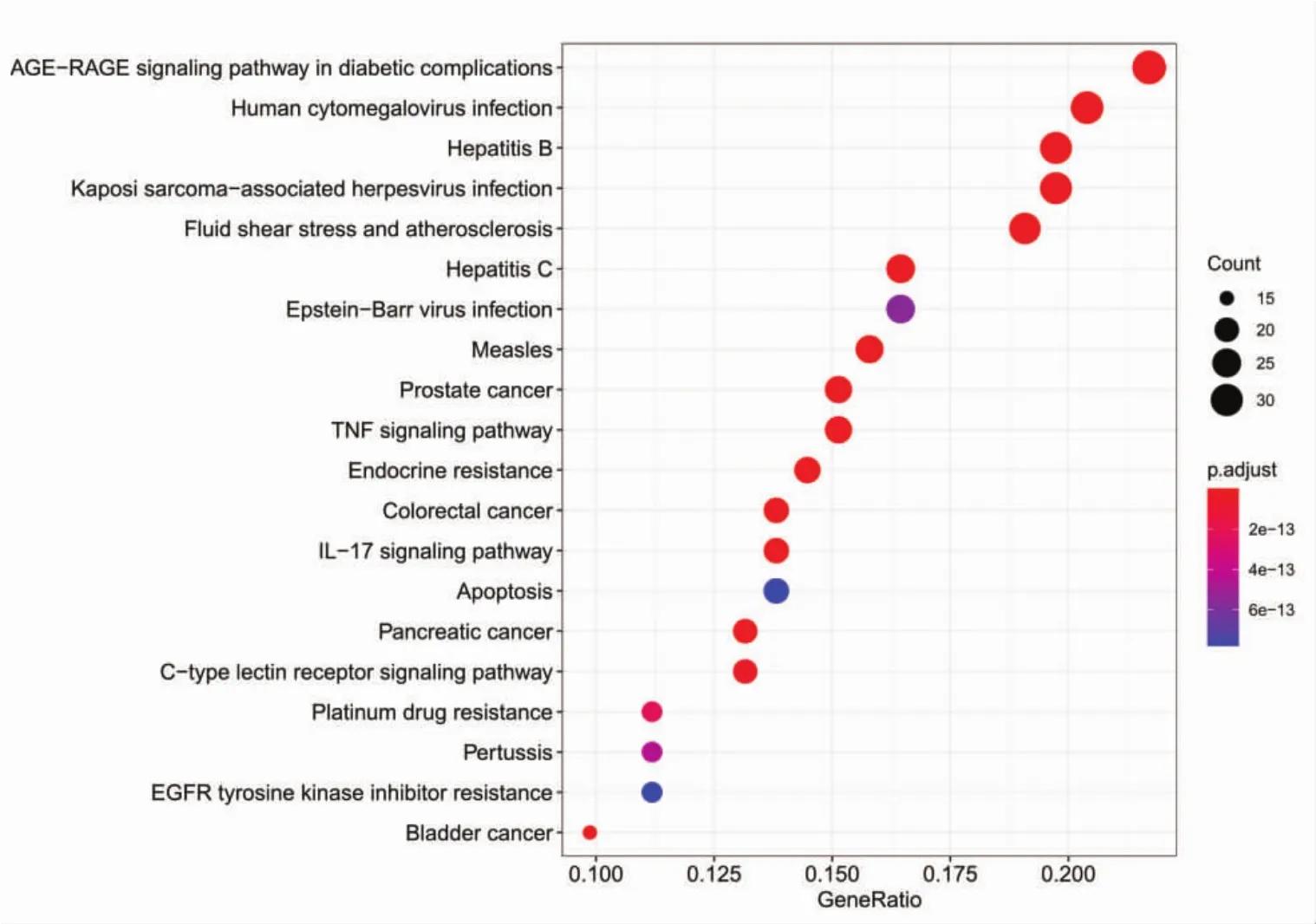
图7 疏风止痉方靶点的KEGG通路富集分析Fig.7 Shufeng Zhijing Prescription targets KEGG pathway enrichment analysis
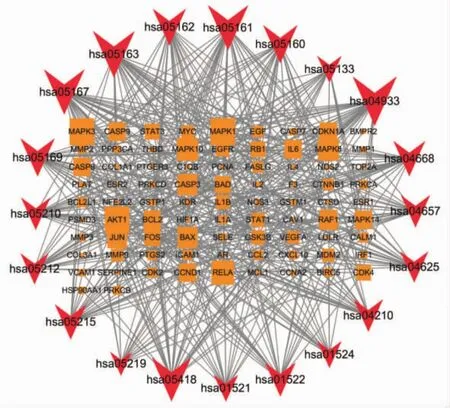
图8 KEGG关系网络Fig.8 KEGG relation network
2.6 活性成分-靶点分子对接结果 将疏风止痉方主要活性成分与核心靶点进行分子对接验证,一般认为活性化合物和靶点蛋白受体间的结合能小于-5 kcal/mol具有较好结合活性,小于-7 kcal/mol具有强烈结合活性。结果提示疏风止痉方核心活性化合物和PTGS2、HSP90AA1、ESR1、AR、MAPK1、AKT1、MAPK3核心靶点之间具有良好的结合活性。见表2和图9。
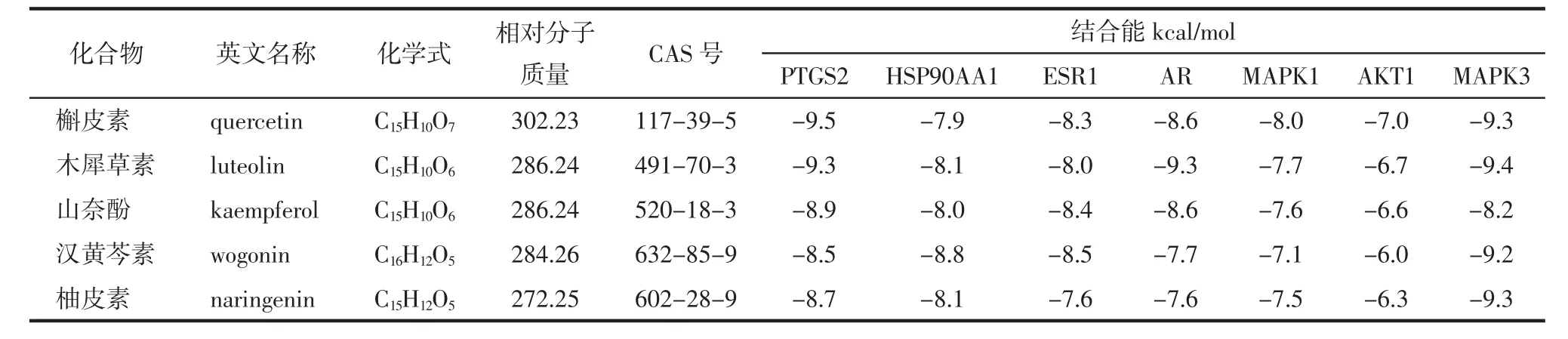
表2 分子对接结果Tab.2 Molecular docking results
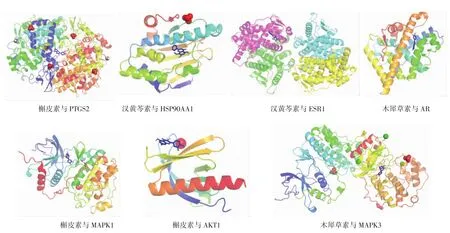
图9 分子对接模式图Fig.9 Molecular docking model
3 讨论
众所周知,癫痫是大脑神经元的异常放电引发大脑功能障碍的神经系统疾病,许多研究证实,受损神经元组织中炎症细胞浸润和分子调节机制紊乱是癫痫发生的主要因素[11]。中医药治疗DRE具有独特优势,许多中药在临床实践中具有较好的抗痫作用,现代研究发现其作用与调控炎性因子的表达、调节兴奋性或抑制性神经递质、离子通道、抗氧化反应等密切相关[12]。马融教授团队通过动物实验及临床诊疗证明疏风止痉方治疗DRE有疗效,具体表现在减少癫痫发作次数及减轻发作级别。
本研究采用网络药理学方法对疏风止痉方中12味中药的有效成分进行分析,再结合分子对接技术将主要活性化合物与关键靶点进行分子对接验证。疏风止痉方的主要活性成分为槲皮素、木犀草素、山奈酚、汉黄芩素、柚皮素。它们均是黄酮类化合物,均具有抗炎、抗氧化等多种生物活性作用。其主要通过调节氧化应激、抑制炎症反应、神经保护等治疗DRE。刘萍等[13]发现,槲皮素可介导TLR4/NF-κB通路,调节NO释放,进而降低TNF-α、IL-1β、IL-6等炎症因子的分泌,从而起到抗炎作用。Akyuz E等[14]研究证据证明了槲皮素具有抗癫痫作用,主要是由于槲皮素对癫痫发作的神经保护作用,槲皮素可能是一种潜在的抗癫痫药物。木犀草素通过抑制NF-κB通路的激活,在许多疾病中显示其抗炎活性。木犀草素还可以通过下调MMP 9的表达水平,激活PI3K/Akt信号通路,提高细胞活力,下调细胞凋亡,从而具有神经保护作用[15]。在急性戊四唑(PTZ)模型中研究发现,木犀草素具有抗惊厥作用,对氧化应激有抑制作用,其可能成为治疗癫痫的潜在分子[16]。El-Kott等[17]实验研究表明山奈酚通过增加SIRT1活性和抑制PARP1活性来改善CdCl2诱导的记忆缺陷和海马氧化应激、炎症和细胞凋亡。Guo等[18]研究表明汉黄芩素对红藻氨酸诱导的颞叶癫痫(TLE)大鼠具有明显的神经保护作用。柚皮素具有神经保护作用,在神经系统疾病中运用广泛。冯祝婷等[19]通过动物实验发现柚皮素对新生大鼠缺血缺氧性脑损伤有保护作用,其作用机制可能与柚皮素下调 NOD2、RIP2、NF-κB蛋白的表达,并减少TNF-α、IL-1β的分泌有关。有研究表明在小鼠癫痫模型中,山萘酚和柚皮素表现出良好的抗癫痫活性,可用于治疗全身性肌阵挛、阵挛和强直性癫痫,特别是治疗耐药局灶性癫痫[20]。综上,疏风止痉方的主要活性化合物均具有抗癫痫活性。
综合交集靶点的PPI网络、中药-化学成分-疾病靶点网络和KEGG网络,笔者推测疏风止痉方治疗 DRE 的关键靶点是:PTGS2、HSP90AA1、ESR1、AR、MAPK1、AKT1、MAPK3。通过皮尔森相关系数分析发现PTGS2基因是神经系统疾病中分子机制的重要靶点[21]。有研究报道表明HSP90AA1在子痫前期妇女(PE)和正常血压妇女之间存在差异甲基化,可能在妊娠期应激反应中起调节作用,并可能是PE的一种生理病理机制[22]。ESR1通过介导雌激素在胎盘形成、胚胎着床等妊娠生理过程中发挥重要作用。杨洋等[23]实验研究表明ESR1是雌激素功能实现的核心,可能通过对雌激素的介导作用而参与了PE的发生、发展。近来越来越多研究提出雄激素对大脑的保护作用,雄激素发挥作用需要依赖AR[24]。研究发现PE的发病机制可能与MAPK1通过调控SRF从而导致中性粒细胞过度活化释放NE有关[25]。AKT1基因编码一种丝氨酸/苏氨酸激酶(Akt1),该激酶参与多种神经发育功能,如神经元迁移、依赖生长因子的神经元存活、轴突生长和分支以及胎盘功能过程[26]。MAPK1与MAPK3均属于丝裂原活化蛋白激酶,该类激酶在脑缺血再灌注损伤中被激活,并在缺血性神经元损伤中发挥重要作用[27]。综上,疏风止痉方的核心靶点对大脑神经具有保护作用。
GO富集分析显示潜在靶点富集的生物学功能主要涉及对金属离子、脂多糖、细菌源分子、抗生素、活性氧的反应等,而细胞组分富集分析显示它们主要分布在细胞的膜筏、膜微域、膜区、胞质小泡腔等,分子功能富集分析显示这些重要靶点主要与泛素样蛋白连接酶、磷酸酶、蛋白磷酸酶、细胞因子受体结合和蛋白丝氨酸激酶活性等有关。临床研究发现小胶质细胞还可通过激活Toll样受体(TLR)促进炎性因子产生[28]。在缺氧、缺血、脑外伤及惊厥等神经病理条件下,丝氨酸激酶迅速被激活,调控多种细胞因子和炎性介质的表达及分泌,使多种底物发生磷酸化反应,进一步调控基因的转录,从而细胞增殖、分化、转化及凋亡的过程中发挥关键作用[29]。KEGG富集分析中靶点通路主要涉及AGERAGE信号通路、流体剪应力与动脉粥样硬化、乙型肝炎、人巨细胞病毒感染等通路。AGE-RAGE信号通路的糖基化终末产物受体(RAGE)主要起促炎性介质作用,而AGEs是RAGE的重要配体,可激活转录因子NF-κB引起炎症和氧化应激反应,从而损害大脑神经元和海马的结构及功能[30-31]。流体剪切应力与动脉粥样硬化信号通路通过诱导内皮细胞Fractalkine mRNA的表达增高,使血管硬化产生斑块从而影响血流动力学引发心脑血管疾病[32]。乙型肝炎通路参与多种功能,并调节转录、细胞信号级联、增殖、分化和凋亡[33]。人巨细胞病毒(HCMV)是引起先天性脑发育障碍及免疫缺陷人群脑功能损害的最常见病原体,脑组织是HCMV感染的主要靶器官之一,感染造成的中枢神经系统损害尤为严重[34]。综上,疏风止痉方可能通过炎症、病毒等通路的调节,发挥治疗DRE作用。
分子对接结果显示,疏风止痉方中主要活性化合物与核心靶点蛋白 PTGS2、HSP90AA1、ESR1、AR、MAPK1、AKT1、MAPK3 能够稳定的结合,初步表明疏风止痉方可能作用于 PTGS2、HSP90AA1、ESR1、AR、MAPK1、AKT1、MAPK3 等靶点,通过调控细胞增殖和凋亡发挥抗病毒作用,抑制炎症反应,对大脑神经具有保护作用,从而治疗DRE。
综上所述,本研究采用网络药理学方法探讨疏风止痉方治疗DRE的作用机制,并通过分子对接技术,初步验证疏风止痉方具有抗病毒、抑制炎症反应、神经保护等多重功效,
通过多成分、多靶点、多通路发挥抗病毒、抑制炎症、神经保护等协同作用治疗DRE,从而减少癫痫发病次数。
