3台医科达加速器束流匹配后互换执行容积旋转调强放射治疗计划的剂量准确性分析
2022-10-09李毅吴文婧张龙何瑞欣唐丰文路咏凯张月美袁维柴林燕王龙张晓智
李毅,吴文婧,张龙,何瑞欣,唐丰文,路咏凯,张月美,袁维,柴林燕,王龙,张晓智
1.西安交通大学第一附属医院肿瘤放疗科,陕西西安 710061;2.西安市疾病预防控制中心,陕西西安 710054
前言
国内较大的肿瘤放射治疗中心往往配备两台或两台以上的医用直线加速器。在放疗过程中,一台加速器故障后,患者将不可避免暂停治疗,影响患者的治疗和正常的工作流程。如果放疗中配备多台相同品牌和相同机头结构的加速器,可将多台加速器束流调整一致或调整达到临床允许的变化范围,实现多台加速器束流匹配(Beam Match)[1-4]。如果一台加速器故障,可在未更改放疗计划的条件下,将该加速器治疗的患者直接移到另外一台加速器治疗,并完成准确的放射治疗。多台加速器束流匹配为临床治疗提供了一种高效的解决方案,避免因加速器故障而影响患者的正常治疗[5]。
国外较早开展加速器束流匹配的研究和相关治疗,积累了大量的工作经验[6-9]。国内研究不多,尚未报道3 台加速器束流匹配的研究工作[10-11]。本单位放疗中心近3年来,安装了3 台医科达直线加速器,已实现束流匹配,包括一台最高端配置加速器VersaHD 和两台中端配置加速器Synergy1、Synergy2。3 台加速器配备相同的Agility 机头,包括在等中心处5 mm 的80 对多叶光栅。本研究将不同部位肿瘤的容积旋转调强放射治疗(Volumetric Modulated Arc Therapy,VMAT)计划在3 台医科达加速器互换执行,利用电离室和三维半导体阵列Delta4分别测量所有执行计划的点剂量和相对三维剂量,验证3 台加速器与治疗计划系统(Treatment Planning System,TPS)四者之间数据的一致性,实现不同放疗计划在3台加速器互换执行,并保证临床放疗计划的准确照射。
1 资料与方法
1.1 设备资料
在3 台医科达加速器束流匹配调试过程中,以Synergy2 的束流模型为基准,调整VersaHD 和Synergy1 的束流,达到3 台加速器束流匹配的要求。束流匹配的射线包括6 MV X 射线。因两台Synergy加速器未配置高剂量率能量,3 台医科达加速器匹配的能量未包括高剂量率能量。计划制作采用Monaco治疗计划系统。点剂量测量采用PTW 剂量仪、CC13型电离室和IBA 模体,相对三维剂量测量采用delta4和相关应用软件。
1.2 临床资料
回顾性分析西安交通大学第一附属医院2018年3月至2021年3月收治的头颈部、胸腹部和盆腔部肿瘤患者共18 例,其中鼻咽癌患者3 例、胶质瘤患者3例、中心型肺癌患者3 例、食管癌患者3 例、前列腺癌患者3 例、宫颈癌患者3 例)。中位年龄62 岁(48~70岁)。其中男性12例,女性6例。
1.3 方法
1.3.1 3 台医科达加速器匹配结果加速器束流匹配验收比加速器常规验收的要求更高。在3 台加速器6 MV X 射线标准射野[(10×10)cm2]的百分深度剂量(Percent Depth Dose, PDD)中,水下10 cm 的剂量值波动范围在±1%以内。在3台加速器中,相同射野PDD 的比较,按照3 mm 的距离范围内剂量偏差3%的点数量统计标准(3 mm/3%),γ 通过率达到100%;X 射线在(10×10)cm2和(30×30)cm2射野投照下,离轴曲线主轴上所有的点剂量波动范围要求±1%以内;3 台加速器常规射野[(3×3)~(40×40)cm2]离轴剂量曲线比较中,按照2 mm/2%的标准,γ 通过率达到100%。
1.3.2 CT 定位所有患者采用仰卧位,热塑体膜固定体位。大孔径CT 模拟定位机(Big bore, Philips Medical Systems,Cleveland)行CT肿瘤定位扫描。头颈部肿瘤患者扫描层厚和层间距为3 mm,其余部位肿瘤患者扫描层厚和层间距为5 mm。扫描图像传输至医科达Monaco V5.2 TPS。
1.3.3 计划制作肿瘤放疗科医生在医生工作站上勾画患者的临床肿瘤计划靶区(Planning Target Volume, PTV)和危及器官(Organ at Risk, OAR)后,确定PTV 处方剂量和OAR 限量。鼻咽癌原发病灶PGTVnx 和鼻咽区淋巴结区域PGTVnd 处方剂量为69.96 Gy/33 次,亚临床病灶PTV 处方剂量为66 Gy/33 次,颈部淋巴结区域PTVnd2 处方剂量为54 Gy/28次。肺癌和食管癌PTV 处方剂量为60 Gy/30 次,宫颈癌PTV 处方剂量为50 Gy/25 次,前列腺癌原发病灶处方剂量为70 Gy/35 次,淋巴结区域处方剂量为50 Gy/25 次。物理师使用3 台医科达加速器模型数据分别对每例患者制作VMAT 计划,采用6 MV 能量。每例患者的VMAT 计划,用Synergy1 模型制作好计划后,计划命名为PlanSynergy1,MU 数和计划不变,换为Synergy2和VersaHD模型能量,计划分别命名为PlanSynergy2和PlanVersaHD。肺癌VMAT 计划采用部分往返弧(180°~30°或330°~180°),食管癌VMAT 计划采用3 段往返弧(180°~225°, 330°~30°, 125°~180°),其余肿瘤患者VMAT 计划采用360°往返弧。所有VMAT 计划最小子野宽度设置为7 mm,计算网格设置为2 mm,采用蒙特卡罗计算方法,蒙特卡罗计算的不确定度为每次计算小于1%。
1.3.4 设备校准设备校准包括加速器剂量校准和验证设备校准。在校准之前,根据TG142 报告[12]的要求,对3 台医科达加速器的各项指标(包括机械部分和剂量部分)进行检测,确保3 台加速器的各项指标达到报告要求。剂量校准时,按照国际原子能机构IAEA277 报告[13]要求,对3 台加速器的6 MVX 射线进行测量和标定,在(10×10)cm2大小射野下,加速器出束100 MU 时,水中中心轴上最大剂量深度处的剂量为100 cGy。标定设备采用PTW Universe 剂量仪和PTW 30013探头,经过中国计量研究院校准。相对剂量测量设备采用Delta4(ScandiDos, Sweden)。校准过程中,同一台Delta4 在3 台加速器分别校准。Delta4 校准包括绝对剂量校准和相对剂量校准。绝对剂量校准采用PTW Universe 剂量仪和PTW 30013探头。
1.3.5 计划验证计划验证包括绝对点剂量验证和相对三维剂量验证。在绝对点剂量验证之前,将电离室插入IBA 体模中,行CT 扫描,扫描层厚和层间距分别为3 mm。图像传输至Monaco TPS。将患者的计划参数导入到IBA体模图像中,采用与计划制作相同的计算算法、不确定度和计算网格,剂量计算后,得出电离室的平均剂量。在绝对点剂量测量过程中,将电离室插入IBA 体模中,对称置于加速器治疗床上,根据激光灯指示将电离室中心置于加速器治疗中心上。加速器执行患者的计划,PTW 剂量仪读出电离室测量的点剂量,与TPS 计算结果相比较,允许误差为±3%。测量点剂量时,测量点取剂量梯度变化平坦的区域。在相对三维剂量测量中,首先在TPS中将患者的计划参数导入到Delta4虚拟模体中,采用与计划制作相同的计算算法、不确定度和计算网格,计算Delta4 的三维剂量分布。其次将Delta4 置于加速器治疗床,加速器执行计划,将Delta4 测量的三维相对剂量分布与TPS 计算结果相比较,采用γ 分析方法评估计划的通过率[14]。根据AAPM TG-218 报告[15],本研究剂量阈值设置为10%,采用3 mm/3%的γ分析标准,γ通过率为95%以上即视为符合标准。
18 例患者分别用3 台机器模型制作3 组计划,分别为PlanSynergy1、PlanSynergy1和PlanVersaHD。每一个VMAT计划分别在3台医科达加速器互换执行,利用电离室和Delta4分别测量绝对点剂量误差和相对三维剂量γ通过率。VMAT 计划互换后点剂量和相对剂量的测量结果与TPS 计算的结果比较,评估3 台加速器束流匹配后VMAT计划互换执行的可行性。
1.4 统计学分析
采用SPSS Version 19 软件对数据进行分析,对两组数据比较采用配对t检验,P<0.05 为差异有统计学意义。
2 结果
2.1 点剂量验证结果
同一VMAT 计划(6 MV X 射线)分别在3 台医科达加速器执行,电离室测量的点剂量误差结果如图1和表1所示。所有计划的点剂量验证结果均在3%以内,3 台加速器束流匹配后点剂量验证结果满足临床要求。PlanSynergy1在Synergy1、Synergy2、VersaHD执行时测得的点剂量与TPS 计算的偏差范围为-2.96%~2.90%,PlanSynergy1在Synergy1 执行的点剂量误差小于在Synergy2 和VersaHD 执行的误差(t=11.145,13.532;P<0.05)。PlanSynergy2在Synergy1、Synergy2、VersaHD 执行的点剂量与TPS 计算的偏差范围为-2.90%~2.90%,PlanSynergy2在Synergy2 执行的点剂量误差小于在Synergy1 和VersaHD 执行的误差(t=8.703,8.816;P<0.05)。PlanVersaHD计划在Synergy1、Synergy2、VersaHD 执行的点剂量与TPS 计算的偏差范围为-2.92%~2.95%。PlanVersaHD计划在VersaHD 执行时的点剂量误差小于在Synergy1 和Synergy2 执行的误差(t=11.469, 10.594;P<0.05)。由表1 可知,与Plansynergy1和PlanVersaHD相比,Plansynergy2在3 台加速器执行的点剂量误差更小。
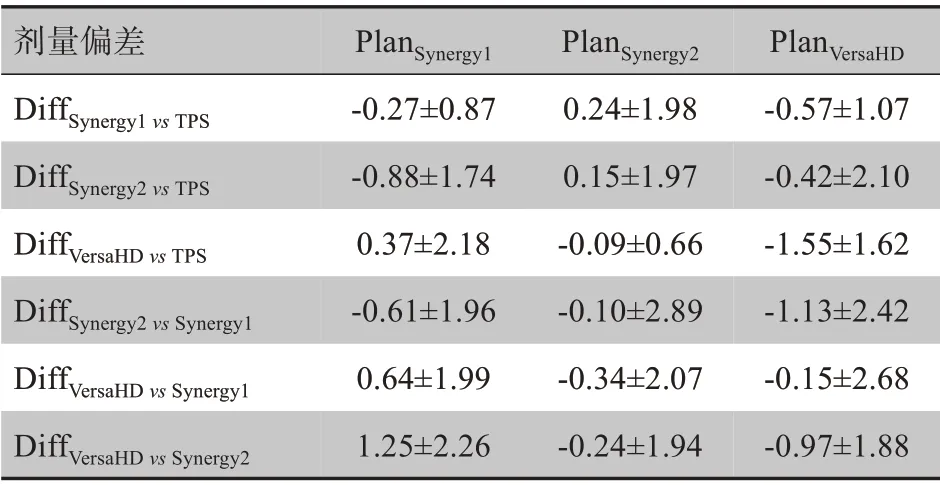
表1 电离室测量的点剂量与TPS计算结果的误差比较(%,xˉ± s)Table 1 Dose error analysis between ionization chamber measurement and TPS calculation(%,Mean±SD)
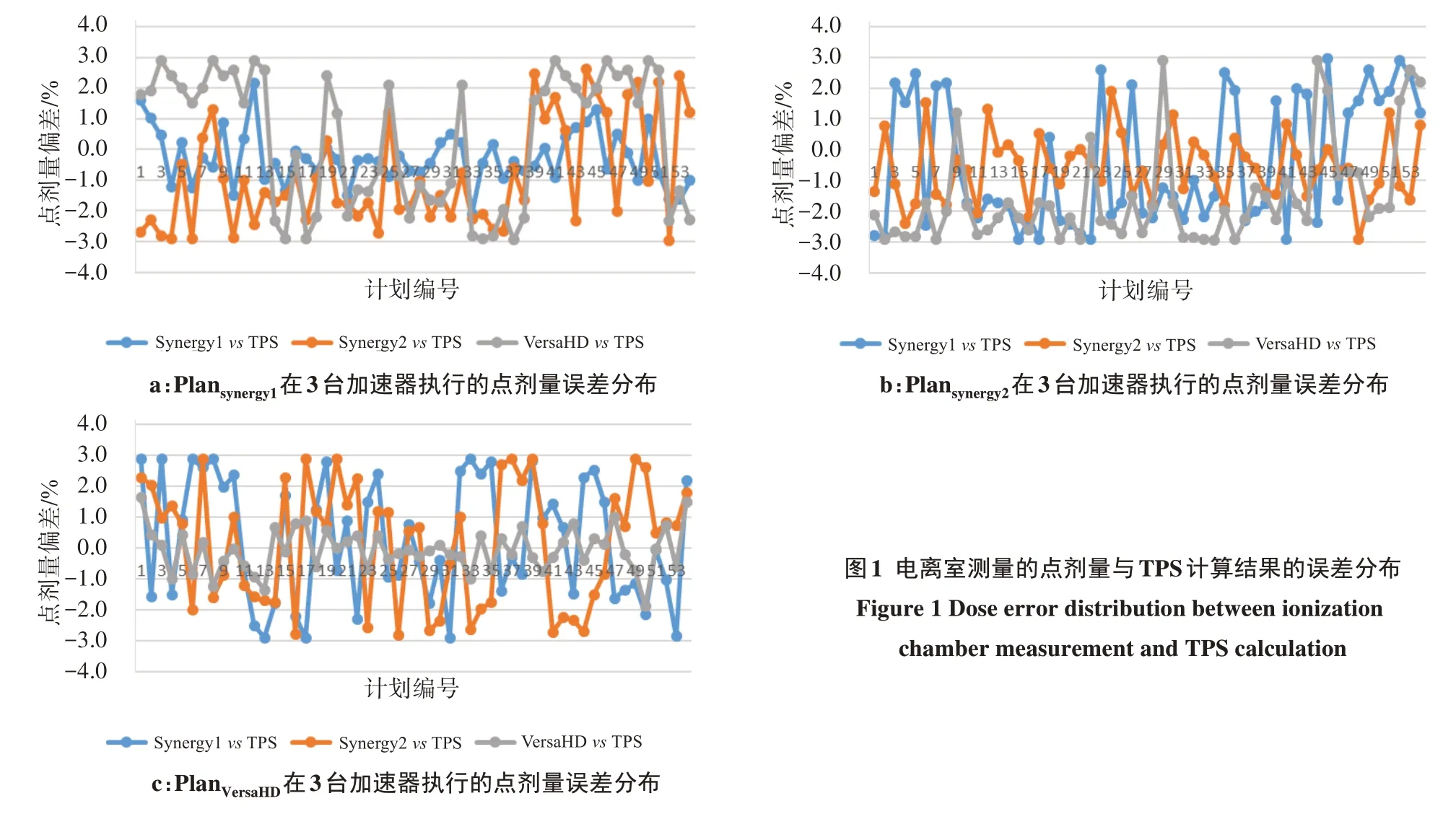
图1 电离室测量的点剂量与TPS计算结果的误差分布Figure 1 Dose error distribution between ionization chamber measurement and TPS calculation
2.2 相对三维剂量验证结果
同一VMAT 计划(6 MV X 射线)分别在3 台医科达加速器执行,Delta4测量的相对三维剂量结果如图2 和表2 所示。所有计划的相对剂量验证γ 通过率均在95%以上,3 台加速器束流匹配后相对三维剂量验证结果满足临床要求。PlanSynergy1在Synergy1、Synergy2、VersaHD 执行的相对剂量与TPS 计算比较的γ 通过率为95.10%~100.00%,PlanSynergy1在Synergy1执行的γ 通过率大于在Synergy2 和VersaHD 执行的γ通过率(t=6.312,6.169;P<0.05)。PlanSynergy2分别在Synergy1、Synergy2、VersaHD 执行的相对剂量与TPS计算比较γ通过率为95.20%~100.00%,PlanSynergy2计划在Synergy2 执行的γ 通过率大于在Synergy1 和VersaHD 执行的γ 通过率(t=5.924,6.286;P<0.05)。PlanVersaHD计划分别在Synergy1、Synergy2、VersaHD执行的相对剂量与TPS 计算比较的γ 通过率为95.00%~100%。PlanVersaHD计划在VersaHD 执行的γ 通过率小于在Synergy1 和Synergy2 执行的γ 通过率(t=9.223,5.982;P<0.05)。
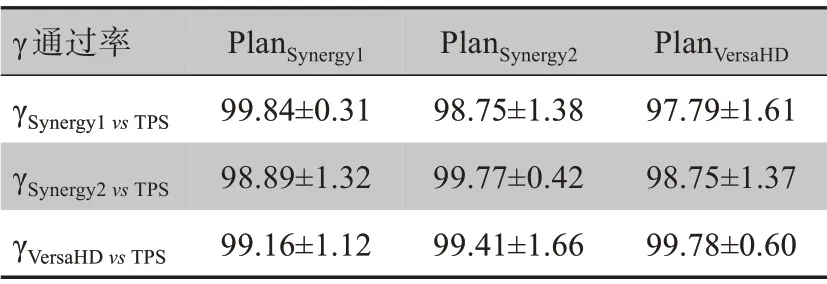
表2 Delta4测量的相对剂量γ通过率比较结果(%,xˉ± s)Table 2 Gamma passing rate analysis of relative dose measured by Delta4(%,Mean±SD)
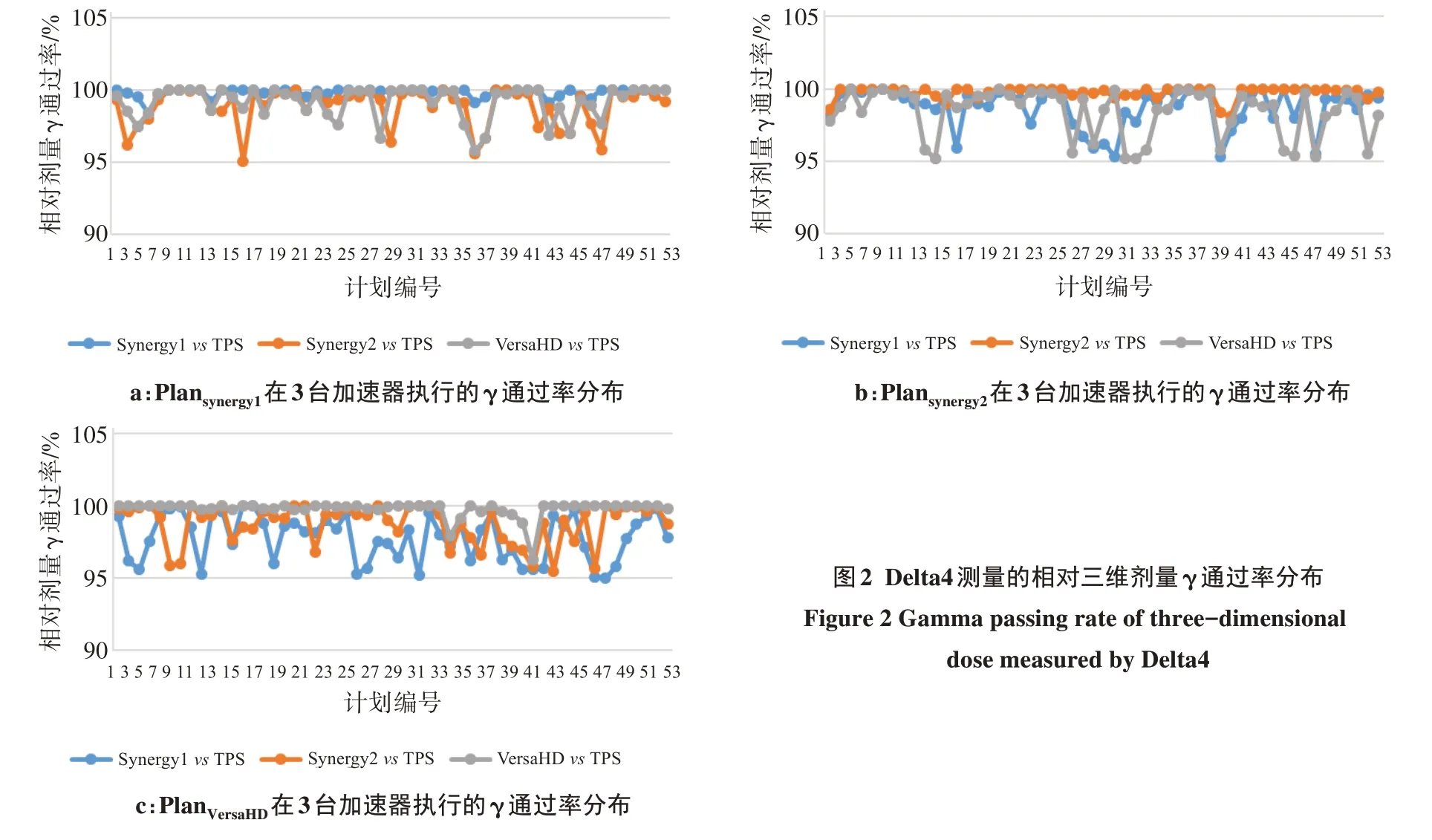
图2 Delta4测量的相对三维剂量γ通过率分布Figure 2 Gamma passing rate of three-dimensional dose measured by Delta4
3 讨论
国内外研究报道,束流匹配后加速器之间具有匹配的剂量学参数,包括输出因子、PDD、离轴剂量分布、能量和剂量率、MLC 位置精度、MLC 速度、机架速度等[16]。如果两台以上的设备来自同一供应商且具有相同的加速器机头配置,可进行加速器束流匹配调试[4]。但束流匹配应用于临床之前需要经过验证方可使用,本研究探讨了3台医科达加速器束流匹配后,同一VMAT 计划(6 MV X 射线)在3 台加速器分别执行,利用电离室和Delta4测量点剂量和相对三维剂量的准确性,评估3 台加速器束流匹配的准确性。
在肿瘤患者体内剂量梯度变化大的区域,肿瘤剂量偏差5%会导致肿瘤控制率10%~20%的变化,正常组织剂量偏差5%会导致危及器官和正常组织并发症概率20%~30%的变化[17]。Krishnappan 等[18]对同一生产厂家且未做束流匹配的6 台加速器的放疗计划点剂量比较,三维适形放射治疗(three Dimension Conformal Therapy, 3DCRT)、调强放射治疗(Intensity Modulated Radiation Therapy, IMRT)和VMAT 计划最大剂量偏差为2.60%,平均偏差小于1.90%。这表明未做束流匹配时,同一厂家不同型号的加速器模型数据剂量差异接近于3%。Kang 等[4]对两台束流匹配的模型计划比较,不同能量和不同部位计划的肿瘤和正常器官的剂量偏差均小于1%。以上两者研究结果得出,束流匹配后的加速器模型数据差异更小。本单位3台加速器束流匹配调试中,3台加速器的射线质偏差小于0.1%,离轴剂量分布平坦度偏差小于1%。本研究中不同部位的同一VMAT计划在3台加速器分别执行,测量的点剂量误差均在3%以内,满足临床要求。方春锋等[19]选取12例患者的IMRT 和VMAT 计划(6 MV 能量),在两台束流匹配的加速器(VersaHD 和Synergy)上分别执行,利用电离室测量两台加速器的点剂量与TPS相比,偏差分别为0.32%±1.32%和0.54%±1.29%,所有计划点剂量误差均在3%以内,这与本研究结果一致。王广善等[1]选取15 例头颈、胸部和腹盆部肿瘤患者的3DCRT和IMRT计划,分别在束流匹配后的两台加速器交叉验证,点剂量最大误差分布为2.36%和-2.8%,结果稍小于本研究结果,这可能是因为治疗技术的不同导致的,VMAT 计划比3DCRT 和IMRT 计划复杂程度高,测量的剂量误差范围可能较大,导致本研究的点剂量最大误差值较大。Ashokkumar等[20]选取30 例头颈、胸部和盆腔部患者VMAT 计划,在3 台束流匹配的加速器交叉执行,测量的点剂量误差在3%以内,这与本研究结果一致。
在相对三维剂量验证中,Plansynergy1、Plansynergy2和PlanVersaHD在3 台加速器执行时,γ 通过率平均值均在98%以上。徐立明等[21]选取5例鼻咽癌EX 加速器模型计划,在IX 加速器执行,相对剂量γ 通过率(3 mm/3%)由92.46%±3.62%降至90.30%±3.14%,平均降幅在2%以上。本研究得出,VMAT 计划在3 台加速器交叉执行,相对剂量通过率按3 mm/3%标准平均幅度变化小于1%,小于徐立明等研究结果,可能因为徐立明等研究中的两台加速器未做束流匹配,导致相对通过率变化幅度较大。这表明束流匹配后,计划在不同加速器交叉执行时,相对剂量通过率的变化幅度更小。方春锋等[19]选取12 例患者IMRT 和VMAT 计划(6 MV 能量),在束流匹配的两台加速器上分别执行,用Arccheck 测量相对剂量γ 通过率,按照3 mm/3%的标准,通过率均超过95%,其两台加速器相对剂量平均通过率差异为0.09%,差异小于本研究结果。这可能与验证设备有关,ArcCheck和Delta4两种半导体探测器设计原理、探头分布位置、探头分辨率和响应均存在差异,在相同γ 标准通过流程的分析下,结果不尽相同[22]。
国内多家放疗单位拥有两台或两台以上的直线加速器。对于束流匹配后两台加速器共用一套模型数据,互换执行放疗计划已有报道,但对于束流匹配中共用哪一套加速器模型结果更加准确的研究未见报道。本研究结果中,与Plansynergy1和PlanVersaHD相比,Plansynergy2在3 台加速器执行的点剂量误差更小,相对剂量γ 通过率较高。这表明3 台加速器中,Synergy2数据(6 MV X 射线)更适合作为共用模型数据,可作为3台加速器的标准模型数据。
最初的验证结果中,Plansynergy1在VersaHD 执行时点剂量和相对三维剂量γ通过率均不满足临床要求。经过调整TPS 中Synergy1 模型数据中的MLC offset值(调整幅度为亚毫米)后,Plansynergy1在3 台加速器的验证结果均满足临床要求。这表明加速器MLC的位置与验证通过率直接相关,且MLC 位置微小的变化会影响束流匹配验证结果[6]。但在加速器使用过程中,随着环境的因素和MLC 的磨损,加速器MLC 的位置会发生变化,所以加速器MLC 位置需要按照周期校准,使得3 台加速器MLC 的位置在使用过程中与验收时保持一致,为3 台加速器束流提供匹配保证。在束流匹配质控中,需要每周对3台加速器束流匹配进行计划的验证,保证3 台加速器使用过程中,束流匹配满足临床要求。
综上所述,3 台医科达加速器束流匹配(6 MV X射线)后,在不需更改计划的情况下,交换执行不同部位的VMAT 计划,治疗误差满足临床要求。在临床工作中,当一台加速故障时,无需更改计划,在束流匹配的另一台加速器治疗,提高临床工作的效率和灵活性。但在交换执行计划之前,必须确保交换的加速器之间满足束流匹配的条件并已得到验证[1,23],方可执行。
