一种自动确定放疗原始等中心的新方法
2022-10-09程龙吴昊天魏晓为秦航蒋红兵时飞跃
程龙,吴昊天,魏晓为,秦航,蒋红兵,4,时飞跃
1.南京医科大学附属南京医院(南京市第一医院)临床医学工程处,江苏南京 210006;2.安徽慧软科技有限公司,安徽合肥 230000;3.南京医科大学附属南京医院(南京市第一医院)肿瘤放疗中心,江苏南京 210006;4.南京市急救中心,江苏南京 210003
前言
近年来,随着计算机技术与医学影像技术的快速发展,放射治疗已经步入精确定位、精确计划、精确治疗的“三精”治疗时代,精准定位作为开展放疗的基础显得尤为重要[1-2]。有文献指出,放疗体位偏移大小与疗效成正相关,过大的偏移量不仅使靶区得不到足够的剂量照射,还会加大对正常组织器官的照射[3-4],开展精确放疗前通常会利用可移动式激光灯在患者的体表贴3个金属标记点(通常称为铅标记点)作为体位参考标记,从而在治疗计划系统中确定放疗的原始等中心[5],该等中心将患者坐标系与治疗机射野坐标系联系起来,原始等中心的准确与否是开展精准放疗的关键基础。由于金属标记点的部分容积效应,标记点会出现在多层CT 图像上,干扰物理师选择CT 参考层面,造成原始等中心的位置偏差。本研究提出一种基于泛洪填充[6-7]与阈值分割[8]的图像算法,并移植到软件中,可以快速精确自动分割放疗标记点并精确计算放疗原始等中心的位置坐标,助力于精确放疗。
1 资料与方法
1.1 资料
1.1.1 临床资料选取南京医科大学附属南京医院40例接受放射治疗的胸腹部肿瘤患者,所有患者均为仰卧位,一般使用体部热塑模将患者固定在碳素纤维底板上。CT 定位扫描:采取与制作固定装置相同的体位,在患者热塑膜表面用记号笔标出激光灯的投影交点,通常用“+”字在患者的正面与侧面分别标记,在标记的中心点分别贴一个直径1.5 mm 的金属标记点,行CT 定位扫描。层厚层间距为5 mm。40例患者中,标记点出现在1 层和2 层CT 图像上的例数各20例。
1.1.2 仪器设备西门子SOMATOM Sensation Open CT 的CT 模拟定位机,配备平板床、主机、辅机以及Vsim 工作站。LAP DORADD 3 的可移动激光定位系统,机架两侧与上方共有3 支激光灯,可实现激光灯沿患者腹背和左右方向移动。瓦里安Eclipse 治疗计划系统,金属标记点(通常称为铅标记点),直径为1.5 mm。
1.2 方法
1.2.1 确定放疗原始等中心的常规方法实施CT 扫描后,将CT 图像传输至瓦里安Eclipse 治疗计划系统,物理师选取标记点所在CT 层面,若标记点出现在多层CT 图像上,选取标记点较为清晰的一层作为参考层面;利用Eclipse 等中心定位十字工具手动移至参考层面3个标记点的中心,水平交线与竖直交线的交点即为原始等中心。图1 为3 个标记点都出现在两层连续CT 层面上的情况,两层标记点同样清晰,给物理师的判断带来干扰。
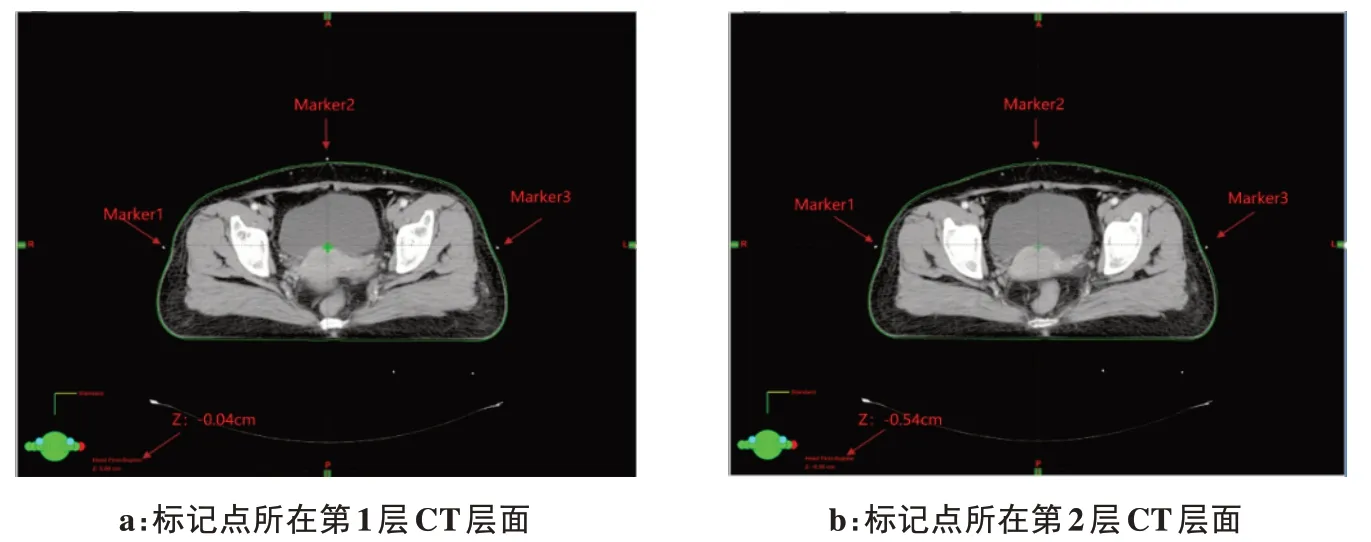
图1 3个标记点出现在两层连续CT层面,层厚5 mmFigure 1 Three marked points appearing in two consecutive CT slices,with a slice thickness of 5 mm
1.2.2 泛洪填充算法基本流程泛洪填充是一种模拟流体扩散过程的算法,该算法被广泛应用在多维空间中确定连通区域的图像处理中,其基本原理是从一个选定的种子点出发,根据种子点与周围像素点灰度值的差值判断周围目标像素点是否与种子点灰度相似,以确定目标点是否属于可填充区域。满足判断,则对该点进行填充,并将该目标点作为新的种子点进行下一轮填充过程。泛洪填充有四连通和八连通两种算法,本文采用四连通算法,在CT 图像上,由于3 个标记点位于体表附近且体表轮廓(Body)与周围空气的像素点灰度值存在突变,本文利用泛洪填充算法提取Body,泛洪算法的实施基于OpenCV开源库,使用Python 语言编写。泛洪填充算法的递归函数F(x,y)如式(1)[9]所示:
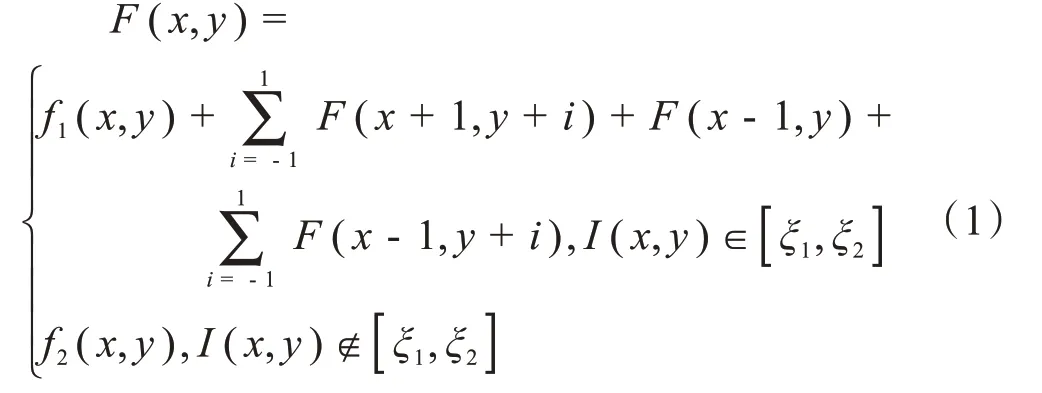
为了减少泛洪带来图像中过多的连通域[10],首先对图像进行预处理,将CT 值低于-150 HU 的像素点置为-150 HU,接着令CT 图像原点的CT 值即F(0,0)为-201 HU,f1(x,y)表示(x,y)处的像素点被认为位于Body 或标记点内,将该点灰度值填充为255;f2(x,y)表示(x,y)在Body 或标记点之外,将该点灰度值填充为0。I(x,y)表示填充条件,通过比较当前像素点与其邻域内种子像素点的灰度值之差来判断是否填充当前像素点;ξ1表示当前像素点与其邻域内种子像素点的灰度值之负差的最大值;ξ2表示当前像素点与其邻域内种子像素点的灰度值之正差的最大值。平面、三维保留最大连通域Body,进一步对Body外扩、内缩、相减操作获取含标记点在内的外扩环形带(即Body外扩减去Body内缩),对外扩环形带以200 HU做阈值分割(大部分金属标记点的CT值皆大于200 HU),此时外扩环形带不仅包含标记点在内,也可能包含人体的表皮组织,通过将低于200 HU值的区域置0,可以过滤此部分干扰。阈值分割后,基本会得到比标记点数量多的连通域,只有极少数情况能够直接得到3 个连通域(即3 个标记点)。标记点的特征有两个,一是3 个标记点在z 轴上的坐标基本一致且连续(其z 轴误差小于2),二是体积基本相同且很小。因此,将所有连通域中心位置按照z轴的坐标排序,取连续3 个z 轴误差不超过2 与体积基本相同的连通域,即左中右3 个标记点,分别将其命名为Marker1、Marker2、Marker3。图2a~图2h 展示了本研究算法对某位患者CT 图像中标记点所在层面的处理流程。
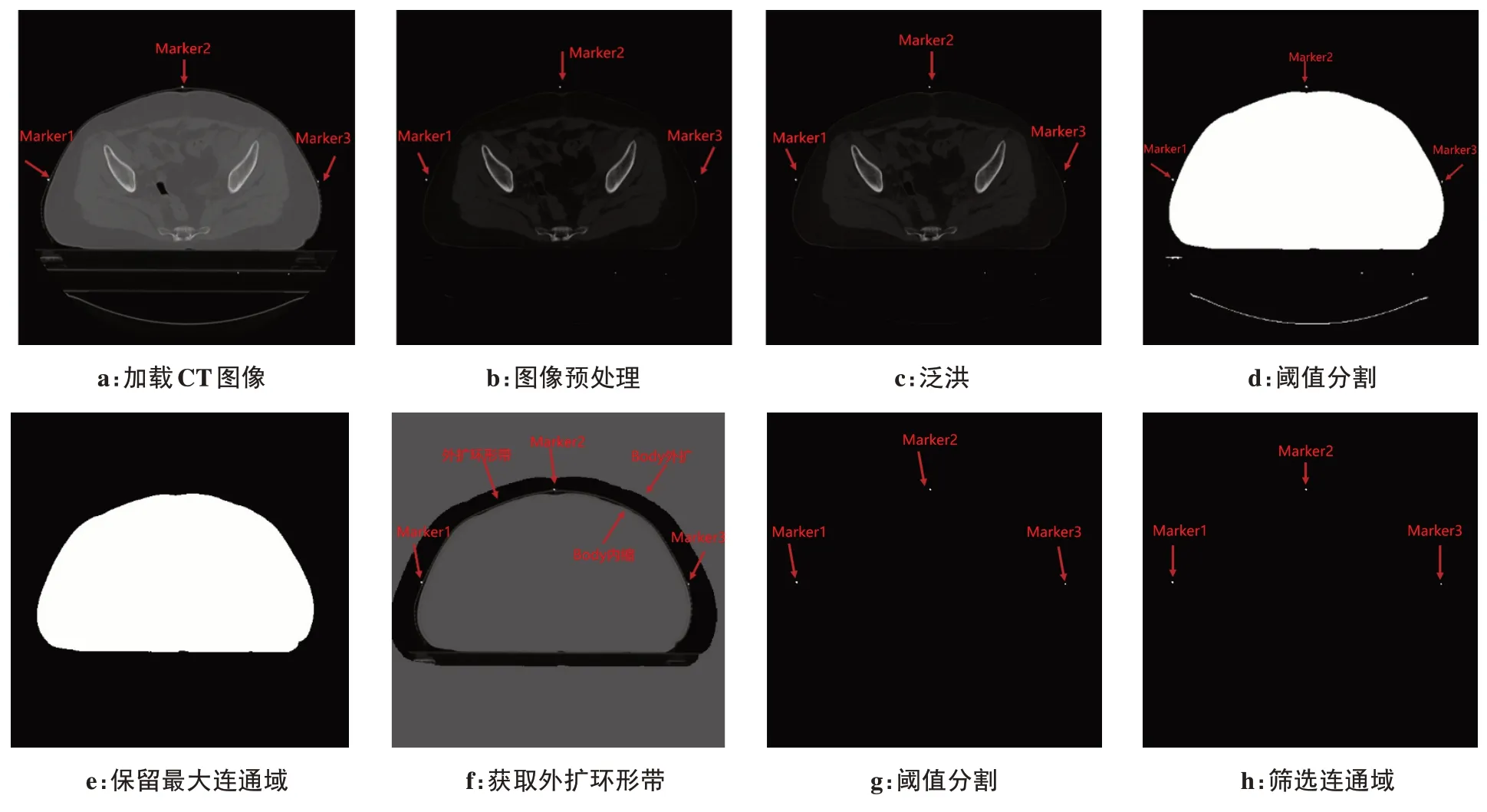
图2 算法处理流程Figure 2 Algorithm processing
1.2.3 确定放疗原始等中心坐标计算3 个标记点Marker1、Marker2、Marker3 的三维质心坐标(x1,y1,z1)、(x2,y2,z2)、(x3,y3,z3),本研究方法确定的原始等中心坐标为(x自动,y自动,z自动),根据几何关系,3个坐标计算公式如下:


其中,x轴坐标为左右方向,y轴坐标为腹背方向,z轴坐标为头脚方向。记常规方法确定的原始等中心坐标为(x手动,y手动,z手动),两种方法确定的原始等中心之间的差异,分别记为Δx、Δy、Δz。其中,Δx=|x自动-x手动|,Δy=|y自动-y手动|,Δz=|z自动-z手动|。
1.2.4 手动勾画标记点结构通过Eclipse计划系统新建3 个新结构,分别将其命名为Marker1、Marker2、Marker3。其中Marker1 代表左侧标记点,Marker2 代表中间标记点,Marker3 代表右侧标记点,选择计划系统中High Resolution Segment(高分辨率分割)菜单工具手动勾画Marker1、Marker2、Marker3左中右3 个标记点的结构。
1.2.5 自动勾画评价参数为了评估本研究提出的标记点自动分割算法效果,以手动勾画标记点结构为参考数据,以自动勾画标记点结构为测试数据,计算两种勾画结构的形状相似性指数DSC值:
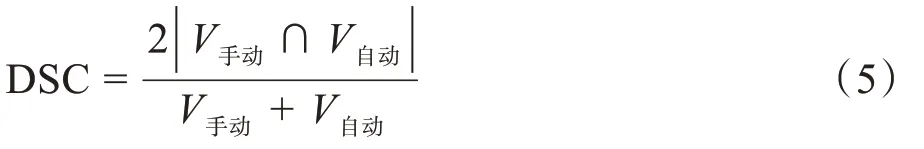
其中,V手动为手动勾画的结构体积,V自动为自动勾画的结构体积。DSC的值越大表示两个轮廓形状的相似性越高,当两种勾画结果完全重合时DSC=1。在图像重合度研究中,DSC>0.7表示为两个结构重合度较好。
2 结果
2.1 两种方法勾画标记点结果
20 例标记点出现在2 层CT 图像中,Marker1、Marker2、Marker3 的DSC 值分别为(0.81±0.07)、(0.81±0.06)、(0.76±0.05)。20 例中所有标记点的DSC 值为(0.79±0.06)。本研究方法实现了标记点的自动分割,与手工勾画相比,结构重合性较好。图3表示手动勾画与自动勾画在某标记点所在CT 层面的勾画效果。
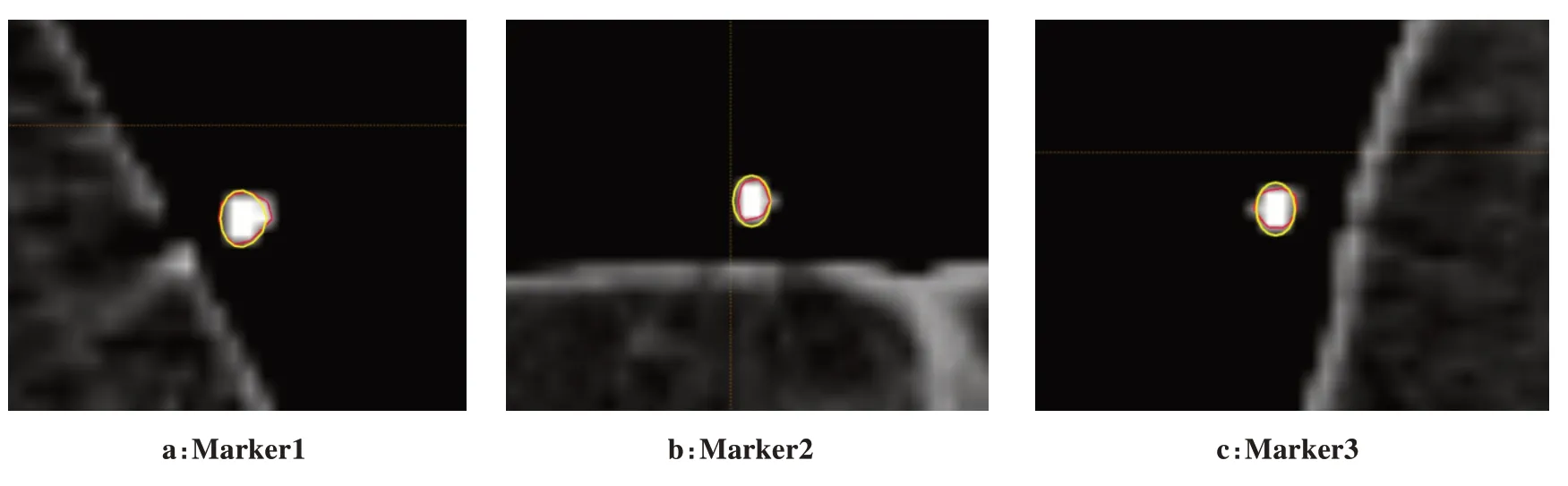
图3 标记点所在CT层面(红色为手动勾画,黄色为自动勾画)Figure 3 CT slices with marked points(the red represents manual delineation,and the yellow represents automatic delineation)
2.2 位置差异结果
常规方法与自动方法确定的40 例原始等中心的x 轴坐标分别为(0.05±0.19)、(0.02±0.18)cm,y 轴坐标分别为(-21.21±1.41),(-21.16±1.42)cm。Δx、Δy的均值分别为0.04、0.05 cm。对于标记点出现在2层CT 图像中的20 例,常规方法只能选择其中1 层作为参考层面设置原始等中心,不可避免导致其z 轴坐标产生一定的误差,本研究实现标记点的自动勾画后,根据式(3)精确计算原始等中心的z轴坐标与Δz。Δz的平均值、标准差、最大值、最小值分别为0.22、0.03、0.26、0.16 cm。
2.3 自动确定放疗原始等中心的软件界面
本研究使用的软件为DeepViewer医学图像处理软件,DeepViewer 软件是由安徽慧软科技有限公司开发的一种基于人工智能与传统图像算法的器官勾画系统。算法通过Pyinstaller 库打包成可供软件调用的exe(可执行程序),软件通过进程间调用的方式访问exe,两者之间的数据交互则通过共享内存的方式进行。本算法在软件使用界面增加了一键计算放疗原始等中心的功能,点击“计算标记点”功能键,可以快速方便获取原始等中心的坐标。40 例原始等中心平均计算时间为6.5 s,操作界面如图4所示。
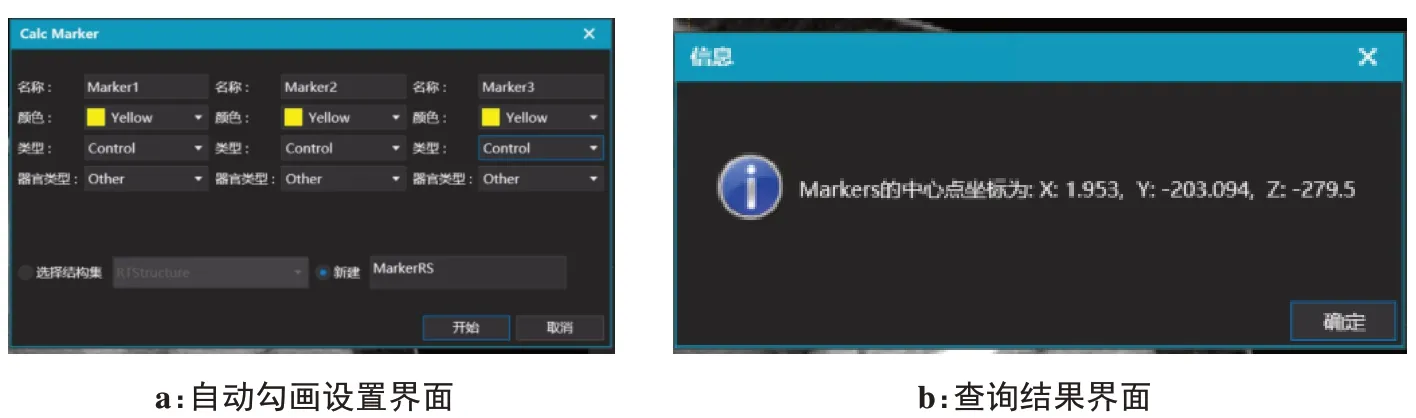
图4 软件展示界面Figure 4 Software display interfaces
3 讨论
在如今的“精确放疗”时代,精确定位与精确计划对精确治疗起着至关重要的作用,国家癌症中心指南指出,开展精确放疗时,等中心精度的质控应该控制在±1 mm[11]。在临床上常用的用于定位的金属标记点,受到射线硬化[12]、散射[13]、部分容积效应[14]的影响,会在CT 图像中产生伪影,甚至会出现在多层CT 图像中,影响图像质量。当标记点出现在多层CT 图像时,会给后续治疗计划系统中原始等中心位置的确定造成一定的干扰。此前陈成等[15]提出一种使用Control Scan 和位置数据计算,精确确定含标记点的CT 层面位置并进行扫描的方法,减少标记点出现在多层CT图像中的频率。
确定原始等中心的常规方法是利用治疗计划系统中的等中心定位十字工具,通过左右、上下平移至标记点的几何中心来实现的。当标记点只出现在1层CT 图像上时,此方法受到不同物理师主观经验和操作习惯的影响,仅使得原始等中心在x轴、y轴方向产生一定的偏差,本研究结果显示,常规方法确定的原始等中心在x轴与y轴上的平均误差小于1 mm,但是当标记点出现在2 层CT 图像上时,无论物理师制作计划时选择哪一层作为参考层面确定原始等中心,都不可避免的会在z轴上产生较大的偏差。本研究方法计算出当标记点完整出现在2 层CT 图像上时,常规方法在z 轴上产生了平均2.2 mm 的偏差。我国现行的国家标准规定,医用加速器的等中心点应该限制在半径为2 mm 的球体内[16]。金孙均等[17]结合现行标准下允许的等中心误差,得到了相对等中心位置处的剂量学测量误差为-0.3%~+0.5%,而2.2 mm 的平均偏差超过了现行标准。朱志鹏等[18]通过移动30 例宫颈癌等中心沿原始z 轴±3 mm 模拟头脚方向系统误差对剂量分布的影响,得出CTV 的D98与PTV 的V95下降平均偏差分别为0.16%与1.72%的结论。Liao 等[19]对乳腺切除术后放疗患者采用容积旋转调强的一项研究显示,等中心z 轴偏移3 mm 对心脏V20与肺V25分别增加2.6%与1.6%。赵永亮等[20]一项研究显示随着定位参考点与肿瘤中心点的空间距离增大,摆位误差也会随之增大。2.2 mm 与上述的2、3 mm同属于mm量级。原始等中心的偏差是摆位误差的来源之一,当标记点出现在2 层CT 图像时,本研究提出的新方法可以有效减少使用常规方法时由于原始等中心z 轴坐标不准确而带来的摆位误差。
此前提出一种在Eclipse 计划系统中通过手动勾画标记点结构,利用坐标关系确定原始等中心的方法,但手动勾画标记点的时间太长,降低了物理师制作计划的效率[21]。本研究根据先前研究的基础,提出一种基于泛洪填充与阈值分割的算法,实现标记点的自动勾画,接近手动勾画的精度,且节约了大量时间,将算法移植到了DeepViewer软件中,实现一键计算原始等中心的功能,平均花费时间为6.5 s。
目前市面上现有的一些商业软件诸如iPlan[22]、QnQ[23]、rtStation[24]、AccuContour[25]等只能勾画危及器官,并不能勾画标记点,由于标记点的直径只有1~2 mm,实现如此小的目标识别有一定难度,本算法实现了自动勾画的效果。但本算法也存在不足之处,对于乳腺肿瘤等患者,由于金属标记点的CT 值与铅丝CT 值较为接近,会给自动分割带来干扰导致标记点自动勾画的准确率下降,还需要进一步研究。
综上所述,使用常规方法时,当标记点出现在1层CT 图像上,受物理师主观经验影响会导致原始等中心在x 轴与y 轴上产生一定的偏差。当标记点出现在多层CT 图像上时,原始等中心会在z 轴上产生较大偏差,本研究提出的通过自动分割标记点并精确计算放疗原始等中心的算法,弥补了以上缺陷,准确率高且耗时达到了令人满意的水平,为实现精准放疗时确定放疗原始等中心提供了有益的参考。
