HSP伴MP感染患儿呼吸道菌群多样性与25(OH)D、IL-6、IgM的相关性
2022-10-09吴秦超金波张显敏
吴秦超 金波 张显敏
过敏性紫癜(henoch-schonlein purpura,HSP)是多系统免疫球蛋白A 介导的儿童常见血管变态反应性疾病,主要表现为非血小板减少性的皮肤紫癜、腹部不适、关节炎或下肢大关节关节痛等关节症状,部分患儿有肾脏、呼吸受累风险[1]。HSP 发生的原因可能是由肺炎支原体(Mycoplasma pneumoniae,MP)感染引起的呼吸道感染,可导致儿童口咽、鼻咽菌群紊乱,还会引起除呼吸道症状以外的广泛组织损伤。近年来有研究报道[2],HSP 患儿常合并MP 感染,1 个月至18 岁儿科患者的MP 感染率为30.3%~37.5%。而B淋巴细胞在HSP 发病中起主要作用,患儿体内B细胞活性增强,分泌到血液中的IgA、IgM 增多,从而增强体液免疫[3]。维生素D 是儿童生长发育必不可少的微量元素,维生素D 可参与骨代谢调节钙磷水平并参与机体免疫反应,现已发现维生素D 与许多儿童常见的感染性自身免疫性疾病的发生发展有关[4]。本研究选取HSP患儿为研究对象,探究HSP 合并MP 感染患儿呼吸道菌群多样性与维生素D、IL-6 及相关免疫指标间的关系。
1 对象与方法
1.1 研究对象
2018年7月至2021年7月期间皖西卫生职业学院附属医院儿科收治的HSP 患儿88 例为研究对象。根据MP 感染情况分未合并MP 感染HSP 组(n=49)与合并MP 感染HSP 组(n=39)。纳入标准:①符合《儿童过敏性紫癜循证诊治建议》[5]中HSP 的诊断标准并经病原学检查确诊;②经血清学方法诊断为MP 感染,表现为外周静脉血MP 抗体阳性[6]。③年龄2~15 岁;④发病时间<5 d;⑤患儿家属知情并签署同意书。排除标准:①患有免疫缺陷性疾病或代谢疾病;②患有意识障碍等神经系统疾病或依从性差,无法配合研究;③近一个月内服用过糖皮质激素、免疫抑制剂或维生素D 补充治疗。未合并MP 感染HSP 组男28 例,女21 例,年龄(7.74±2.14)岁;合并MP 感染HSP 组男19 例,女20 例,年龄(7.62±2.63)岁。两组性别、年龄等一般资料比较,差异无统计学意义(P>0.05),具有可比性。本研究经皖西卫生职业学院附属医院医学伦理会审批并通过。
1.2 呼吸道菌群检测方法
专业护士指导患儿用温开水漱口后用无菌痰液收集器收集患儿咳出的气管深处痰液,保存于-80℃冰箱中待测。对标本作液化处理后加入裂解液裂解,转至硅胶柱中吸附DNA,对目标基因片段进行PCR 扩增,回收扩增产物,用荧光定量系统对PCR 扩增回收产物定量后,采用NovaSeq6000 高通量测序仪(美国Illumina 公司)进行高通量测序,最后用QIIME 序列分析软件分析呼吸道菌群多样性。采用辛普森多样性指数(Simpson index)与香农-维纳指数(Shannon index)[7]评估呼吸道菌群多样性,Simpson 指数越小,Shannon 指数越大,表示物种数量越多。
1.3 25(OH)D、IL-6 及免疫指标检测方法
于研究对象入院次日清晨采集空腹肘正中静脉血10 mL,注入含有抗凝剂的试管中混匀,1 800×g 离心10 min(离心半径10 cm)后取上层血清,保存于-80℃冰箱中待测。25(OH)D 检测:采用XevoTQ-S 型三重四级杆串联质谱仪(美国Waters 公司)及其配套试剂盒,以液相色谱-串联质谱法检测。IL-6 检测:采用双抗体夹心法使用试剂盒(广州祺正生物科技有限公司)进行测定。IgM 检测:采用Cobas e 601 型全自动化学发光免疫分析仪(罗氏诊断产品有限公司)采用免疫透射比浊法进行测定。
1.4 统计学方法
采用SPSS Statistics 21 统计学软件进行分析。计量资料以(±s)表示,采用t检验;计数资料以n(%)表示,采用χ2检验。采用Spearmen 分析患儿呼吸道菌群多样性与血清25(OH)D、IL-6 及免疫指标的关系,P<0.05 表示差异有统计学意义。
2 结果
2.1 两组呼吸道菌群多样性比较
Simpson 指数:合并MP 感染HSP 组大于未合并MP 感染HSP 组,差异有统计学意义(P<0.05);Shannon 指数:未合并MP 感染HSP 组大于合并MP 感染HSP 组,差异有统计学意义(P<0.05)。见表1。
表1 两组Simpson 与Shannon 指数比较(±s)Table 1 Comparison of Simpson and Shannon indices between two groups(±s)

表1 两组Simpson 与Shannon 指数比较(±s)Table 1 Comparison of Simpson and Shannon indices between two groups(±s)
组别合并MP 感染HSP 组未合并MP 感染HSP 组t 值P 值n 39 49 Simpson 指数0.75±0.06 0.36±0.04 36.467<0.001 Shannon 指数0.79±0.10 1.51±0.25 16.924<0.001
2.2 两组25(OH)D、IL-6、IgM 水平比较
IL-6 水平:合并MP 感染HSP 组大于未合并MP 感染HSP 组,差异有统计学意义(P<0.05);25(OH)D 水平:未合并MP 感染HSP 组大于合并MP 感染HSP 组,差异有统计学意义(P<0.05);IgM 水平:未合并MP 感染HSP 组大于合并MP感染HSP 组,差异有统计学意义(P<0.05)。见表2。
表2 两组25(OH)D、IL-6、IgM 水平比较(±s)Table 2 Comparison of 25(OH)D,IL-6 and IgM levels between two groups(±s)
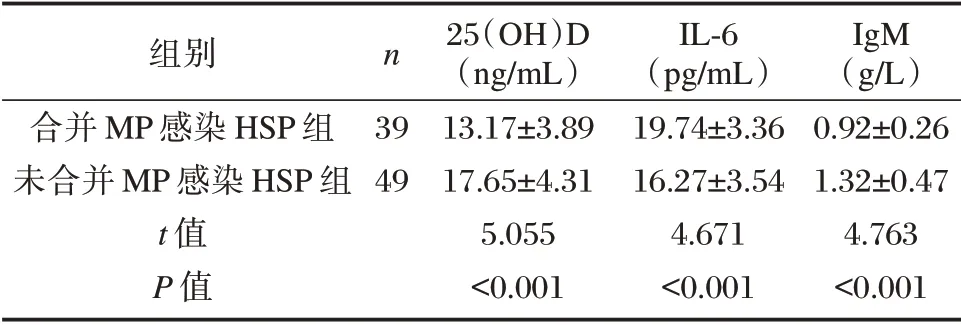
表2 两组25(OH)D、IL-6、IgM 水平比较(±s)Table 2 Comparison of 25(OH)D,IL-6 and IgM levels between two groups(±s)
组别合并MP 感染HSP 组未合并MP 感染HSP 组t 值P 值n 39 49 25(OH)D(ng/mL)13.17±3.89 17.65±4.31 5.055<0.001 IL-6(pg/mL)19.74±3.36 16.27±3.54 4.671<0.001 IgM(g/L)0.92±0.26 1.32±0.47 4.763<0.001
2.3 呼吸道菌群多样性与血清25(OH)D、IL-6 及免疫指标的相关性分析
Spearmen 相关性分析结果显示,HSP 合并MP感染患儿Simpson 指数与血清25(OH)D、IgM 水平呈负相关,Shannon 指数与IL-6 水平呈正相关(P<0.05)。见表3。

表3 呼吸道菌群多样性与血清25(OH)D、IL-6 及免疫指标的相关性分析Table 3 Correlation analysis of respiratory flora diversity and serum 25(OH)D,IL-6 and immune indexes
3 讨论
目前HSP 发病机制尚不完全清楚,但遗传因素和环境因素(接触过敏原、微生物感染、药物等)与HSP 的发生及发展关系密切。MP 是儿童呼吸道感染的主要病原体之一,可引起较轻的上呼吸道感染(咽炎、鼻窦炎)和严重的下呼吸道感染(支气管炎、肺炎)并损害肺外系统[8-9]。目前MP 感染患者存在大环内酯类耐药率升高、多种全身并发症、治疗难度增加等问题[10]。因此,加强相关研究对指导临床开展针对性治疗及改善HSP 合并MP 感染患儿预后具有重要意义。
HSP 患儿紫癜皮肤的毛细血管内的沉积物中含有大量IgA,这主要与T淋巴细胞、B淋巴细胞活性增强,导致产生大量IgA 免疫复合物,进而引起IgA 介导的免疫反应有关。此外,T 淋巴细胞亚群功能失调及相关细胞因子的异常分泌等免疫失衡也是HSP 发病的重要因素之一。HSP 急性期时IgM 水平会发生变化,本研究中合并MP 感染HSP 组患儿血清IgM 水平低于未感染组,Simpson 指数与血清IgM 水平呈负相关,提示MP感染可导致HSP 患儿呼吸道菌群多样性下降,且IgM 水平降低可能与MP 感染所致的HSP 发病有关,这与雷小葆等[11]的研究结果部分相符。白细胞介素-6(interleukin-6,IL-6)是一种重要的细胞因子,主要由Th2 细胞分泌,可促进细胞外微生物病原体保护性抗体的分泌。研究表明[12],IL-6 在MP 感染的发病机制中起重要作用,IL-6-174 G/C基因型会使患者的感染率上升。MP 刺激白细胞介素和肿瘤坏死因子α 的产生,并可引起血管炎,介导HSP 的发生发展。本研究中,合并MP 感染HSP 组患儿的IL-6 水平显著高于未感染HSP 组,提示IL-6 与HSP 合并MP 感染患儿呼吸道菌群多样性密切相关,与张洁等[13]的报道相似。其机制可能是通过引起患儿免疫应答失衡,诱导大量促炎因子生成,形成相应组织的自身抗体与抗原-抗体复合物,沉积于小血管壁上,引起血管炎为主的病理改变有关。维生素D 是一类脂溶性维生素,其在调节免疫功能、炎症反应等方面均具有重要作用,在多种自身免疫性疾病中扮演重要角色。维生素D 在肝脏内转化为25(OH)D,25(OH)D 半衰期长,在血液中浓度稳定,是反映人体内维生素D 水平的最佳指标[14]。维生素D 促进T 调节细胞的诱导,刺激炎症细胞因子如TNFα 的表达。先前的研究表明,维生素D 缺乏会导致呼吸道病原体感染的风险增加,25(OH)D 不足的儿童,更容易受到流感、呼吸道病毒、呼吸道病原菌和MP 等病原微生物的侵害[15]。HSP 患儿血清25(OH)D 水平降低,导致患儿T 细胞功能改变,B 细胞多克隆活化,体液免疫反应总体处于亢进状态,从而促进HSP 的发生及发展。本研究结果显示,HSP 合并MP 感染患儿血清25(OH)D 水平明显降低,且随着患儿感染程度呈逐渐降低趋势,与董显燕等[16]研究结果相一致,这提示25(OH)D 与HSPMP 感染程度有关。
综上,本研究发现HSP 合并MP 感染患儿呼吸道菌群多样性与血清25(OH)D、IL-6 及免疫指标IgM 显著相关,提示上述指标可能参与了HSP合并MP 感染过程。在临床治疗中,治疗原发MP感染的同时,可通过补充免疫抑制剂、维生素D 等途径调节免疫平衡以获得更好的治疗效果。本研究还存在许多不足之处:①研究样本量较少,且研究对象均来自皖西卫生职业学院附属医院,可能由于地域、文化或习俗差异,导致代表性不高。②未对其信号通路及具体机制做深入分析。希望将来可进行多中心、大样本的前瞻性研究,以便更深入地探究HSP 合并MP 感染患儿呼吸道菌群多样性与血清25(OH)D、IL-6 及免疫指标的相关性及机制。
