生鲜猪肉中单增李斯特菌动态生长预测与数值模拟
2022-10-09唐宇宏刘丽敏王晔茹李长城高一辉
唐宇宏,刘丽敏,白 莉,王晔茹,方 婷,李长城,*,高一辉
(1.福建农林大学食品科学学院,福建 福州 350002;2.国家食品安全风险评估中心,北京 100022)
我国是全球最大的生鲜猪肉生产国和消费国,猪肉在我国居民肉类消费量中占比高达65%,因此,与猪肉相关的食品安全问题一直是政府相关监管部门和消费者重点关切的对象。在生鲜猪肉从农场至餐桌的全产业链中,除去药残、违禁添加剂等化学性危害外,由食源性致病菌和腐败菌引发的生物性危害是另一重要方面,这是因为养殖、屠宰、切割、运输、贮藏、销售等环节均不可避免地存在交叉污染。然而,猪肉本身营养丰富,因交叉污染引入的食源性致病菌在适当条件下可以快速生长繁殖,进而对消费者的健康造成威胁。在生鲜猪肉及其屠宰加工环境中,单增李斯特菌是常被检出的主要食源性致病菌,该菌具有耐低温(4 ℃)且能适应较宽范围pH值和高盐浓度等生长特性,曾被世界卫生组织列为四大食源性致病菌之一。人体摄入被单增李斯特菌污染的食品可引起李斯特菌病,其致死率高达30%。据报道,欧盟每年单增李斯特菌感染患者大约有1 300 例;同时,美国疾病预防控制中心的统计结果显示其每年感染病例大约为1 600 人。在中国,虽未见有大规模的单增李斯特菌感染爆发,但近年来包括生鲜肉制品在内的多类食品或原材料中均有不同程度的检出报道,并且零星散发病例呈逐年增多趋势。因此,生鲜猪肉中单增李斯特菌的污染及其引发的风险不容小觑,应加强监管和防范。
作为微生物定量风险评估的重要工具,预测微生物学模型通过构建微生物生长动力学方程,结合计算机语言程序,可以客观估计食品中的微生物在不同环境条件下的动态变化。目前,国内外关于生鲜猪肉中预测微生物学模型的研究主要侧重于腐败菌方面,而关于生鲜猪肉中单增李斯特菌生长预测模型的研究相对较少。张培培等测定了4~16 ℃贮藏条件下冷鲜肉中单增李斯特菌的生长曲线,并通过现有的预测微生物学软件或平台(DMFit)构建其生长模型;王凯等构建了冷鲜肉中单增李斯特菌在4~28 ℃范围内的生长模型,并开展相关暴露评估;陈尔凝等建立了生鲜猪肉中单增李斯特菌与假单胞菌的竞争生长初级模型,但尚未构建二级模型。上述研究主要以冷鲜肉为研究对象,其测试温度未覆盖支持单增李斯特菌生长的全体生理温度范围,模型对超出实验温度范围的生长预测存在明显的局限性。当前的国内生鲜猪肉市场上,除了近年来流行的冷鲜肉外,处于常温或更高环境温度下贮销的热鲜肉仍占据大量的份额。因此,构建适合描述更宽泛温度范围的单增李斯特菌生长预测模型具有迫切需求。另一方面,上述研究均采用两步法逐步构建生鲜猪肉中单增李斯特菌生长的初级模型和二级模型,与近年来常被报道的一步法相比,两步法构建的模型累积误差相对较大,且实验研究过程耗时耗力。此外,实际的屠宰加工、运输以及销售贮藏过程中,环境温度波动难以避免,现有模型缺乏波动温度条件下生鲜猪肉中单增李斯特菌生长的验证研究。
本研究旨在采用一步法构建波动温度条件下生鲜猪肉中单增李斯特菌动态生长预测模型,并开展相关验证实验以评估模型的准确性;同时,结合实测的家庭冰箱温度变化,开展单增李斯特菌动态生长数值模拟,以期为开展生鲜猪肉中单增李斯特菌的定量风险评估提供基础。
1 材料与方法
1.1 材料与试剂
生鲜猪肉(肉糜)购买于福建福州金山大润发超市,抽真空包装后于福建康普顿辐照技术有限公司辐照处理(Co,剂量15 kGy),并于-80 ℃冻藏。
大豆酪蛋白琼脂(tryptose soya agar,TSA)培养基、脑-心浸萃液态(brain heart infusion broth,BHI)培养基 广东环凯微生物科技有限公司;利福平(rifampicin,Rif) 北京索莱宝科技有限公司;蛋白胨粉 杭州微生物试剂有限公司。
1.2 仪器与设备
BSC-1000生物安全柜 新加坡ESCO公司;LRH-250生化培养箱 上海一恒科学仪器有限公司;FRIOCELL变温培养箱 德国MMM公司;Bag Mixer-400均质拍打器 法国Interscience公司;ST-16R高速冷冻离心机 美国Thermo Fisher公司;T-100磁力搅拌器 上海力辰邦西仪器有限公司;Whirl-Pak-207 mL无菌均质袋 美国Nasco有限公司;THZ-92P气浴恒温振荡器 上海博迅医疗仪器股份有限公司;GI80TW立式高压灭菌锅致微(厦门)仪器有限公司;JCS-3000电子天平 深圳凯丰集团有限公司;BSA224S电子天平 赛多利斯科学仪器(北京)有限公司。
1.3 方法
1.3.1 菌株培养与接种菌液的制备
所选用的单增李斯特菌菌株(共3 株),均依据GB 4789.30—2016《食品微生物学检验 单核细胞增生李斯特氏菌检验》,从福州市售的生鲜猪肉中分离所得。参照Fang Ting等的方法,分别将3 株单增李斯特菌诱导为对Rif耐受质量浓度为100 mg/L的抗性菌株,并于-80 ℃甘油管中冻藏。短期使用时,将冻藏菌种管中的单增李斯特菌接种至10 mL Rif添加质量浓度为100 mg/L的BHI溶液,于37 ℃隔夜培养后,经平板划线法接种于TSA/Rif平板,再于37 ℃培养24 h,最后于4 ℃培养箱中保存,并且每周重新转接至新制备的TSA/Rif平板以保持其活性。每次实验前1 d,从3 皿保存单增李斯特菌的TSA/Rif平板上挑取单个菌落,分别转移至10 mL Rif添加质量浓度为100 mg/L的BHI溶液中,并于37 ℃恒温振荡器130 r/min培养18~20 h;菌液经4 ℃、5 000 r/min离心15 min后去掉上清液,菌体经无菌蛋白胨水(质量分数0.1%)洗涤2 次后再悬浮于5 mL蛋白胨水中;最后,将3 株单增李斯特菌菌液混合,制备成15 mL菌悬液,并经蛋白胨水梯度稀释,使得单增李斯特菌的浓度为4.0~5.0(lg(CFU/g)),备用。
1.3.2 样品接种、生长实验及计数
无菌条件下,称取若干份猪肉样品(5±0.2)g/份于无菌均质袋中,再向每袋样品中接种100 μL前述已制备单增李斯特菌悬浮液,并适当揉捏均质袋,使菌液与样品充分混合,随后将均质袋口卷封,以防异物进入。将接种后的猪肉样品置于温度可编辑的变温培养箱中,并分别在7 组任意设置的动态温度条件(DT-1、DT-2、DT-3、DT-4、DT-5、DT-6、DT-7)下培养,开展动态生长实验。其中,温度曲线DT-1、DT-2、DT-3的波动范围分别为4~43、3~43 ℃和4~16.5 ℃,时长分别为85、79.5 h和696 h,此3 组动态条件下的生长数据用于模型构建;温度曲线DT-4、DT-5、DT-6、DT-7的温度波动范围分别为3~45、4~43、2~43 ℃和1~37 ℃,时长分别为130、102、102.5 h和93 h,此4 组动态条件下的生长数据用于模型验证。此外,将接种的猪肉样品分别置于温度为4、20 ℃和37 ℃的恒温培养箱中开展生长实验,其生长数据同样用于模型验证。所有条件下的生长实验均独立重复两次,并按预设的时间间隔取样。取样时,将20 mL无菌蛋白胨水加入均质袋中,并置于均质拍打器中以最大速度正、反两面各拍打2 min,均质液经梯度稀释后涂布于TSA/Rif平板,随后将TSA/Rif平板置于37 ℃条件下中培养,48 h后计数,最终生鲜猪肉中单增李斯特菌浓度以lg(CFU/g)或 ln(CFU/g)表示。
1.3.3 生长模型
分别采用Baranyi模型和Two-compartment模型描述猪肉中单增李斯特菌的生长数量随时间的变化,其中,Baranyi模型表达式及初始条件为:
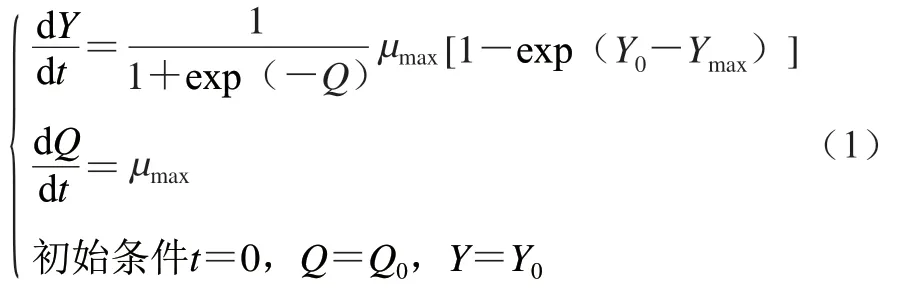
式中:为与时刻对应的单增李斯特菌浓度(ln(CFU/g));、分别为猪肉中单增李斯特菌的初始菌浓度和最大生长浓度(ln(CFU/g));为猪肉中单增李斯特菌的最大比生长速率/h;为描述单增李斯特菌生理状态的变量。
在Two-compartment模型中,单增李斯特菌的细胞被分为两部分,分别为处于休眠期的细胞和处于分裂期的细胞,其表达式和初始条件为:
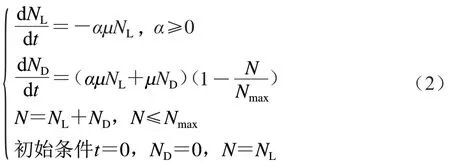
式中:、、分别为处于休眠期、分裂期的单增李斯特菌细胞数量以及单增李斯特菌细胞总数/(CFU/g);为单增李斯特菌的最大生长浓度/(CFU/g);为分裂期细胞的最大比生长速率/h;为休眠期细胞向分裂期细胞的转化速率(0<<1)。
猪肉中单增李斯特菌的生长速率()受温度的影响,两者相互关系可通过Cardinal模型描述,其表达式如下:

式中:、、为猪肉中单增李斯特菌的最低生长温度、最适生长温度和最高生长温度/℃;为最适温度()下的生长速率,亦即最适生长速率/h;此外,该模型假设当<或>时,0。
1.3.4 数值分析与优化

1.3.5 模型评价与验证
通过均方根误差(root mean square error,RMSE)赤池信息量准则(akaike information criterion,AIC)值评价两种模型的适用性及拟合优良度,其计算如式(5)、(6)所示:

式中:为实测值的数量;RSS为残差平方和;为模型参数数量。

1.3.6 模型应用
生鲜猪肉销售贮存过程中,环境温度波动以及潜在的温度失控往往难以避免。因此,当模型动力学参数验证完成后,即可用于预测冷藏温度及失控温度条件下生鲜猪肉中单增李斯特菌的生长行为。本研究通过电子温度计记录某家庭冰箱150 h内的温度波动,并基于此条件模拟生鲜猪肉家庭贮藏过程中单增李斯特菌的数量变化。
2 结果与分析
2.1 模型构建及生长动力学参数估计
辐照后的猪肉样品经PALCAM平板划线培养,未检出单增李斯特菌,样品中单增李斯特菌的初始接种浓度为2.5~3.2 (lg(CFU/g)),3 组波动温度条件(DT-1、DT-2、DT-3)下,猪肉样品中单增李斯特菌的生长曲线如图1所示。动态温度曲线DT-1和DT-2几乎完整覆盖支持单增李斯特菌生长的温度范围,两组猪肉样品中单增李斯特菌的生长浓度均在实验末期左右达到最大值;温度曲线DT-3保持于4 ℃,仅在403~411 h处短暂升温至17.6 ℃,该条件下单增李斯特菌的生长数据主要用于计算机建模程序对最低生长温度的优化计算,在测试时间范围内,单增李斯特菌的生长均未到达稳定期。

图1 波动温度条件下生鲜猪肉中单增李斯特菌生长与拟合曲线Fig. 1 Growth and fitted curves of L. monocytogenes in fresh pork under dynamic temperatures
3 组波动温度(DT-1、DT-2、DT-3)条件下,猪肉样品中单增李斯特菌的生长实验数共计92 个数据点,通过一步动态法对其进行全局拟合分析,构建初级模型与二级模型的组合模型,即Baranyi-Cardinal模型和Twocompartment-Cardinal模型。表1为一步法统计分析结果以及模型相关动力学参数。可知,Baranyi-Cardinal模型和Two-compartment-Cardinal模型中,各参数的拟合值估计均具有显著统计学意义(<0.05),由两种模型估计的生鲜猪肉样品中单增李斯特菌的最大生长浓度分别为20.88(ln(CFU/g))(或9.07 (lg(CFU/g)))和20.92(ln(CFU/g))(或9.09 (lg(CFU/g)))。Baranyi-Cardinal模型和Two-compartment-Cardinal模型估计的猪肉样品中单增李斯特菌的最低生长温度、最适生长温度、最高生长温度分别为0.94、38.37、45.36 ℃和1.03、37.96、45.58 ℃。据ICMSF报道,单增李斯特菌的最低生长温度、最适生长温度和最高生长温度分别为-0.4、37 ℃和45 ℃。本研究中,两种模型估计的3 个温度参数无显著差异,且均与文献数据接近。虽然两种模型估计的单增李斯特菌的温度参数和最大生长浓度相近,但两者对其迟滞期的定义具有差别。Baranyi-Cardinal模型中,单增李斯特菌的迟滞期与参数相关,其估计值为-2.207;Two-compartment-Crdinal模型则以参数(=0.135)定义单增李斯特菌休眠期细胞向分裂期细胞的转化速率,也即定义了其迟滞期。此外,两种模型的整体RMSE均仅为0.19(lg(CFU/g)),且AIC值相近(分别为-295.85和-297.91),表明两者均适合用于描述生鲜猪肉中单增李斯特菌的生长行为,且具有等同的拟合优度。

表1 Baranyi-Cardinal模型和Two-compartment-Cardinal模型的动力学参数估计Table 1 Kinetic parameter estimates of Baranyi-Cardinal model and Two-compartment-Cardinal model
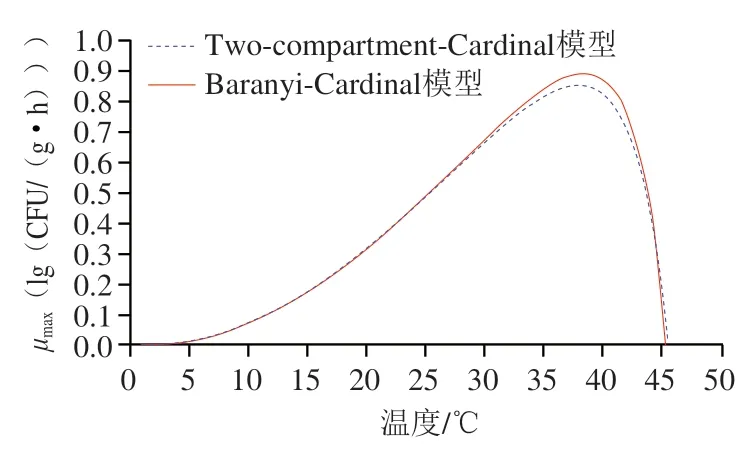
图2 温度对生鲜猪肉中单增李斯特菌最大比生长速率(μmax)的影响Fig. 2 Effect of temperature on maximum specific growth rate (μmax) of L. monocytogenes in fresh pork
根据一步法求解的模型参数(、、、、),可以获得猪肉样品中单增李斯特菌的最大比生长速率与温度关系曲线。由图2可知,通过Baranyi-Cardinal模型和Two-compartment-Cardinal模型计算的单增李斯特菌的生长速率的无明显差异;当<时,最大比生长速率随着温度的升高而增大;而>时,最大比生长速率随着温度的升高而急剧减小。同时,图2还比较了本研究结果与相关文献报道数据之间的差异。张培培和Lee等分别通过Baranyi模型估算了冷鲜猪肉(4~16 ℃)和猪皮(4~30 ℃)中单增李斯特菌的生长速率,其报道结果与本研究结果相近。王凯等同样通过Baranyi模型描述4~28 ℃条件下冷却猪肉中单增李斯特菌生长,并通过Ratkowsky方程对生长速率进行拟合,其估算的最低生长温度()为4.91 ℃,显然大于本研究以及文献报道的结果;Luo Ke等构建了经过紫外照射的生鲜猪肉(5~35 ℃)中单增李斯特菌的生长模型,其预测的生长速率略低于本研究的结果,上述差别可能是因为单增李斯特菌菌株差异所致,这也提示生鲜猪肉单增李斯特菌生长预测及风险评估中应考虑耐冷菌株的生长特性。此外,Huang Lihan基于一步动态构建非腌制熟猪肉中单增李斯特菌生长模型(Two-compartment-Cardinal模型),其估计的单增李斯特菌生长速率、最适和最高生长温度均显著小于本研究的结果,这主要由于其供试猪肉样品中含有质量分数0.3%三聚磷酸钠和2.5%乳酸钠,单增李斯特菌的生长被抑制。
2.2 波动及恒定温度条件下的模型验证
虽然Baranyi-Cardinal模型和Two-compartment-Cardinal模型对猪肉中单增李斯特菌的生长具有等同的拟合优度,但后者的AIC值略小,故仅对Two-compartment-Cardinal模型开展验证。图3为4 组波动温度(DT-4、DT-5、DT-6、DT-7)及3 组恒定温度(4、20、37 ℃)条件下单增李斯特菌生长的模型预测与实测曲线,动态及等温条件下的实测数据均与预测曲线相近,表明模型可以准确地预测猪肉中单增李斯特菌的生长。统计分析表明,4 组动态生长条件下的RMSE分别为0.37、0.13、0.32(lg(CFU/g))和0.25(lg(CFU/g)),3 组等温条件下的RMSE分别为0.48、0.21(lg(CFU/g))和0.46(lg(CFU/g))。此外,动态及等温条件下,预测曲线的残差服从均值为-0.02(lg(CFU/g))、标准差为0.29(lg(CFU/g))的正态分布(图4),大约有91.5%残差处于±0.5(lg(CFU/g))范围内,进一步表明,基于一步动态法构建的模型对猪肉中单增李斯特菌的生长具有较为准确的预测能力。
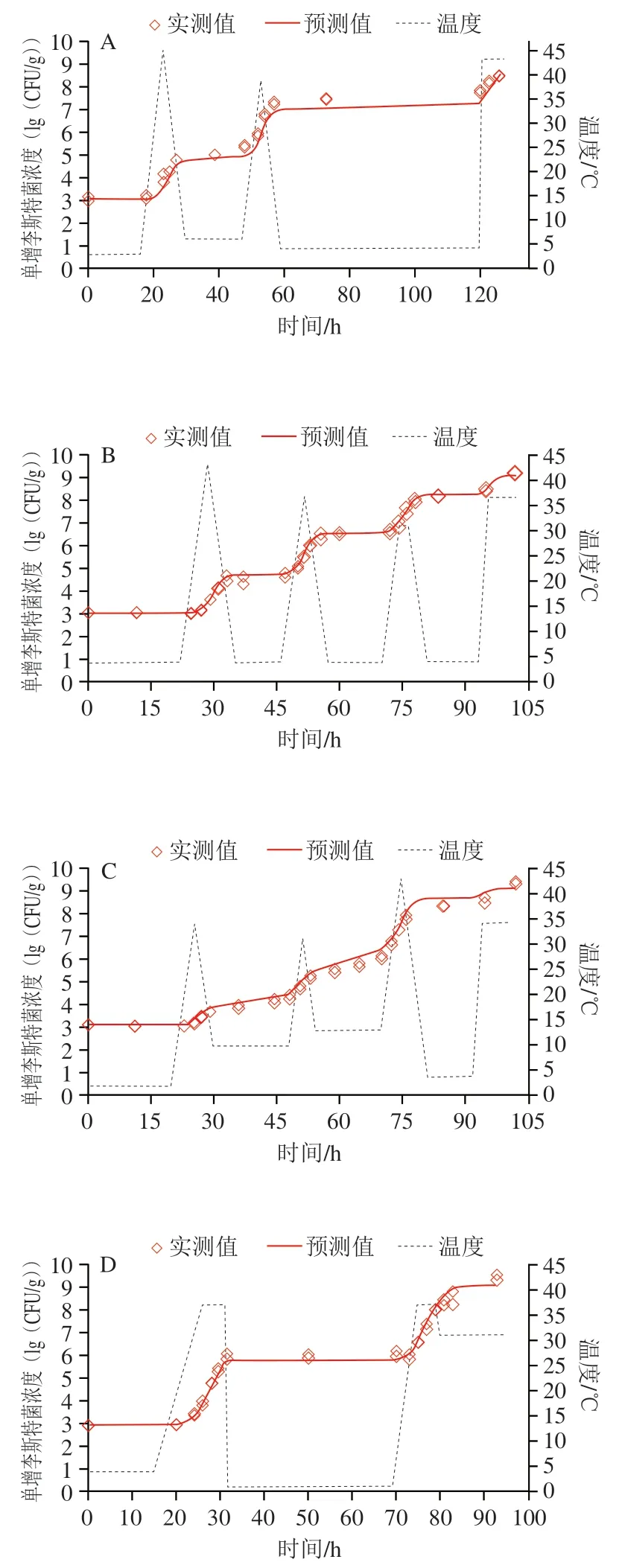

图3 动态及等温度条件下生鲜猪肉中单增李斯特菌生长与预测Fig. 3 Growth and prediction of L. monocytogenes in fresh pork under dynamic and isothermal temperatures

图4 模型验证残差(预测值、实测值)拟合分布Fig. 4 Distribution of residual errors (predicted and actual values) for model validation
2.3 生鲜猪肉家庭冰箱贮藏过程单增李斯特菌生长数值模拟
生鲜猪肉销售贮存过程中,环境温度波动及潜在的温度失控现象难以避免,James等曾报道家庭冰箱的运行温度通常略高于厂家推荐的工作温度,并且冰箱门的开启频率及时间等也会引起冰箱温度发生变化;另外,据文献显示,正常使用的家庭冰箱冷藏室平均温度在3.5~9.3 ℃之间。因此,本研究随机采集某一正常使用的家庭冰箱冷藏室温度曲线,并使用上述构建的模型模拟猪肉贮存过程中单增李斯特菌的生长,其结果如图5A所示。可知,在贮存前期(前24 h内),冷藏室的最低和最高温度分别为5.8 ℃和13.3 ℃,可能由于冰箱门开启较为频发或开启时间过长,其整体运行温度相对较高、波动范围较大;大约24 h后,冷藏室的温度基本保持在4.6~8.8 ℃,整个贮存期(150 h)内单增李斯特菌浓度增加1.18(lg(CFU/g))。因此,假若生鲜猪肉在购买前已被单增李斯特菌污染,在此条件下贮藏时,单增李斯特菌可继续繁殖,消费者具有潜在的被感染的风险。倘若将当前冰箱的温度整体下调或上调2 ℃,根据模型预测的猪肉中单增李斯特菌生长模拟曲线分别如图5B、C所示。计算结果表明,如果冰箱温度整体下调2 ℃,同样的贮存期内,单增李斯特菌浓度仅增加0.26(lg(CFU/g))(图5B);如果冰箱温度整体上调2 ℃,其浓度则增加2.74(lg(CFU/g))(图5C)。因此,严格低温监控对于防止生鲜猪肉贮藏时单增李斯特菌的生长具有重要意义。需要指出的是,实际销售的猪肉产品通常含有一定数量的背景微生物菌群,并且已有文献报道食品中的背景菌群可能对单增李斯特菌的生长造成抑制。本研究构建的数学模型以辐照处理的猪肉为对象,未考虑背景菌群与单增李斯特菌之间的相互竞争效应,因此,模型可能高估单增李斯特菌的生长,但从风险评估的角度而言,此种情况属于“失效-安全(fail-safe)”,有利于风险的控制。
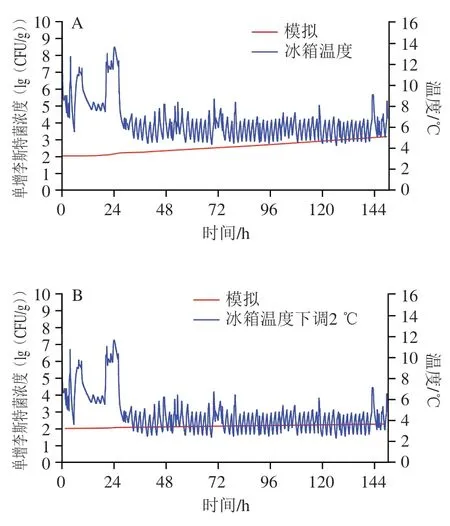

图5 生鲜猪肉家庭冰箱冷藏过程中单增李斯特菌生长数值模拟Fig. 5 Numerical simulation of the growth of L. monocytogenes in fresh pork under cold storage in household refrigerator
3 结 论
基于3 组波动温度条件下猪肉中单增李斯特菌生长数据,通过一步动态法分别构建Baranyi-Cardinal模型和Two-compartment-Cardinal模型;两种模型具有等同的拟合优度,由其估计的最低、最适、最高生长温度分别为0.94、38.37、45.36 ℃和1.03、37.96、45.58 ℃,最适生长速率分别0.891 h和0.858 h,最大生长浓度分别为9.07(lg(CFU/g))和9.09(lg(CFU/g));通过另设的4 组动态和3 组等温条件下的生长实验对Twocompartment-Cardinal模型进行验证,分析结果表明,构建的模型可以准确预测猪肉中单增李斯特菌的生长,其RMSE介于0.13~0.48(lg(CFU/g)),且验证实验数据的整体残差服从均值为-0.02(lg(CFU/g))、标准差为0.29(lg(CFU/g))的正态分布,大约有91.5%的残差处于±0.5(lg(CFU/g))范围内;此外,本研究基于实测的家庭冰箱温度数据,对生鲜猪肉家庭贮藏过程单增李斯特菌的生长进行数值模拟,表明模型潜在的应用性,同时提示生鲜猪肉单增李斯特菌防控过程中低温贮藏的重要性。
