微波冻融法预处理用于酵母菌落PCR检测
2022-10-08彭志清李寅琛吴升山曾宪海
李 闯, 彭志清, 李寅琛, 吴升山,2,3, 林 鹿,2,3, 曾宪海,2,3
(1.厦门大学能源学院,福建 厦门 361102;2.福建省生物质清洁高值化技术工程研究中心,福建 厦门 361102;3.厦门市生物质清洁高值化利用重点实验室,福建 厦门 361102)
酿酒酵母是一种典型的模式微生物,在生命科学研究中发挥着重要作用.因具备生长迅速、基因操作简单、同源重组能力强等特点[1-2],酿酒酵母成为真核基因表达中最常见的宿主系统.随着基因编辑技术的高速发展,酿酒酵母在大规模DNA片段组装等合成生物学领域已有广泛的应用[3-4].
在酵母底盘中进行基因操作,为确保其准确性,需对DNA片段引入或删除进行鉴定,常规步骤包括单菌落扩大培养、收集并裂解细胞、提取高纯度DNA模板及PCR检测[5],在进行大规模筛选工作时,该方法往往成本高且效率低;相反,菌落PCR检测方式无需预先分离或纯化DNA,而是以菌体为模板来完成靶标序列的扩增[6],可以有效避免上述弊端.然而与传统原核微生物不同,酿酒酵母细胞壁由复杂多糖和少量蛋白质组成,具有较强韧性.特殊的细胞壁结构使其难以被简单的高温程序破坏,因此将酿酒酵母直接作为模板进行PCR检测的成功率较低[7],需使用预处理方式破坏细胞壁,再进行菌落PCR以增强检测效率.目前已有文献报道了酿酒酵母的多种预处理方式,如通过消解酶水解细胞壁,使用氢氧化钠、醋酸锂、十二烷基硫酸钠、曲拉通X-100处理酵母,均有效提高了检出率[8-12],但酶制剂成本较高,酶解缓冲液以及化学试剂中金属离子的引入会干扰PCR检测的稳定性[13],极大制约了菌落PCR在酿酒酵母中的应用.
本研究通过对比不同预处理方法,探索出一种高效酵母菌落PCR检测方法.该方法无需辅助物质的添加,使用微波结合冻融的方式处理酵母菌液,以其为模板进行PCR检测,成本低、效率高、稳定性好,不仅适用于不同基因操作模式下阳性克隆的筛选,还可用于3 000 bp以上长链DNA片段的检测;此外,该方法可应用于树干毕赤酵母和巴斯德毕赤酵母阳性克隆的筛选.
1 材料与方法
1.1 材料
1.1.1 菌株 大肠杆菌DH5α、野生型二倍体酿酒酵母(Saccharomycescerevisiae)YD202、单倍体酿酒酵母BY4741、巴斯德毕赤酵母(Komagataellaphaffii)GS115均由厦门大学生物质燃料与化学品团队保藏;树干毕赤酵母(Scheffersomycesstipitis)CGMCC 2.3250购自中国普通微生物菌种保藏管理中心.
1.1.2 培养基 Luria-Bertani(LB)培养基:10 g·L-1胰蛋白胨、5 g·L-1酵母抽提物、10 g·L-1氯化钠;Yeast Extract Peptone Dextrose(YEPD/YPD)培养基:20 g·L-1胰蛋白胨、10 g·L-1酵母抽提物、20 g·L-1葡萄糖.
分别向以上体系中添加终浓度为20 g·L-1的琼脂,配制成相应的固体培养基.在制备抗性平板时,向灭菌后的LB固体培养基中加入终浓度为100 μg·mL-1的氨苄青霉素,向YPD固体培养基中加入终浓度为200 μg·mL-1的潮霉素B或G418.
1.1.3 质粒与DNA片段 酿酒酵母木糖异构酶(XI)表达质粒pRS41H-xylA、表面展示型XI表达质粒pRS41H-xylA-sag1,巴斯德毕赤酵母特异蛋白表达质粒pPIC9K-catcher、pPIC9K-xynA均由无缝克隆技术构建.酿酒酵母非特异性醛糖还原酶敲除盒gre3_U-hpt-gre3_D、δ位点整合片段δ1-xylA-KanMX-δ2,树干毕赤酵母己糖激酶敲除盒nag5_U-hpt_m-nag5_D均通过重叠延伸PCR方式构建.其中,hpt为潮霉素B抗性基因,而树干毕赤酵母属于CUG分支酵母,将常规亮氨酸密码子CUG翻译为丝氨酸[14],故选用经过突变后的潮霉素B抗性基因hpt_m作为筛选标记[15].
1.1.4 引物 根据待测片段的特性共设计7组引物,均由上海生工生物工程公司合成,引物序列详见表1.

表1 菌落PCR检测所使用的引物
1.1.5 主要试剂与设备 2×RapidTaqMaster Mix、2×Phanta Flash Master Mix、DL5000 DNA Marker、One Step Cloning Kit购自南京诺唯赞公司;抗生素G418、潮霉素B购自上海生工生物工程公司;PEG3350购自上海新铂化学技术公司;LiAc购自上海麦克林生化科技公司.其他化学试剂均为国产分析纯.
基因扩增仪、电泳仪、化学发光凝胶成像系统、电穿孔系统购自美国BIO-RAD公司;微型高速离心机购自德国Eppendorf公司;荧光倒置显微镜购自德国Leica公司;700 W微波炉购自广东美的公司.
1.2 方法
1.2.1 质粒及DNA片段的转化 酿酒酵母醋酸锂/聚乙二醇转化参照Gietz[16]的方法进行,并适当优化.完成感受态酵母细胞的制备和转化体系的配制后,于30 ℃温浴30 min,42 ℃热激25 min,在500 μL YPD培养基中复苏2 h,吸取100 μL培养液涂布选择性平板,培养2~3 d后,挑选单菌落检测阳性克隆.
毕赤酵母使用电转化法进行DNA的转化[17].转化时使用0.2 cm电转化杯,电穿孔系统设置电压2 000 V、电容25 μF、电阻200 Ω,转化完成后在选择性平板上涂布相应菌液.
1.2.2 酵母质粒及基因组DNA的获取 在抗性平板上挑选单菌落,接种至20 mL YPD培养基上,培养至对数生长后期(D600 nm=8~10)时,收集菌体.分别使用北京天根生化公司的酵母质粒提取试剂盒和基因组DNA提取试剂盒进行酵母质粒及基因组DNA的提取.
1.2.3 预处理酵母制备PCR模板的方法 直接法:使用无菌牙签从筛选平板上挑取少量菌体直接用于PCR检测.
水浴法:挑取单菌落接种至20 mL抗性YPD培养基中,过夜培养(D600 nm=4~5),取1.5 mL菌液,于12 000 r·min-1离心15 s,弃上清,用200 μL ddH2O重悬菌体,于12 000 r·min-1再次离心15 s,弃上清,用200 μL TE缓冲液重悬菌体,沸水浴10 min,于12 000 r·min-1离心5 min,取1 μL上清作为PCR模板.
水浴冻融法:使用与水浴法同样的方式收集菌体,沸水浴10 min,于-80 ℃冷冻处理10 min,完成后再次沸水浴10 min,于12 000 r·min-1离心5 min,取1 μL上清作为PCR模板.
微波法[18]:使用无菌牙签挑取菌体至PCR管壁,用700 W微波炉全功率处理5 min,于-20 ℃快速冷却至室温后作为PCR模板.
微波冻融法:取单菌落接种至含2 mL抗性YPD培养基的5 mL无菌离心管中,过夜培养(D600 nm=1.5~2.0),取10 μL菌液至PCR管中,用700 W微波炉全功率处理5 min,于-80 ℃冷冻10 min,快速解冻,再次用微波炉全功率处理2 min,取1 μL菌液作为PCR模板.
1.2.4 PCR检测 按照试剂使用说明配制20 μL反应体系进行PCR检测.以1%琼脂糖凝胶电泳检测PCR产物.
2 结果与分析
2.1 不同预处理方式下酵母形貌的比较
为了比较不同预处理方式对酵母形貌的影响,以野生型酿酒酵母为研究对象,按照“1.2.3”中的方法处理菌体.显微镜下观察的结果(图1)显示:未经处理的酵母轮廓清晰,并展现出芽特性;水浴法处理后,部分酵母细胞体积膨胀,有少数胞体破裂;酵母经过水浴冻融和微波冻融处理后的效果相似,部分细胞内容物溢出且细胞质壁分离明显;与水浴法、水浴冻融法、微波冻融法不同,微波法处理后酵母整体呈降解趋势,大量细胞以碎片形式存在.表明以上4种处理方式均可在不同程度上破坏酵母细胞,与其他3种方法相比微波法的破胞效率最高.
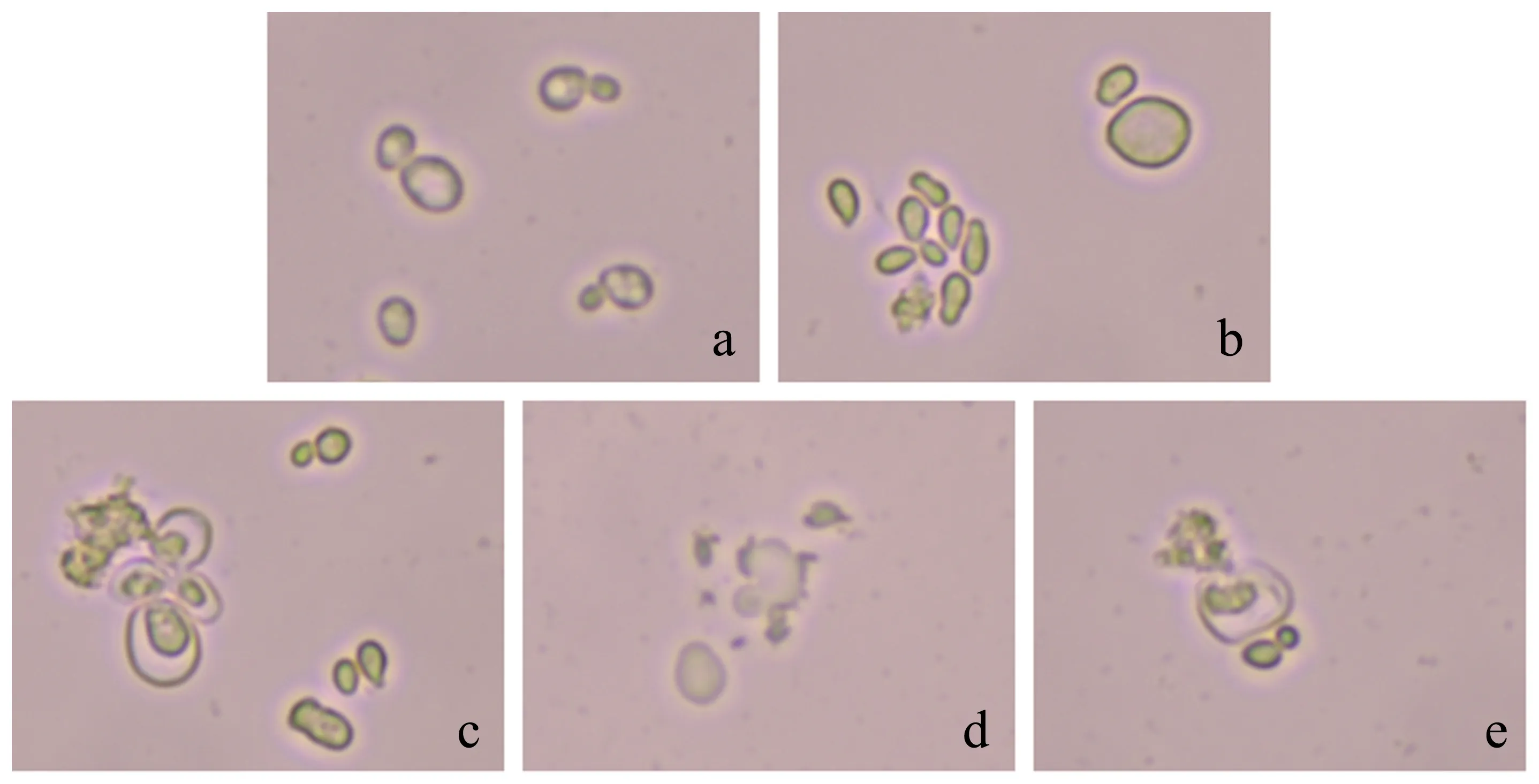
a:原始酵母细胞;b:水浴处理;c:水浴冻融处理;d:微波处理;e:微波冻融处理.
2.2 不同预处理方式对酵母菌落PCR检测的影响
通过醋酸锂转化法将木糖异构酶游离表达质粒pRS41H-xylA转化至野生型酿酒酵母中,使用潮霉素B抗性平板进行克隆子的筛选,结果见图2a.随机挑选5个单菌落经过5种预处理方式制备模板进行菌落PCR检测,其琼脂糖凝胶电泳图谱如图3所示.当以试剂盒提取质粒为PCR模板时(图3a),电泳条带与XI开放阅读框长度1 320 bp保持一致,表明重组质粒均已成功转化.然而,直接以菌体为模板(图3b)或采用水浴法(图3c)和微波法(图3e)制备模板,电泳图谱显示无条带或微弱目标条带,难以实现检测目的.采用水浴冻融法(图3d)和微波冻融法(图3f)处理菌体后进行PCR检测,电泳图谱均显示出与质粒PCR检测结果相吻合的目标条带,但微波冻融法表现出更高的稳定性.
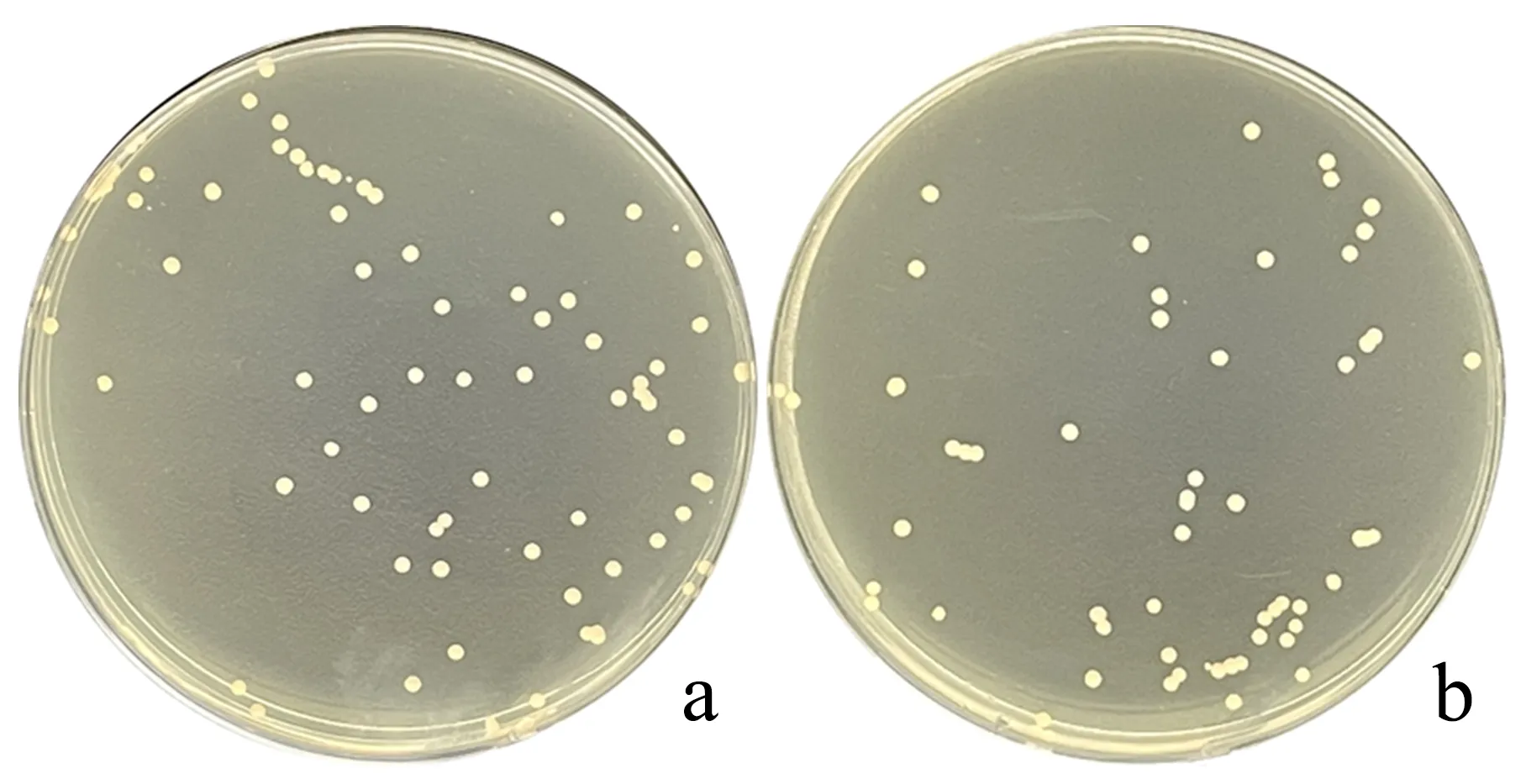
a:酿酒酵母pRS41H-xylA;b:酿酒酵母Δgre3∷hpt.
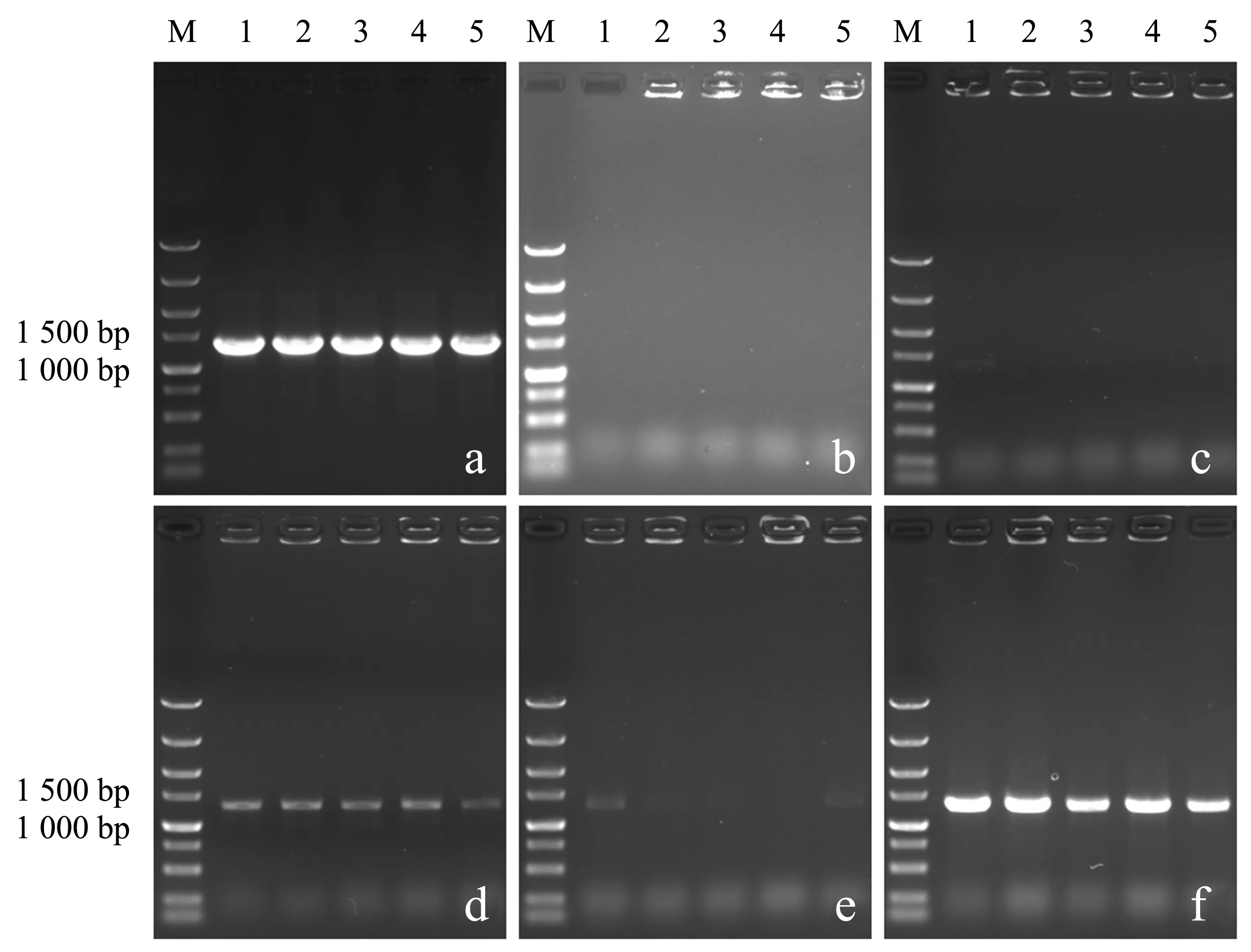
a:质粒模板;b:直接模板;c:水浴模板;d:水浴冻融模板;e:微波模板;f:微波冻融模板(M:DL5000 Marker;1~5:单菌落).
向酿酒酵母中导入DNA片段gre3_U-hpt-gre3_D后,通过同源重组的方式敲除非特异性醛糖还原酶基因gre3,抗性筛选结果见图2b.挑选5个单菌落,使用不同预处理方式制备的模板进行PCR检测,结果如图4所示.以提取的基因组DNA为模板时(图4a),电泳图谱显示于2 100 bp处存在明显条带,其中,泳道3、4更为明亮.测序结果显示,以上两条DNA片段即为扩增所得的gre3基因敲除盒.采用直接法(图4b)和微波法(图4e)制备的模板均无法完全扩增出目标条带,检测结果显示假阴性率高.相比水浴法和水浴冻融法,采用微波冻融法(图4f)制备的模板进行菌落PCR检测的稳定性更好.此外,菌落PCR仍能检测出800 bp左右的待敲除片段,表明在多个单菌落中,基因敲除盒部分整合至二倍体酵母染色体中,敲除基因同源位点仍存在完整的gre3基因.
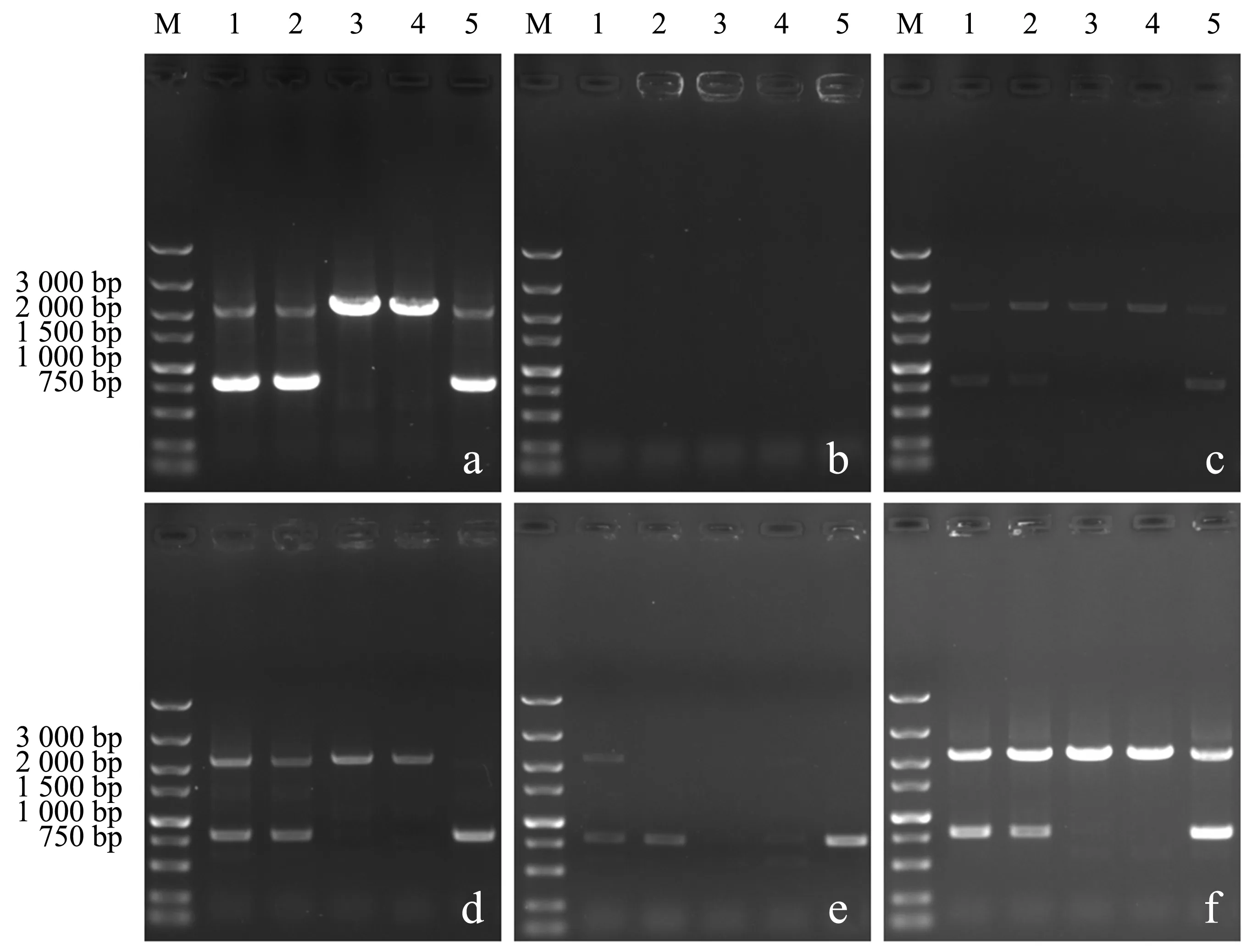
a:基因组模板;b:直接模板;c:水浴模板;d:水浴冻融模板;e:微波模板;f:微波冻融模板(M:DL5000 Marker;1~5:单菌落).
对于质粒转化和染色体整合两种体系,直接以酵母菌体为模板进行PCR检测,无法扩增出目的片段,表明通过PCR无法使酵母细胞壁结构遭受破坏而暴露核酸物质.水浴法所得的电泳条带较暗,在经过冷冻和2次水浴后,菌落PCR灵敏度提升明显,但稳定性不足,可能由长时间高温破坏核酸结构所致.由图1d可知,微波法处理后的酵母破胞明显,大量内容物溢出以及剧烈变化的物理环境导致DNA降解等因素均可导致PCR检测结果呈假阴性.相比其他预处理方法,微波冻融法操作简单,所得电泳图谱条带清晰,耗费较少时间即可达到常规试剂盒提取法相同的检测效果.
2.3 酵母长链DNA片段的检测结果
使用醋酸锂/聚乙二醇转化法分别向野生型酿酒酵母和BY4741中导入δ位点整合片段δ1-xylA-KanMX-δ2和表面展示型XI表达质粒pRS41H-xylA-sag1,分别使用G418和潮霉素B平板进行筛选.在选择性平板上随机挑选单菌落,使用微波冻融法制备的模板进行PCR检测.电泳图谱(图5)显示,基因组模板和微波冻融模板在4 000 bp左右处有明显条带,与插入δ位点的特征序列长度相同.图6b显示,泳道1、2、3、4、6在3 000~5 000 bp处有单一条带,与质粒PCR检测结果(图6a)一致.以上两种检测结果表明,使用微波冻融法制备的模板进行菌落PCR可用于酿酒酵母长链DNA片段的检测.
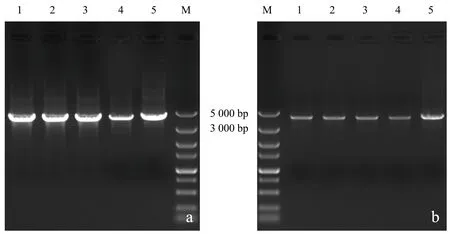
a:基因组模板;b:微波冻融模板(M:DL5000 Marker;1~5:单菌落).
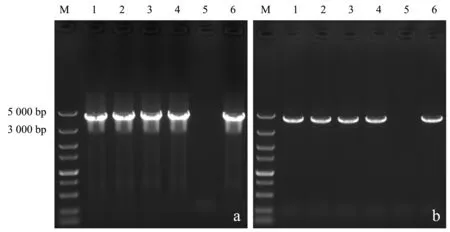
a:质粒模板;b:微波冻融模板(M:DL5000 Marker;1~6:单菌落).
2.4 毕赤酵母菌落PCR检测结果
使用电转化法向树干毕赤酵母中导入己糖激酶敲除盒nag5_U-hpt_m-nag5_D,在获取转化子后采用微波冻融法制备模板,使用nag5上下游引物对基因敲除情况进行PCR检测.结果(图7)显示,以树干毕赤酵母原始基因组DNA作为对照可以扩增出2 233 bp的待敲除片段,而对于树干毕赤酵母nag5敲除体系,大部分筛选所得的单菌落可扩增出3 456 bp的nag5基因敲除盒.
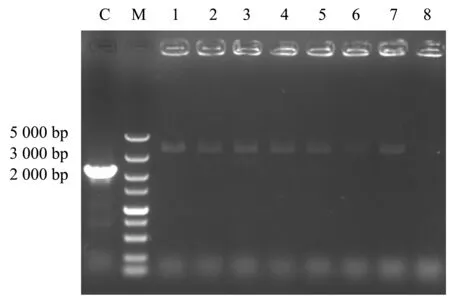
C:原始基因组模板;M:DL5000 Marker;1~8:微波冻融模板.
使用电转化法向巴斯德毕赤酵母中分别导入使用限制酶SalⅠ线性化处理后的质粒pPIC9K-xynA、pPIC9K-catcher,在筛选平板上获取单菌落后,采用微波冻融法制备PCR模板,使用AOX1通用引物扩增目标条带.结果(图8)显示:两种体系均可扩增得到2 200 bp的野生型AOX1基因,表明获得的单菌落均为甲醇利用野生型(Mut+);同时,泳道1~4、5~10分别在1 200和1 700 bp处有明显条带,与组合AOX1基因上下游同源序列的目的基因长度相匹配.表明微波冻融模板不仅适用于酿酒酵母菌落的PCR检测,在毕赤酵母中亦有较好的检测效果.

a:pPIC9K-xynA;b:pPIC9K-catcher(M:DL5000 Marker;1~4、5~10:微波冻融模板).
3 讨论
使用菌落PCR筛选大肠杆菌阳性克隆时,在PCR预变性步骤持续高温的作用下,菌体会部分裂解而暴露DNA,可直接作为菌落PCR检测的模板.与之不同的是,酵母菌落PCR检测成功的关键是通过预处理方式破坏细胞壁结构,以提高聚合酶与扩增模板的接触概率,来实现PCR的顺利进行.酵母预处理方法包括酶法、化学法、物理法.酶法借助消解酶、蜗牛酶等酶制剂的水解作用来处理酵母细胞壁,消除PCR检测的屏障,但成本较高、作用时间长,且对细胞壁组分复杂的野生型酵母的作用并不显著,一般用于辅助其他处理方式,以协同方式完成破胞[19].化学法需添加醋酸锂、氢氧化钠、十二烷基硫酸钠、曲拉通X-100改变细胞壁的通透性,以提高菌落PCR检测的成功率,但化学试剂的引入会干扰PCR体系,对聚合酶活性产生较大的影响[13].物理法常使用高温、冷冻、微波、研磨等方式破坏细胞结构以达到释放DNA的目的[20],该方法操作简单,但部分处理方式的PCR检测效果并不理想.基于物理法的优势,本研究对不同处理方式与菌落PCR检测结果之间的关系进行了探究.
粟酒裂殖酵母(Schizosaccharomycespombe)可直接使用酵母菌体为模板进行菌落PCR检测用于分子遗传鉴定,对1 500 bp以内的短链基因片段有较好的检测效果[7];但本研究采用直接法制备的野生型酿酒酵母模板进行菌落PCR检测,无法检测出目标条带.试验结果不一致推测是由于酵母的遗传背景差异较大且野生型酿酒酵母细胞壁结构复杂[21].相比水浴法,采用水浴冻融法制备的模板进行菌落PCR检测时,其检测灵敏度提升明显,与通过冰晶破坏细胞壁可以提高检测成功率的快速冻融法[22]一致,然而长时间的高温环境以及反复冻融操作均会破坏基因组DNA结构,影响后续PCR检测结果.据报道,微波法制备的模板适用于酿酒酵母2 000 bp以内DNA片段的快速检测[18],但在操作中发现此法的PCR模板量难以得到精确控制,最优微波处理时间亦随菌体量和酵母遗传背景的不同而改变;同时,菌体以及微波处理时间过长导致细胞内容物溢出(图1d)均可成为PCR检测的干扰因素.因此,本研究使用微波法制备的模板进行菌落PCR检测的灵敏度低、稳定性较差(图3e、4e).与微波法不同,微波冻融法以酵母菌液为操作对象,使用长时间微波处理可以保证微波破胞的同时降低高温对酵母基因组的破坏,保持基因组的完整性,在经过冻融辅助破壁和再次微波处理后,进行菌落PCR可达到相比其他预处理方式更优的检测效果(图3f、4f).
培养基的组成以及培养物的生长周期均可成为影响酵母菌落PCR检测效率的因素[18],本研究选取不同生长时期的酵母菌液进行微波冻融处理,后续的PCR检测结果并无明显差异.对于微波冻融法制备的模板,控制相同模板量,使用10 μL反应体系亦可得到相同的检测结果.因此,微波冻融法受培养基以及菌体生长周期的影响较小,相比其他预处理方式更占优势.在酿酒酵母大规模DNA片段组装后的鉴定中,以长链DNA片段为靶标可以提高检测准确度,同时能够助力测序验证工作的高效运行.本研究使用微波冻融法扩增长链DNA片段,所得电泳条带明亮且单一,表明该方法的条件温和且对细胞DNA的破坏较小,适用于长链DNA片段的检测.
4 结论
本研究从菌落PCR常规的物理预处理方式出发,通过对比各种方法的异同之处,提出使用微波冻融法制备的模板进行酿酒酵母菌落PCR检测,该方法操作简单、耗时短、条件较为温和、破壁效果显著,不仅可在不同基因操作体系中高效扩增短链DNA,且适用于3 000 bp以上长链DNA片段的检测.此外,在巴斯德毕赤酵母和树干毕赤酵母中使用微波冻融法制备的模板进行菌落PCR均可实现较好的检测效果.综上所述,微波冻融法的应用降低了检测成本,提高了检测效率,适合应用在复杂酵母菌落PCR检测.
