菌群发酵对菌草饲料营养品质和体外抗氧化活性的影响
2022-10-08邱余杨雷雅婷刘庆华
邱余杨, 雷雅婷, 赵 辉, 刘庆华, 刘 斌
[1.福建农林大学国家菌草工程技术研究中心;2.福建农林大学生命科学学院;3.福建农林大学动物科学学院(蜂学学院);4.福建农林大学食品科学学院,福建 福州 350002]
菌草(JUNCAO)已在国内大面积种植及开发利用,其中巨菌草和‘绿洲一号’菌草是最为重要且应用广泛的菌草[1].巨菌草和‘绿洲一号’均是高大禾本科的多年生草本植物,片厚大,叶质柔软多汁,富含糖分、木质素、粗蛋白和粗纤维,适口性好,易消化,成为畜牧和水产养殖优质青饲料的最优选择[2-4].二者均具有生长速率快,产量高,抗逆性强,耐高温、干旱、盐碱等特点.‘绿洲一号’所具有的耐寒性对改变我国北方冬天牧草资源短缺现状具有重要意义[5].
目前,已有的研究大多局限于传统的菌草青贮饲料,而菌草青贮饲料发酵时间长且贮存期短,营养品质不佳[6-8].生物发酵饲料是利用益生菌等微生物进行发酵,其代谢产物可丰富营养成分,进一步提高饲料的理化性质及饲料营养和消化吸收率;调节动物肠道的微生态平衡,提高机体免疫力[9-10].生物发酵饲料还具有质优价廉、吸收利用率高、可替代抗生素、保护环境等功能,在生态畜牧业发展中有很好的应用前景[11].因此,将营养丰富的菌草与微生物发酵技术相结合,生产新型菌草发酵饲料,具有很好的开发潜力.
目前,对微生物发酵菌草饲料的研究不多.因此,本研究通过探讨不同菌群发酵对巨菌草和绿洲一号营养成分、品质和抗氧化活性的影响,筛选出适合菌草发酵的菌群,以替代蛋白饲料,为菌草饲料的开发利用提供参考.
1 材料与方法
1.1 菌草和菌种来源
‘绿洲一号’菌草和巨菌草均为高2.5 m左右2月龄的新鲜菌草,由国家菌草工程技术研究中心提供.将‘绿洲一号’和巨菌草粉碎后50 ℃下烘干,分别过20目筛,备用.玉米粉和麦麸购自河南麦德旺农副产品公司.饲料发酵菌种:菌群A主要菌有乳酸菌、酵母菌、枯草芽孢杆菌等;菌群B主要菌有乳酸菌、酵母菌、放线菌、嗜酸乳杆菌等;菌群C主要菌有乳酸菌属、酵母菌、芽孢杆菌、粪肠球菌、梭菌等.3个菌群均由本实验室筛选、保存.
1.2 试验设计
试验分为未灭菌巨菌草组(USJ)、灭菌巨菌草组(SJ)、未灭菌‘绿洲一号’组(USL)和灭菌‘绿洲一号’组(SL)4个大组,再向四大组中分别添加无菌蒸馏水或A、B、C菌群,其中加无菌蒸馏水参与发酵的组为对照CK,未参与发酵的组为对照CK0,共20个组,每组3个重复,共60个样.称取总量为250 g的发酵基料(巨菌草或‘绿洲一号’∶麦麸∶玉米粉=8∶1∶1).灭菌组样品先经121 ℃高压灭菌30 min,冷却至室温后分别添加3种菌群(接种量为2.5%),未灭菌组样品也分别添加3种菌群,对照加等体积蒸馏水.混合均匀后,配置成50%含水量的发酵体系,转移至1 L的发酵瓶中,排除空气,压实密封,于30 ℃培养箱静置发酵12 d.
1.3 指标测定
1.3.1 感官评定 发酵结束后,对饲料样品进行感官评定.参照农业部的《青贮饲料质量评定标准》[12],观察饲料的气味、颜色、质地.根据稻秸青贮饲料的气味(15分)、色泽(15分)和质地(10分)感官指标进行感官评定.其中,优等为30~40分,良好为20~30分,一般为10~20分,差为10分以下.
1.3.2 营养成分测定及相对饲用价值计算 发酵结束后,取100 g样品,65 ℃烘48 h后进行指标测定.干物质(dry matter, DM)、粗蛋白(crude protein, CP)分别按照GB/T 6435—2014、GB/T 6432—2018[13-14]测定.中性洗涤纤维(neutral detergent fiber, NDF)、酸性洗涤纤维(acid detergent fiber, ADF)、酸性洗涤木质素(acid detergent lignin, ADL)和酸不溶灰分(acid insoluble ash, AIA)的测定,以及纤维素和半纤维素含量计算参考宋书红[15]的方法,相对饲用价值(relative feeding quality, RFQ)计算参考文献[16].
1.3.3 发酵品质的测定 取25 g发酵饲料于三角瓶中,加入1∶9的蒸馏水搅拌均匀,4 ℃冰箱浸提24 h,再常温水浴超声30 min,过滤后离心(7 850 r·min-1) 10 min,取上清浸提液.部分浸提液用于测定pH值、有机酸和氨态氮(NH3-N)的含量,-20 ℃冰箱冻存备用.另一部分浸提液经旋蒸冻干后用于抗氧化测定.采用超高效液相色谱仪(Water型)测定乳酸(lactic acid, LA)、乙酸(acetic acid,AA)、丙酸(propionic acid, PA)和丁酸(butyric acid, BA)含量.色谱柱为ACQUITY UPLC®BEH C18 1.7 μm,2.1 mm×100 mm Column, Ireland.二元梯度洗脱流动相:A为20 mmol·L-1NaH2PO4(pH为2.7),B为甲醇;起始流动相为95%A+5%B,维持2 min;2.5 min后调为90%A+10%B,维持10 min.流速0.3 mL·min-1,柱温30 ℃,检测波长210 nm,进样量10 μL,参考文献[17]进行改良.NH3-N含量的测定采用苯酚—次氯酸钠比色法[18].
1.3.4 体外抗氧化活性的测定 以VC为参照物,发酵产物水提物中-OH自由基清除能力、DPPH自由基清除能力、ABTS自由基清除能力的测定参考张雪娇等[19]、李新[20]的方法,并作改良,计算自由基清除能力(IC50值).
1.4 数据分析
采用Excel 2019对数据进行分析和绘图,采用SPSS 13.0统计软件对数据进行单因素方差统计分析,采用LSD和Duncan法进行差异显著性分析,数据均采用平均值±标准差表示.
2 结果与分析
2.1 不同菌群发酵后菌草饲料的感官评定结果
依据各指标对各试验组进行打分,再综合评定发酵饲料的质量等级(表1).各CK菌草饲料(灭菌巨菌草除外)的感官总评分均显著高于CK0(P<0.05).与CK相比,添加菌群B和C的未灭菌巨菌草以及添加菌群C的未灭菌‘绿洲一号’饲料的感官总评分极显著提高(P<0.01).这3组饲料等级皆为优,其它组饲料等级皆为良好.表明菌群C改善了饲料的风味、质地和适口性(表1).
2.2 不同菌群发酵对菌草饲料营养成分的影响
由表2可知,各组别中CK菌草饲料与CK0相比,部分指标有所改善,但无明显差异(P>0.05).
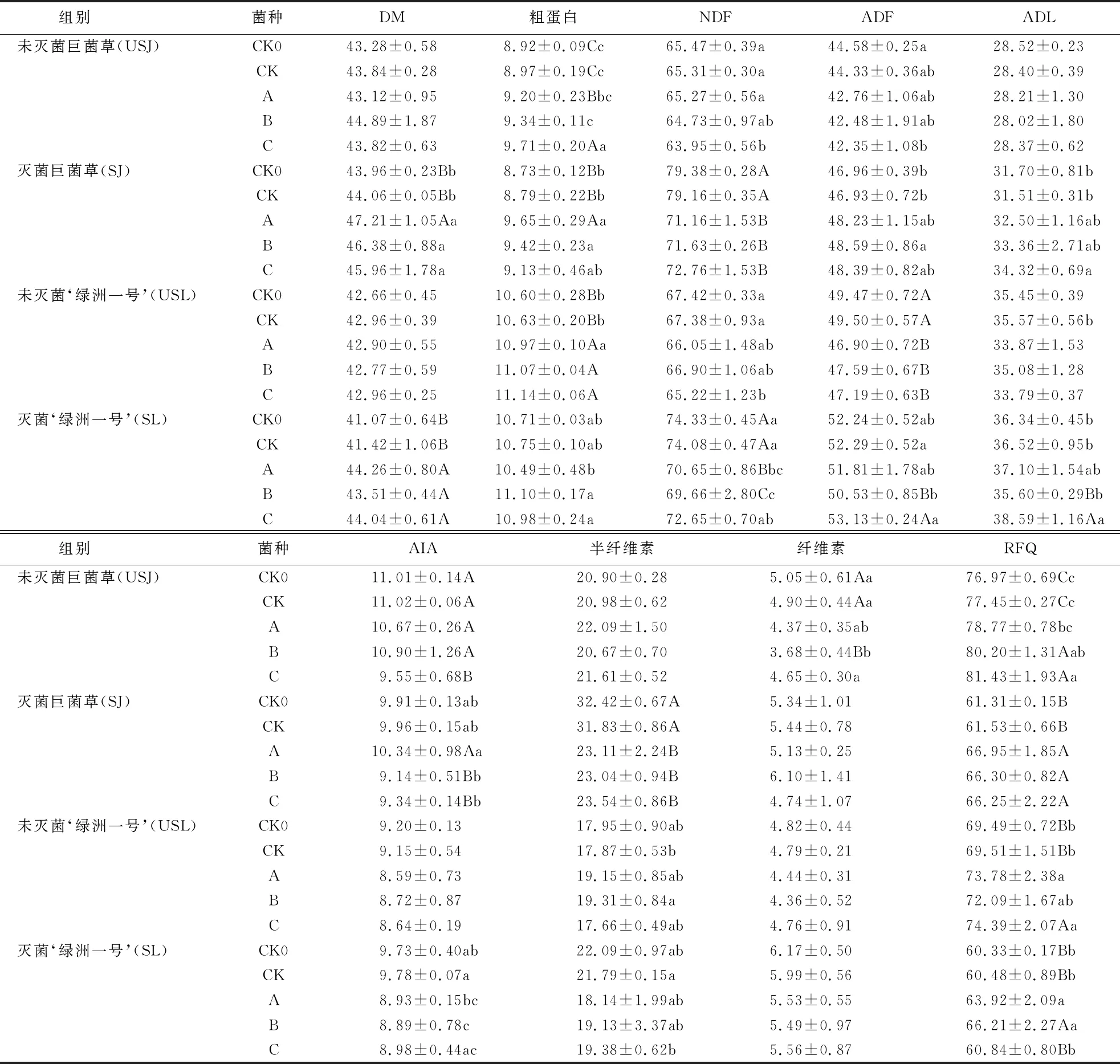
表2 不同菌群发酵后菌草饲料中的营养成分1)
USJ组别中,与CK相比,添加菌群C的NDF和AIA含量分别显著降低了2.08%和13.34%(P<0.05),CP和RFQ含量分别极显著提高了8.25%和5.14%(P<0.01);添加菌群B的CP和RFQ含量分别显著提高了4.12%和3.55%(P<0.05),AIA和纤维素含量分别极显著降低了13.34%和24.90%(P<0.01);各组的DM、ADF、ADL和半纤维素的含量差异虽不显著,但ADF和ADL含量均出现不同程度的下降.
USL组别中,与CK组相比,添加菌群A、B和C的ADF含量分别极显著下降了5.25%、3.86%和4.67%(P<0.01),而CP含量均分别极显著提高了3.20%、4.14%和4.80%(P<0.01);添加菌群B的半纤维素含量显著提高了8.06%(P<0.05);添加菌群A和B的RFQ含量分别显著提高了6.14%和7.02%(P<0.05);各组的DM、NDF、ADL、AIA和纤维素的含量差异不显著.
USJ组别和SJ组别相比,SJ组别中DM、NDF、ADF、ADL、半纤维素和纤维素的含量明显高于USJ组,而USJ组别中AIA、CP及RFQ含量高于SJ组.
USL组别与SL组别相比,USL组别中CP及RFQ含量均高于SL组,SL组其余各指标均高于USL组.
2.3 不同菌群发酵对菌草饲料品质的影响
由表3可知,USJ组别中,与CK0相比,各组的pH值极显著减小(P<0.01),其余指标均显著增加(P<0.05).与CK相比,添加菌群C的pH值、BA含量分别极显著下降了2.41%、41.88%(P<0.01),NH3-N/TN值显著下降了10.53%(P<0.05),LA/AA值极显著提高了25.53%(P<0.01).

表3 不同菌群发酵后菌草饲料的品质1)
SJ组别中,与CK相比,添加菌群A的pH值、NH3-N/TN值和AA含量均极显著下降(P<0.01),LA/AA值极显著提高了18.60%(P<0.01).
USL组别中,与CK0相比,CK的pH值极显著减小(P<0.01),其余指标含量均显著增加(P<0.05).与CK相比,添加菌群A、C的pH值均极显著减小(P<0.01)、LA/AA值极显著提高了16.28%(P<0.01);但添加菌群A的BA值极显著提高了55.40%(P<0.01),添加菌群C的BA值极显著下降了31.22%(P<0.01).
SL组别中,与CK相比,添加菌群C的pH值极显著减小,BA值极显著下降(P<0.01),LA、AA含量分别提高了65.80%、30.39%(P<0.05),LA/AA值极显著提高了26.67%(P<0.01).
综合来看,添加菌群C的未灭菌巨菌草和‘绿洲一号’组能有效降低菌草发酵饲料的pH、NH3-N/TN值,提高LA/AA值,因此能明显改善菌草饲料的品质.
2.4 不同菌群发酵对菌草饲料抗氧化性活性的影响
由图1可以看出,分别与CK相比,USJ组中添加菌群C,SJ组中添加菌群B、C以及SL组中添加菌群A、B、C的DPPH的IC50值显著降低(P<0.05);SJ组中添加菌群C的-OH的IC50值显著降低(P<0.05);USJ组添加菌群A、B的ABTS的IC50值显著降低(P<0.05);其余各组的DPPH、-OH、ABTS的IC50值没有明显差异.
3 讨论
研究[21]表明,双孢菇菌糠经混菌发酵后CP含量明显提高.范恩帝等[22]研究表明,混合发酵白酒酒糟饲料明显提高了CP含量(1.56%,35.21%),降低了粗纤维的含量(33.11%,12.73%).李成舰等[23]研究表明,混菌发酵后的饲料中CP含量显著提高,NDF和ADF含量显著降低,从而提高了饲料营养价值.本试验发现,相比发酵前后的空白对照(CK0和CK),添加不同菌群发酵的饲料营养均有所改善.‘绿洲一号’和巨菌草均属新型牧草,‘绿洲一号’茎秆更粗硬,其自身纤维和粗蛋白含量均高于巨菌草[24-25],因而‘绿洲一号’饲料中的CP、NDF和ADF含量要高于巨菌草饲料.乳酸菌属和粪肠球菌属有助于将纤维物质降解为更易吸收的小分子糖类,为微生物菌群提供糖原,促使其快速生长繁殖,加快菌体蛋白的形成,进而提高饲料中的CP含量[26-27],这与本研究一致.本研究结果表明添加菌群C发酵的未灭菌巨菌草和‘绿洲一号’饲料的NDF和ADF含量均下降,从而相对饲用价值提高,营养增强.
饲料发酵初期,酵母菌、枯草芽孢杆菌等好氧菌进行有氧呼吸,可降解饲料中的大分子物质,并通过自身繁殖来提高饲料中营养物质含量[28].当体系中氧气耗尽,则各类乳酸菌等厌氧菌快速生长,乳酸菌可消耗饲料中的可溶性糖,产生大量LA和AA,有效降低饲料pH值,抑制大肠杆菌、霉菌和梭菌等有害菌的增殖[29].饲料中丙酸菌会利用LA产生的AA和PA,二者可抑制酵母菌和霉菌繁殖,而且AA可提高饲料有氧稳定性,缩短饲料发酵期[26,30].BA是梭菌等腐败菌分解蛋白质、葡萄糖和LA的产物,BA含量越高,发酵饲料品质越低[31-32].NH3-N/TN值越大,蛋白质和氨基酸被分解越多,可被动物利用的蛋白质越少,饲料品质越差[30,33].本研究中,灭菌巨菌草和‘绿洲一号’的pH、LA和AA的含量显著低于未灭菌组,表明未灭菌菌草饲料品质更优.这可能归因于经未灭菌的巨菌草和‘绿洲一号’中的有益好氧菌和添加菌群的协同作用,迅速耗尽发酵罐中氧气而进行厌氧发酵,有助于LA和AA的产生,缩短发酵时间.因此,未灭菌的菌草更适合作为饲料发酵原料.
饲料中若具有较高含量的抗氧化活性物质则可有效减弱饲养动物的氧化应激,增强动物机体的免疫功能[34-35].DPPH·、-OH·和ABTS·被广泛用于天然活性物质的抗氧化研究.体外抗氧化结果显示,4个组别中添加菌群C的发酵饲料对DPPH·、-OH·、ABTS·的清除能力(IC50值)均小于1.0 mg·mL-1,ABTS·的IC50值小于0.25 mg·mL-1,表明添加菌群C后发酵饲料的提取物具有更强的抗氧化能力.
4 小结
本研究结果表明:添加菌群C的未灭菌巨菌草和‘绿洲一号’两种饲料的感官评价皆为优,可极显著提高未灭菌巨菌草和‘绿洲一号’两种饲料的粗蛋白含量、乳酸/丙酸值,以及未灭菌巨菌草的相对饲用价值;显著降低pH、丁酸含量和NH3-N/TN值.未灭菌菌草更适合作为饲料发酵原料,菌群C发酵菌草饲料的营养品质和体外抗氧化活性最佳.
