鼠伤寒沙门氏菌LT2 Hfq与fadL、ompN、ybfM mRNA 5′UTR结合位点的预测与验证分析
2022-10-08令狐远凤段世宇张家莉张宝太
令狐远凤, 杨 阳, 潘 永, 段世宇, 张家莉, 张宝太, 杨 琦
(1.贵州大学动物科学学院, 贵州 贵阳 550025;2.贵州大学动物疫病研究所,贵州 贵阳 550025;3.贵州省农业科学院畜牧兽医研究所,贵州 贵阳 550025)
沙门氏菌(Salmonella)为肠杆菌科、沙门氏菌属成员,可引起人与动物多种疾病,在全世界均有发生,造成严重的经济损失[1].研究表明[2],沙门氏菌中重要的调控因子small RNA(sRNA)在转录水平上对细菌的生命活动进行调控,其中反式编码sRNA调控作用往往离不开伴侣蛋白Hfq的帮助.当Hfq缺失后,相关sRNA的调控作用可能会减弱甚至消失.也有研究表明[3-4],越来越多的肠杆菌sRNA在转录后水平上对外膜蛋白(OMPs)的表达进行调节,已知InvR、MicA、MicC、MicF、OmrAB、RseX、RybB等至少8个sRNA在大肠杆菌与沙门氏菌中可以调节OMPs.
Hfq蛋白由6个相同的分子质量为11.2 ku的亚基组成,形成环状结构的同型六聚体结构.该种蛋白具备最少3个不同的RNA相互作用面:近端面、远端面、边缘面.Hfq蛋白通过这3个不同的接触面,与RNA相互作用.近端面与富含尿嘧啶核苷(U)的序列结合,每个单体最多结合6个核苷酸,这种多存在于与许多sRNA 3'端的Rho非依赖性终止子结合.而远端面对富含腺苷(A)的序列具有亲和力,在rpoSmRNA的5′-UTR内首次确定的相关结构,AAYA 序列显著增强了Hfq的结合,并在Hfq、rpoS和DsrA之间形成稳定的三元复合物[5].基因转录的调控是控制细菌内基因表达过程的第一步,转录控制涉及RNA聚合酶和许多其他调节因素的共同作用,无论是全局的还是局部的,正的或负的调节剂,在细菌细胞中都起着至关重要的作用.根据调控条件的不同,在颜色指示重组菌株fadL、ompN、ybfM基因(ARN)n基序缺失基础上再分别进行hfq基因缺失,通过β-半乳糖苷酶活性分析可以反映基因表达含量的变化,探究缺失区域对该基因产生的作用.
本试验将利用5′RACE技术探究fadL、ompN、ybfMmRNA 5′UTR基因转录起始位点;筛查fadL、ompN、ybfMmRNA 5′UTR可能的Hfq结合位点(ARN)n基序;利用λ-red同源重组技术构建不同(ARN)n完整基序突变的lacZ基因融合菌株;利用噬菌体转导技术构建相应的hfq基因缺失菌株;通过β-半乳糖苷酶试验检测不同重组菌株fadL、ompN、ybfM基因的蛋白水平,分析fadL、ompN、ybfMmRNA (ARN)n基序与Hfq调控的作用关系,为阐明鼠伤寒沙门氏菌(Salmonellatyphimurium,STM)中Hfq与靶mRNA的作用机制提供依据.
1 材料与方法
1.1 菌株与质粒
MA7455菌株(STM LT2/pKD46),MA10241菌株(STM LT2 ΔgcvB∷cat),MA10675菌株(STM LT2 Δhfq∷tetRA),P22噬菌体,pKD13质粒,pCP20质粒及pCE40质粒均由法国国家科学研究中心(CNRS)分子遗传学Bossi实验室惠赠,STM LT2fadL∷kn菌株,STM LT2ompN∷kn,STM LT2ybfM∷kn由本实验室构建.
1.2 主要试剂
TRIzol、SMARTer RACE 5′/3′Kit(Cat.NO.634859)和pMD19-T试剂盒均购自宝日医生物技术(北京)有限公司.氯仿和甲苯申请并报备于贵州大学实验室与设备管理处.氨苄青霉素、卡那霉素、氯霉素、盐酸四环素、利福平、Pfu DNA Polymerase、Taq DNA Polymerase、dNTPs Mix 及ONPG均购自北京索莱宝科技有限公司.DL2000 Plus DNA Marker、AceQ Universal SYBR qPCR Master Mix和胶回收试剂盒均购自南京诺唯赞生物科技有限公司.Cycle-Pure Kit和质粒提取试剂盒均购自Omega生物科技有限公司.NovoScript®Plus All-in-one 1st Strand cDNA Synthesis SuperMix (gDNA Purge)购自近岸蛋白科技有限公司.
1.3 引物设计与合成
根据GenBank上STM LT2 菌株的fadL、ybfM、ompN基因序列与5′RACE引物要求设计引物(表1),引物均由生工生物工程(上海)股份有限公司进行合成.

表1 5′RACE引物序列
1.4 fadL、ybfM、ompN mRNA二级结构预测和ARN基序筛查
根据R6950 Bacterial RNA Kit,提取STM LT2的总RNA,利用特异性的反转录引物在反转录试剂(RNase H-) 作用下合成5′RACE Ready cDNA,在TdT酶作用下加上10~15个(dC)残基,进行第1轮R1的扩增和第2轮R2的扩增.使用Mfold软件预测fadL、ybfM、ompNmRNA部分序列的二级结构,登录网站(http://unafold.rna.albany.edu/?q=mfold),打开RNA Folding Form (version 2.3 energies)选项,输入fadL、ybfM、ompNmRNA 5′UTR完整序列至编码区第20个碱基,其余参数按默认方案设置,导出并分析结果.根据(ARN)n基序特征筛查fadL、ybfM、ompNmRNA 5′UTR的ARN基序.
1.5 ARN基序缺失菌株的构建
1.5.1 引物设计 参照5′UTR分析结果设计相应引物(表2),P1(F)分别与P2(F)、P3(F)进行扩增,P4(F)、P5(F)验证,构建fadLARN-1、ARN-2缺失菌株;P1(Y)分别与P2(Y)、P3(Y)、P4(Y)、P5(Y)、P6(Y)进行扩增,P7(Y)、P8(Y)验证,构建ybfMARN-1、ARN-2、ARN-3、ARN-4、ARN-5缺失菌株;P1(O)分别与P2(O)、P3(O)、P4(O)、P5(O)进行扩增,P6(O)、P7(O)验证,构建ompNARN-1、ARN-2、ARN-3、ARN-4缺失菌株.

表2 定点突变菌株构建使用引物1)
利用λ-Red同源重组酶及FLP重组酶系统,以STM LT2fadL∷kn菌株总DNA为模板,分别以P1(F)/P2(F)、P1(F)/P3(F)为引物,PCR扩增将用于敲除fadLmRNA 5′UTR中经预测ARN基序的目的片段,产物经纯化回收后取5 μL与50 μL MA7455电转化感受态细胞混合并进行电转化试验,吸取200 μL菌液涂布于卡那抗性平板中进行培养筛选,获得菌株STM LT2fadLΔ(AAAAATAAT)∷kn、STM LT2fadLΔ(AAAAAA)∷kn;将质粒pCP20转入STM LT2fadLΔ(AAAAATAAT)∷kn、STM LT2fadLΔ(AAAAAA)∷kn中,在氨苄抗性的平板中进行培养筛选,获得菌株STM LT2fadLΔ(AAAAATAAT)∷scar、STM LT2fadLΔ(AAAAAA)∷scar;将质粒Pce40转入菌株STM LT2fadLΔ(AAAAATAAT)∷scar、STM LT2fadLΔ(AAAAAA)∷scar中,在卡那抗性平板中进行培养筛选,以P4(F)/P5(F)为引物进行PCR与测序验证,构建出菌株STM LT2fadLΔ(AAAAATAAT)∷MudK、STM LT2fadLΔ(AAAAAA)∷MudK.其余ARN基序缺失菌株根据其相对应引物按同样方法分别构建出LT2ompNΔ(GTTTTT)∷MudK、LT2ompNΔ(TCTTTT)∷MudK、LT2ompNΔ(ATTATT)∷MudK、LT2ompNΔ(TTTGCT)∷MudK,构建LT2ybfMΔ(AAGAGG)∷MudK、LT2ybfMΔ(AGCAAT)∷MudK、LT2ybfMΔ(AGTAAA)∷MudK、LT2ybfMΔ(AAAAATAGT)∷MudK、LT2ybfMΔ(AACAGAAAG)∷MudK.
1.5.2 P22噬菌体转导构建缺失菌株 将ARN基序缺失和点突变菌株通过噬菌体转导技术构建相应的hfq基因缺失菌株.以MA10675菌株为供体菌,ARN基序缺失和点突变菌株为受体菌,取20 μL的供体菌borth至1.5 mL离心管,按1∶50加入980 μL无菌PBS中进行稀释.分别取受体菌50、100 μL稀释后,供体菌borth至2.0 mL EP管中,混匀.将2.0 mL离心管置于37 ℃摇床进行孵育1 h后,取20 μL在相应抗性 LB平板进行涂布筛选,次日取单个菌落进行划线纯化培养.将经鉴定正确构建的菌株在噬菌体鉴别培养基上纯化,直至无噬菌体残留.
1.5.3 β-半乳糖苷酶活性分析 每组设3个重复并以STM LT2fadL∷lacZ菌株为阴性对照,同时设空白对照.步骤:将待测菌株过夜培养后取100 μL再次培养至D600 nm=0.3~0.5,从中抽取菌液1 mL置于比色皿中测D600 nm,记录数值.从这1 mL菌液中取0.1 mL置于新的试管中,以Z buffer定容至1 mL,加入1滴甲苯,立即旋转振荡30 s.后将其置于42 ℃摇床中振荡2 h,再置于28 ℃水浴锅中5 min.往试管中加入0.2 mL ONPG(4 mg·mL-1),记录加入时间(start time,t0).当试管中出现黄色时,加入0.5 mL 1 mol·L-1Na2CO3终止反应,记录终止时间(finish time,tf).将所得液体进行离心,取上清液1 mL置于比色皿,以Z buffer作为空白对照,测D420 nm,记录数值.β-半乳糖苷酶活性=1 000×D420 nm/[(tf-t0)×D600 nm].
2 结果与分析
2.1 fadL、ybfM、ompN mRNA 5′UTR测序
提取鼠伤寒沙门氏菌总RNA,使用5′/3′RACE试剂盒,对STM LT2fadL、ybfM、ompNmRNA 进行5′RACE PCR试验,按试剂盒上步骤分别进行R1、R2的扩增,将R2 PCR产物进行测序,测序结果确认fadL、ompN、ybfM基因转录起始位点(表3).

表3 fadL、ompN、ybfM序列1)
2.2 fadL、ompN、ybfM mRNA二级结构预测及ARN基序筛查
将fadL5′-UTR 端序列导入网站(http://rna.urmc.rochester.edu/)进行fadL 5′UTR端二级结构预测,确定其可能的(ARN)n位点与rybB结合区域.fadL5′UTR退火形成2个茎环结构,从中筛选出2个可能的(ARN)n位点,ARN-1(AAAAATAAT)位于靠近fadLAUG的茎环结构上,ARN-2(AAAAAA)则远离2个茎环结构,距离AUG近160 nt,2个(ARN)n均处于单链状态.以上结果表明,成功预测了fadL5′ UTR的二级结构,并筛选出2个可能的(ARN)n序列ARN-1和ARN-2.同样方法预测出ompN5′UTR的二级结构,筛选出4个可能的(ARN)n序列ARN-1、ARN-2、ARN-3、ARN-4,ybfM5′UTR筛选出5个可能的(ARN)n序列ARN-1、ARN-2、ARN-3、ARN-4、ARN-5(图1).
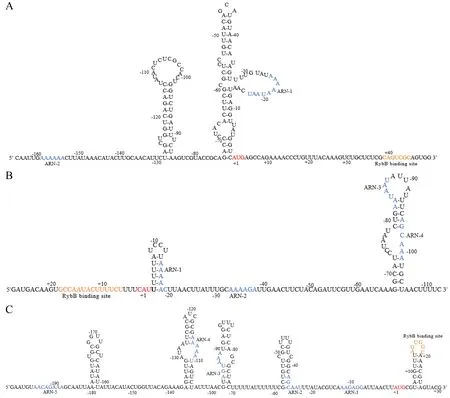
A:fadL mRNA 5′UTR;B:ompN mRNA 5′UTR C:ybfM mRNA 5′UTR.
2.3 基因定点ARN基序缺失菌株鉴定
利用λ-Red同源重组酶及FLP重组酶系统,成功构建出fadL基因中ARN-1、ARN-2区域缺失的STM LT2fadLΔ(AAAAATAAT)∷MudK、STM LT2fadLΔ(AAAAAA)∷MudK;ompN基因中ARN-1、ARN-2、ARN-3、ARN-4区域缺失的LT2ompNΔ(GTTTTT)∷MudK、LT2ompNΔ(TCTTTT)∷MudK、LT2ompNΔ(ATTATT)∷MudK、LT2ompNΔ(TTTGCT)∷MudK;ybfM基因中ybfMARN-1、ARN-2、ARN-3、ARN-4区域缺失的LT2ybfMΔ(AAGAGG)∷MudK、LT2ybfMΔ(AGCAAT)∷MudK、LT2ybfMΔ(AGTAAA)∷MudK、LT2ybfMΔ(AAAAATAGT)∷MudK、LT2ybfMΔ(AACAGAAAG)∷MudK(图2).

A:菌株fadL mRNA ARN-2、ARN-1基序的敲除;B:菌株ompN mRNA ARN-4、ARN-3、ARN-2和ARN-1基序的敲除;C:菌株ybfM mRNA ARN-5、ARN-4、ARN-3、ARN-2和ARN-1基序的敲除.
2.4 定点缺失颜色指示菌株hfq缺失
通过噬菌体转导技术,成功构建fadL、ompN、ybfM对应(ARN)n基序的hfq基因缺失菌株LT2 ΔfadL(AAAAAA)∷MudK Δhfq∷TetRa、LT2 ΔfadL(AAAAATAAT)∷MudK Δhfq∷TetRa、LT2 ΔybfM(AAGAGG)∷MudK Δhfq∷TetRa、LT2 ΔybfM(AGCAAT)∷MudK Δhfq∷TetRa、LT2 ΔybfM(AGTAAA)∷MudK Δhfq∷TetRa、LT2 ΔybfM(AAAAATAGT)∷MudK Δhfq∷TetRa、LT2 ΔybfM(AACAGAAAG)∷MudK Δhfq∷TetRa、LT2ΔompN(GTTTTT)∷MudK Δhfq∷TetRa、LT2ΔompN(TCTTTT)∷MudK Δhfq∷TetRa Δhfq∷TetRa(图3).

M:2 000 bp DNA maker;1、2:LT2 ΔfadL(AAAAAA)∷MudK Δhfq∷TetRa;3、4:LT2 ΔfadL(AAAAATAAT)∷MudK Δhfq∷TetRa;5、6:LT2 ΔybfM(AAGAGG)∷MudK Δhfq∷TetRa;7、8:LT2 ΔybfM(AGCAAT)∷MudK Δhfq∷TetRa;9、10:LT2 ΔybfM(AGTAAA)∷MudK Δhfq∷TetRa;11、12:LT2 ΔybfM(AAAAATAGT)∷MudK Δhfq∷TetRa;13、14:LT2 ΔybfM(AACAGAAAG)∷MudK Δhfq∷TetRa;15、16:LT2ΔompN(GTTTTT)∷MudK Δhfq∷TetRa;17、18:LT2ΔompN(TCTTTT)∷MudK Δhfq∷TetRa Δhfq∷TetRa.
2.5 (ARN)n序列缺失对fadL、ompN、ybfM表达的影响
通过β-半乳糖苷酶活性分析试验探知(ARN)n缺失对fadL、ompN、ybfM的蛋白表达的影响(图4).结果表明:ARN-1(AAAAAA)、ARN-2(AAAAATAAT)分别对fadL蛋白水平表达量下调72%、56%;ARN-1(GTTTTT)、ARN-2(TCTTTT)、ARN-3(ATTATT)、ARN-4(TTTGCT)缺失导致ompN蛋白表达水平分别是原菌株的1.29、1.30、0.90、1.07倍;ARN-1(AAGAGG)、ARN-2(AGCAAT)、ARN-3(AGTAAA)、ARN-4(AAAAATAGT)、ARN-5(AACAGAAAG)可提高ybfM蛋白表达水平,分别是原菌株的4.20、3.99、10.90、227.00、46.00倍.

图4 (ARN)n序列缺失菌株的β-半乳糖苷酶活性
以LT2 Δhfq∷TetRa作为供体菌,通过P22噬菌体将hfq缺失片段转入(ARN)n序列缺失指示菌株中,进行(ARN)n序列缺失指示菌株的hfq基因缺失(图5).结果表明:hfq缺失后,LT2 ΔfadL(AAAAAA)∷MudK、LT2 ΔfadL(AAAAATAAT)∷MudK中fadL蛋白水平分别下调62%、48%;LT2 ΔybfM(AAAAATAGT)∷MudK、LT2 ΔybfM(AACAGAAAG)∷MudK中ybfM蛋白水平上调,分别为对照组的4.12、7.25倍.

图5 hfq缺失后(ARN)n序列缺失菌株的β-半乳糖苷酶活性
3 讨论
在大肠杆菌中,与富含腺苷(A)复合的Hfq晶体结构显示,Hfq每亚单位在分离面上结合3个核苷酸,即是(ARN)序列,A是腺苷核苷酸,R是任何一种嘌呤核苷酸,N是任何核苷酸[6].此发现证实了Hfq的作用机制是多元化的,在促进sRNA与靶mRNA之间相互配对的同时,可以调节相应的生理活动,重塑RNA的二级结构,促进sRNA对靶mRNA的调控[7].Hfq蛋白参与靶标调控的主要方式是帮助sRNA与其靶mRNA的5′UTR结合,该区域可能是核糖体结合位点、核糖体结合位点上游或核糖体结合位点下游(包含起始密码子的区域),而与靶mRNA 3′UTR结合方式较为少见[8].在sRNA 对其靶mRNArpoS和fhlA的调控过程中,这些Hfq结合序列对于调节至关重要[9].沙门菌yifK mRNA ACA翻译增强子元件的鉴定研究表明[10],(ARN)n基序可能作为fadL、ompN、ybfMmRNA翻译增强子,缺失导致其mRNA翻译受阻.
Hfq蛋白对不同的RNA表现出明显的亲和力,其中远端面多与mRNA中5'-UTR区域进行结合,以帮助sRNA与靶标mRNA的相互作用.本试验首先对fadL、ompN、ybfMmRNA 5′UTR进行了分析,并确证了fadL、ompN、ybfM基因的转录起始位点.根据ARN基序特征,在fadL、ompN、ybfMmRNA 5′UTR 筛选到符合ARN特性的对应基序.在预测其mRNA二级结构中,(ARN)n完全或大部分处于单链状态,说明蛋白对单链结构的偏好性有着同一特征,(ARN)n具备与Hfq蛋白相互作用的条件.
为确定Hfq对fadL、ompN、ybfM的结合位点,通过对fadL、ompN、ybfM进行5′UTR进行分析及二级结构的预测,在fadLmRNA中筛选出ARN-1(AAAAAA)、ARN-2(AAAAATAAT),在ompN中筛选出ARN-1(GTTTTT)、ARN-2(TCTTTT)、ARN-3(ATTATT)、ARN-4(TTTGCT),在ybfM中筛选出ARN-1(AAGAGG)、ARN-2(AGCAAT)、ARN-3(AGTAAA)、ARN-4(AAAAATAGT)、ARN-5(AACAGAAAG),根据筛选结果构建相应的ARN基序缺失菌株.β-半乳糖苷酶活性分析试验结果表明:fadL(ARN)n位点缺失后,fadL所翻译的蛋白表达量显著降低;ompN中(ARN)n位点缺失后,ompN的蛋白表达量未出现显著变化;而ybfM(ARN)n位点缺失后,ybfM的蛋白表达量出现不同程度升高,其中ARN-4(AAAAATAGT)缺失对ybfM的影响最为显著.对部分(ARN)n指示菌株进行hfq缺失后,β-半乳糖苷酶活性分析结果表明,在(ARN)n序列缺失后,fadL中ARN-1(AAAAAA)、ARN-2(AAAAATAAT)的蛋白表达量均显著下降,ybfM中ARN-4(AAAAATAGT)、ARN-5(AACAGAAAG)的蛋白表达量均有不同程度升高.该结果表明,ompN的(ARN)n基序缺失对蛋白表达量的影响不显著,仅略微上调,这可能是因为ompN筛选出的(ARN)n基序对于Hfq调控影响不显著.而fadL、ybfM的(ARN)n基序对于Hfq调控fadL、ybfM的表达有着重要联系,进一步确证了(ARN)n基序与Hfq调控fadL、ybfMmRNA的机制有关,并推测Hfq通过与其fadL、ybfM(ARN)n基序结合从而发挥作用,但相关机制需进一步探究.
