高胰岛素血症与EGFR阳性晚期非小细胞肺癌患者一线TKIs耐药的相关性临床研究*
2022-10-08陈杼君陈维领邓才霞王文伟唐春兰
陈杼君,王 康,陈维领,邓才霞,王文伟,唐春兰,宫 亮
(陆军军医大学第一附属医院呼吸与危重症医学科,重庆 400038)
肺癌仍然是目前严重危害人类健康的重大疾病,不论是发病率和病死率均呈明显上升趋势[1]。在亚洲地区,51.5%的晚期肺腺癌患者具有驱动基因表皮生长因子受体(epidermal growth factor receptor,EGFR)基因突变,其中女性约61.1%,男性约44.0%[2]。靶向药物即酪氨酸激酶抑制剂(tyrosine kinase inhibitor,TKIs),包括吉非替尼、厄洛替尼、阿法替尼、奥西替尼等在驱动基因EGFR阳性的晚期肺腺癌患者一线治疗中显示出卓越疗效,但耐药后治疗仍面临巨大挑战。目前EGFR-TKIs耐药机制主要为T790M突变,但也仅占50%左右,且不同代TKIs的耐药机制并不完全相同,其他机制还包括抑癌基因缺失和旁路激活[3-5]。近年来,国内外有研究表明肺癌患者存在高胰岛素血症,同时高胰岛素血症相关基因,如肥胖相关因子(fat mass and obesity,FTO)、胰岛素受体、G蛋白偶联受体激酶-5(G protein-coupled receptor kinase-5,GRK-5)与肺癌发生、复发及转移均有相关性,胰岛素可通过参与多种分子通路促进肿瘤的发生、发展[6-7],目前证实其机制与协同/竞争癌细胞生长和转化关系密切的胰岛素样生长因子(insulin-like growth factor,IGF)家族有关,主要包括IGF-1,其他包括胰岛素水平升高可能刺激胰岛素受体亚型R导致癌症风险增加。此外,胰岛素还可通过调节多聚唾液酸修饰的神经细胞黏附分子(polysialylated neural cell adhesion molecule,PSA-NCAM)促进肿瘤细胞迁移和分化[8]。然而,目前高胰岛素血症与肺癌的EGFR基因突变出现TKIs耐药的关联性在国内外未见报道。因此,本研究拟探讨高胰岛素血症与EGFR阳性晚期非小细胞肺癌一线TKIs治疗后耐药的相关性,为延缓晚期EGFR阳性非小细胞肺癌耐药提供新的思路和治疗策略,现报道如下。
1 资料与方法
1.1 一般资料
回顾性收集2019年10月1日至2022年3月30日本院呼吸与危重症医学科的37例晚期非小细胞肺癌患者资料。纳入标准:(1)年龄≥18岁;(2)病理证实为非小细胞肺癌;(3)Ⅲb/Ⅳ期非小细胞肺癌;(4)美国东部肿瘤协作组(eastern cooperative oncology group,ECOG)评分≤2分;(5)组织或血、胸腔积液检测EGFR 19外显子缺失、21L858R点突变及其他罕见突变;(6)一线单药EGFR-TKIs(吉非替尼、厄罗替尼、埃克替尼、达可替尼、阿法替尼、阿美替尼、奥西替尼)治疗;(7)基线具有至少1个可测量病灶;(8)所有患者均在TKIs治疗前、治疗后达部分缓解(partial response,PR)或疾病稳定(stable disease,SD)、耐药后检测空腹血糖(fasting blood glucose,FBG)、空腹胰岛素定量(fasting insulin quantification,FIQ)、IGF-1、胰岛素样生长因子结合蛋白(insulin-like growth factor binding protein,IGFBP)-3和胰岛素抵抗指数(insulin resistance index,HOMA-IR)。排除标准:(1)肥胖(BMI为18.5~24.0 kg/m2)、糖尿病、高血压及其他肿瘤;(2)患者临床资料不完整;(3)治疗期间联合化疗、放疗或免疫治疗;(4)无完整影像学资料;(5)有症状的脑转移。37例患者中男18例,女19例,年龄42~78岁,中位年龄64岁;病理类型:腺癌36例,鳞癌1例;基线时脑转移11例,无脑转移26例;基因突变类型:EGFR 19del突变有17例,EGFR 21L858R突变18例,EGFR 18G719X 突变2例;靶向治疗药物:吉非替尼9例,厄罗替尼7例,埃克替尼1例,阿法替尼5例,达可替尼10例,阿美替尼5例。本研究通过医院伦理委员会审批(KY2022137)。
1.2 方法
1.2.1收集资料
根据纳入标准收集患者以下病例资料:性别、年龄、吸烟史、病理类型(腺癌、鳞癌)、临床分期(Ⅲb、Ⅳa/b期)、基因突变类型、ECOG评分、颅脑转移情况及TKIs治疗前、TKIs开始治疗后的影像学资料[胸部和全腹部CT、骨扫描、头颅增强磁共振成像(magnetic resonance imaging,MRI)、腹部超声、正电子发射型计算机断层显像(positron emission computed tomography,PET)-CT]、FBG、FIQ、IGF-1、IGFBP-3,根据公式计算出HOMA-IR,HOMA-IR=FIQ(mU/L)×FBG(mmol/L)/22.5。
1.2.2研究方式
(1)分析TKIs治疗前FBG、FIQ、IGF-1、IGFBP-3、HOMA-IR与性别、年龄、基因突变类型、临床分期、颅脑转移情况的相关性。(2)疗效评估。客观缓解率(objective response rate,ORR)定义为首次接受EGFR-TKs治疗之日至疾病完全缓解(complete response,CR)或PR的患者百分比。疾病控制率(disease control rate,DCR)定义为SD、CR与PR病例的总和占病例总数的百分比。无进展生存期(progression-of response,PFS)定义为从首次接受EGFR-TKIs治疗之日至首次观察到PD及任何原因所致的死亡。疗效评估按照实体肿瘤RECIST1.1标准进行。肺部可测量病灶的测量工作由两名合格的影像科医师独立完成。若两者相差<0.5 cm,则取两者的平均值,如果二者相差≥0.5 cm,则由1名副高级及以上职称的影像科医生进行判断。(3)分析TKIs治疗前、治疗后达PR或SD及耐药后FBG、FIQ、IGF-1、IGFBP-3、HOMA-IR变化值。
1.3 统计学处理

2 结 果
2.1 TKIs治疗前FBG、FIQ、IGF-1、IGFBP-3、HOMA-IR与临床各参数的相关性
TKIs治疗前FBG、FIQ、IGF-1、IGFBP-3、HOMA-IR水平与年龄、性别、基因突变类型、临床分期、颅脑转移情况无相关性(P>0.05),见表1。

表1 TKIs治疗前FBG、FIQ、IGF-1、IGFBP-3、HOMA-IR与临床各参数的相关性

续表1 TKIs治疗前FBG、FIQ、IGF-1、IGFBP-3、HOMA-IR与临床各参数的相关性
2.2 疗效评价
随访至2022年3月30日,37例患者经TKIs治疗后靶病灶都有一定程度的缩小,ORR为59%,DCR为100%。中位随访时间为18.1个月,37例患者均发生PD,中位PFS为14.08个月,见图1、2。

A:TKIs治疗后靶病灶大小较基线缩小的百分比;B:靶病灶大小较PR或SD最小值增大的百分比;横坐标为37例患者。

图2 37例患者PFS曲线
2.3 TKIs治疗前、治疗后达PR或SD及耐药后FBG、FIQ、IGF-1、IGFBP-3、HOMA-IR变化值
TKIs治疗前FBG与TKIs治疗后达PR或SD及耐药后比较,差异无统计学意义(P>0.05)。TKIs治疗后达PR或SD的FIQ、HOMA-IR与TKIs治疗前比较,差异无统计学意义(P>0.05)。耐药后FIQ和HOMA-IR明显高于TKIs治疗前及TKIs治疗后达PR或SD(P<0.05)。TKIs治疗后达PR或SD的IGF-1及IGFBP-3较TKIs治疗前明显降低,而耐药后明显升高(P<0.05),见图3。
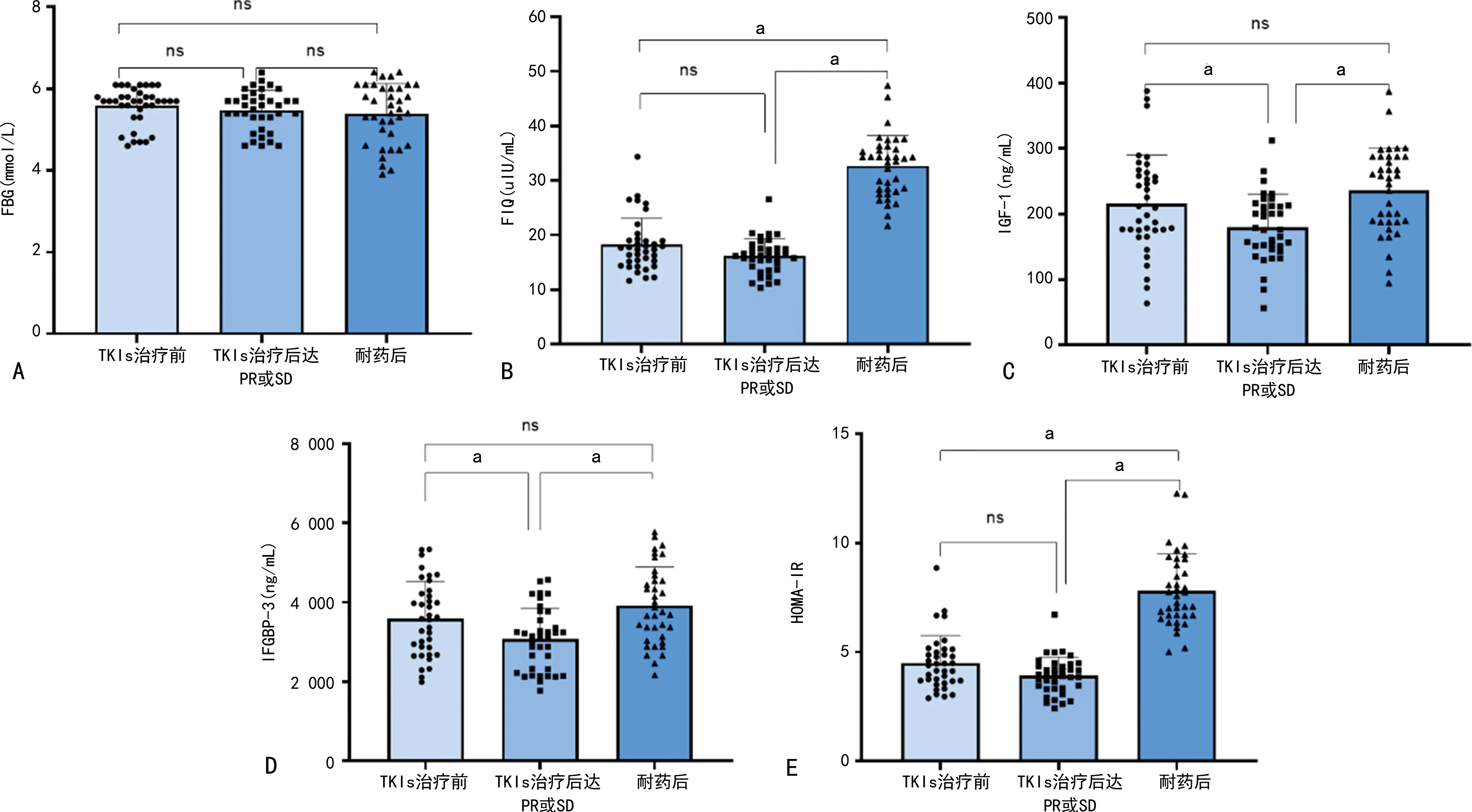
A:FBG;B:FIQ;C:IGF-1;D:IGFBP-3;E:HOMA-IR;a:P<0.05;ns:P>0.05。
2.4 预后的单因素和多因素COX回归分析
分类变量按排序进行分组,见表2。单因素COX回归分析结果显示,高FIQ(≥32.24 μIU/mL)、高HOMA-IR(≥7.70)是肺癌患者预后不良的影响因素(P<0.05)。多因素COX回归分析结果显示,高FIQ(≥32.24 μIU/mL)是肺癌患者预后不良的独立危险因素(P<0.05),见表3。
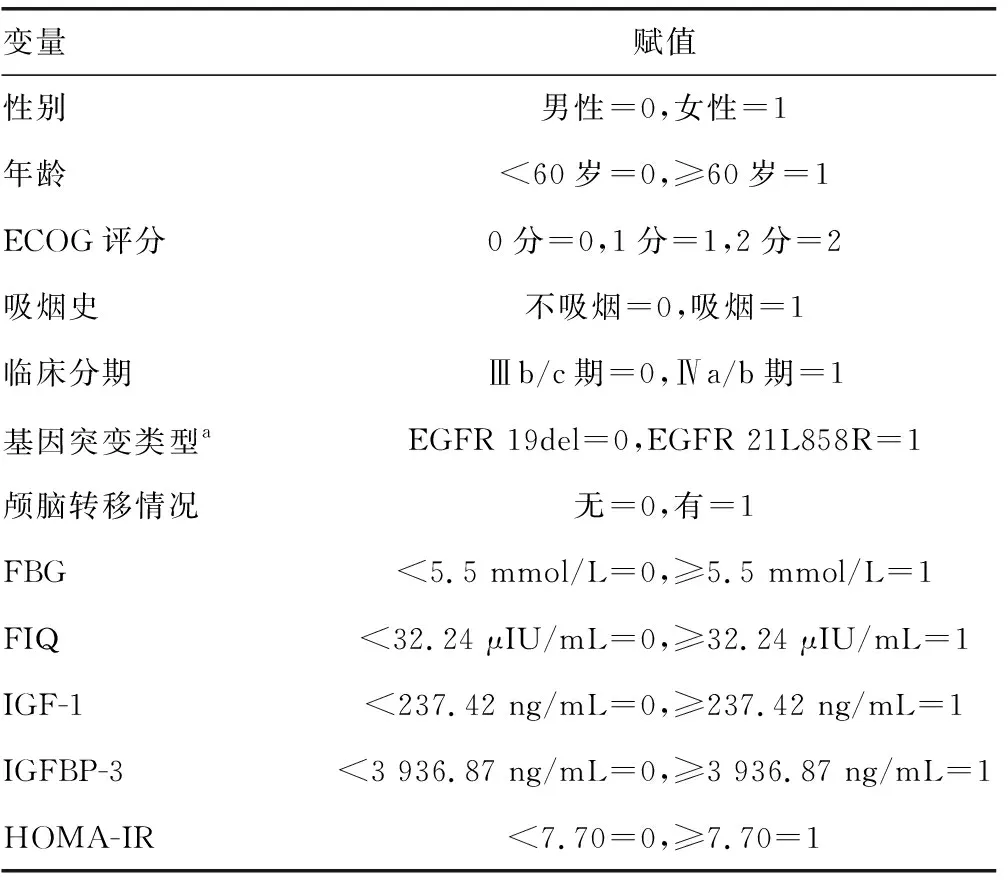
表2 变量赋值表

表3 37例患者预后因素的单因素和多因素COX分析
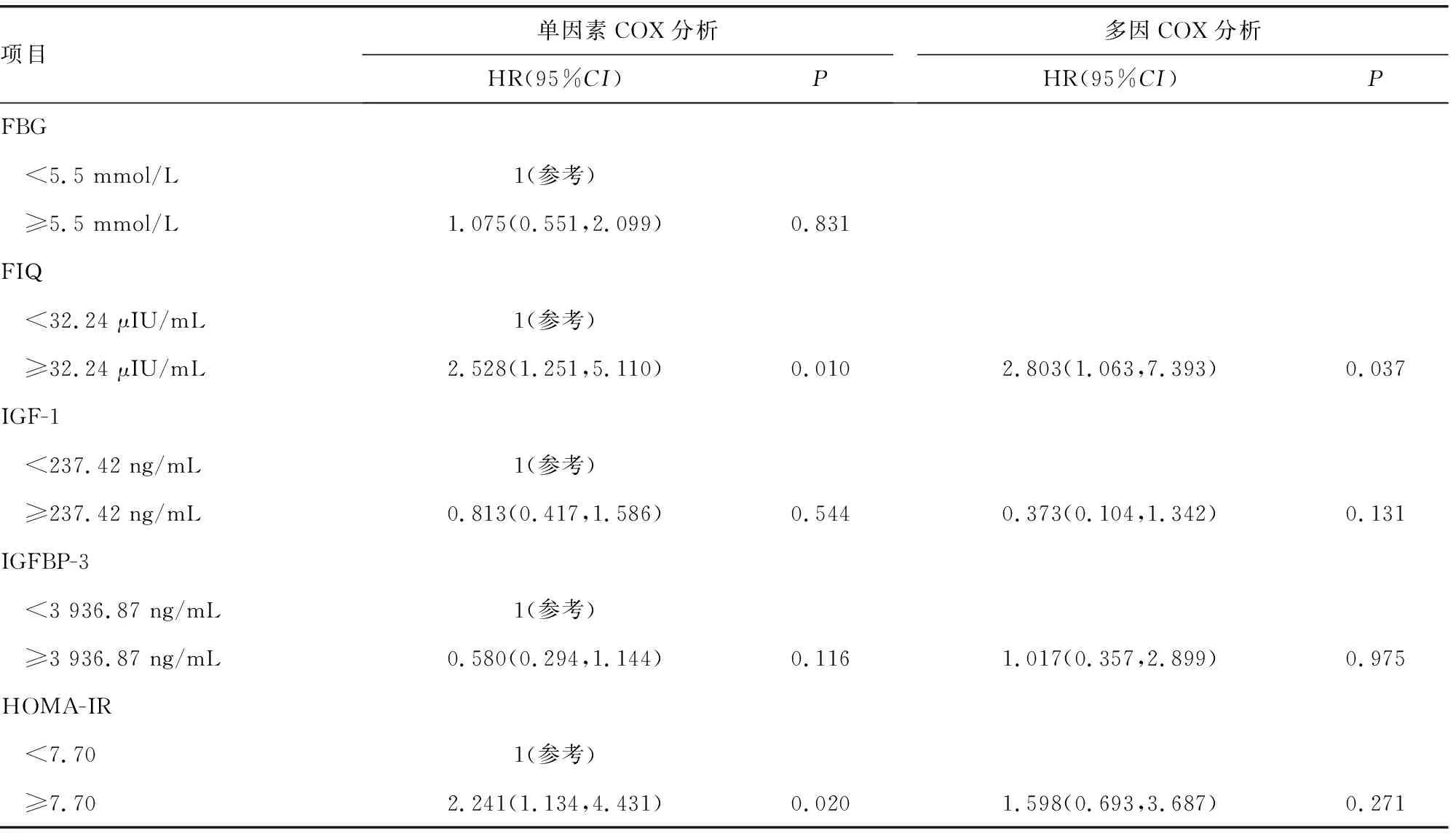
续表3 37例患者预后因素的单因素和多因素COX分析
3 讨 论
根据美国癌症协会发布的2022年癌症统计,肺癌依旧是发病率第二、全球病死率第一的恶性肿瘤[9]。非小细胞肺癌占所有肺癌的85%~90%[10],包括腺癌、鳞癌、腺鳞癌、大细胞癌、类癌及其他[11]。除了传统的手术、放化疗,非小细胞肺癌的靶向治疗已经成为肺癌治疗中的重要疗法,不仅明显提高了肺癌患者的生存期,不良反应还小。EGFR基因突变是非小细胞肺癌中最常见的基因突变,在亚裔和我国人群的发生率较高,占非小细胞肺癌的30%~35%,其他还包括ALK、ROS1、BRAF、MET、RET、ERBB2、NTRK、KRAS等基因突变。EGFR在正常细胞和肿瘤细胞中均有表达,在细胞的生长分化中起重要作用,非小细胞肺癌的癌细胞中EGFR基因突变可促进肿瘤细胞生长,抑制细胞凋亡,增加血管生成因子的产生,以及促进肿瘤转移[12]。EGFR-TKIs可抑制酪氨酸的自体磷酸化,进而抑制下游信号通路传导,包括PI3K/AKT/mTOR和RAS/RAF/MEK/ERK等信号通路,从而阻止EGFR依赖的细胞增殖,抑制肿瘤增殖。尽管EGFR基因突变型非小细胞肺癌研究取得了重大进展,但仍存在一些挑战,其中一个不可避免的问题是耐药性的出现。因此,对EGFR-TKIs的耐药机制研究仍是目前的热点。
EGFR-TKIs耐药包括原发性耐药和继发性耐药,EGFR T790M突变是非小细胞肺癌应用EGFR-TKIs药物继发性耐药最常见的原因,其他包括旁路激活,如MET、HER、HER3的激活,下游通路的激活,BRAF基因突变或PI3K信号通路激活,组织学类型的转变,向小细胞肺癌转化或发生上皮间质转化[13-15]。胰岛素受体的经典信号通路为其与胰岛素的结合,在非依赖EGFR通路的旁路激活的胰岛素样生长因子-1受体(insulin-like growth factor-1 receptor,IGF-1R)通路,通过下游PI3K/AKT信号通路参与调节细胞生长、分化、凋亡、转化和其他重要的生理过程[16]。相关研究显示,IGF-1R导致EGFR-TKIs继发耐药也主要是通过PI3K/AKT信号通路实现的,可通过应用IGF-1R抑制剂联合EGFR-TKIs治疗来克服耐药[17-18]。胰岛素具有促进有丝分裂和细胞增殖作用,胰岛素的生物学效应取决于IFG-1家族的细胞表面受体的相互作用,以高胰岛素血症为特征的代谢性疾病(肥胖和2型糖尿病)与癌症风险增加和癌症相关死亡率增加有关,因此,胰岛素过量被认为是患者的促癌因子[19]。胰岛素水平的升高也可以通过减少肝脏IGFBP的产生间接促进细胞生长,从而增加生物活性游离IGF-1,这是一种有效的促有丝分裂和抗凋亡因子,已知导致癌症生长,同时高胰岛素血症也可通过增加透明质酸合成促进癌症的扩散,最终导致癌症的发生。IGFBP-3是IGFBP家族6种结合蛋白中血清水平最高的一种,作为一种多功能蛋白,IGFBP-3可以抑制细胞生长并诱导凋亡。IGFBP-3是IGF-1的转运蛋白,IGFBP-3可以通过延长IGF-1的半衰期、限制其与IGF-1R的结合来调控IGF-1的生物活性,从而抑制细胞增殖。此外,IGFBP-3还可以在IGF-1非依赖的情况下参与多条细胞信号通路(如Smad/TGF-β信号通路)调控肿瘤的发生、发展、转移及复发[20]。因此,胰岛素与癌症的关系已成为一个临床相关问题。据笔者所知,目前国内外研究尚未明确高胰岛素血症对癌症发生、抗肿瘤治疗后疾病发展及预后的关系,笔者也提出高胰岛素血症与EGFR阳性晚期非小细胞肺癌患者一线TKIs耐药相关。
TAS等[21]的一项临床研究纳入80例肺癌患者和30例健康人,发现二者之间的基线血清胰岛素、IGF-1水平无差异(胰岛素中位数分别为19.25、16.46 μIU/mL,P=0.532;IGF-1中位数分别为145.5、160.5 ng/mL,P=0.403),但与健康人比较,肺癌患者的基线血清IGFBP-3水平明显降低(中位数分别为3.175、4.235 μg/mL,P<0.001)。本研究对收集的37例患者的临床基本资料进行分析,发现没有高胰岛素血症的危险因素如肥胖、糖尿病、代谢综合征的患者初次诊断为非小细胞肺癌时,其FBG、FIQ、IGFBP-3、HOMA-IR与性别、年龄、基因突变类型、临床分期、颅脑转移情况均无相关性(P>0.05),与上述研究结果一致。XUE等[22]研究发现,IGFBP-3在胃癌组织中的表达水平明显低于癌旁组织,而高表达往往对应着更长的生存期,这可能与IGFBP-3还可以在IGF-1非依赖的情况下参与多条细胞信号通路调控肿瘤的发生、发展有关。目前国内外大规模的、以人群为基础的研究均聚焦于糖尿病患者FBG、FIQ、HOMA-IR与肺癌发生和预后存在明显关联[23-24],未提出在抗肿瘤治疗过程中上述指标变化趋势。而本研究提示在TKIs治疗非小细胞肺癌的过程中,动态观察胰岛素水平可预警TKIs是否出现耐药。在不同肺癌类型中,腺癌组织中胰岛素水平远高于鳞癌和小细胞肺癌,且与年龄、性别、分化程度无明显相关性,但值得注意的是,在TNM分期(Ⅲ+Ⅳ)和伴有淋巴结转移的患者肺组织中,胰岛素及胰岛素受体的表达水平更高。KIM等[25]通过对459例接受根治性肺癌切除术的患者进行平均4年的随访,证实胰岛素受体水平与非小细胞肺癌的术后复发直接相关,与胰岛素受体表达水平低的患者相比,胰岛素受体表达水平高的患者无复发,但生存期更短。多变量分析显示胰岛素受体是非小细胞肺癌患者总生存期较短的独立预测标志物,尤其是肺鳞癌患者。近年来,腺癌已经超越鳞癌成为最常见的肺癌。本研究通过对37例患者进行随访,发现其中36例肺腺癌患者耐药后FIQ、HOMA-IR较TKIs治疗前及治疗后达PR或SD时明显升高,进一步按照预后因素进行单因素和多因素COX回归分析,结果显示高FIQ是肺癌患者预后不良的独立危险因素,提示高胰岛素血症与EGFR阳性晚期非小细胞肺癌患者生存期可能存在负相关。
综上所述,高胰岛素血症与EGFR阳性晚期非小细胞肺癌患者一线TKIs耐药及预后不良相关,特别是肺腺癌患者,这为延缓晚期EGFR阳性耐药提供了新的思路和治疗策略。但不足之处在于,本研究为回顾性研究,样本量较少,可能使统计结果产生偏倚,与目前国内外研究存在小部分差异。后期将继续搜集病例,进行前瞻性研究,优化研究条件,综合临床、病理数据全面分析,对所有PD患者肺部病灶进行二次活检,通过组织检测FIQ、IGF-1、胰岛素受体的表达水平,从机制延伸至临床,使所得结果对临床产生更加深远的决策意义。
