多杀性巴氏杆菌脂多糖刺激羊支气管上皮细胞后的转录组测序与分析
2022-10-06吴艳茹陈巧玲刘志勇李崇瑞黄惠娴王雪梅满初日嘎王凤阳
吴艳茹,陈巧玲,刘志勇,李崇瑞,黄惠娴,翟 哲,王雪梅,满初日嘎,杜 丽,王凤阳
(海南大学动物科技学/海南省热带动物繁育与疫病研究重点实验室/海口市动物基因工程重点实验室,海南 海口 570228)
多杀性巴氏杆菌(Pasteurella multocida,Pm)是一种革兰氏阴性、兼性厌氧、不产生孢子的球状杆菌,能够感染多种家养和野生哺乳动物、鸟类和爬行动物以及人类[1]。Pm 可分为5 个荚膜血清组(A、B、D、E 和F)和16 个脂多糖(LPS)血清型(血清型1~16),禽霍乱主要由A:1、A:3 和A:4 血清型引起,牛出血性败血症主要由B:2 和E:2 血清型引起,猪的进行性萎缩性鼻炎主要由A 和D 血清型引起,牛呼吸道疾病主要由A:3 血清型引起,兔巴氏杆菌病主要由B:2 和E:2 血清型引起,羊巴氏杆菌病主要由A 和D 血清型引起[2-5]。在山羊和绵羊中,Pm 是类似于溶血性曼氏杆菌的条件性致病菌,主要引起机体以肺部病变为主的巴氏杆菌病[6]。对Pm感染后有临床症状羊的检测结果显示,病原菌主要存在于其内脏、淋巴结、血液及部分病变组织中,而对Pm 感染后无临床症状羊的检测结果显示,病原菌主要存在于其黏膜、上呼吸道以及扁桃体中[7]。Pm严重危害羊的健康,养羊业也因此遭受重大经济损失[8]。尽管如此,Pm 的致病机制仍尚未明确。
脂多糖(Lipopolysaccharide,LPS)是Pm 的主要毒力因子,也是革兰氏阴性菌细胞外膜的主要成分[9],因此,LPS 在细菌与环境的相互作用中起至关重要的作用,并与膜屏障功能、细菌毒力和宿主免疫密切相关[10]。在病原体中,LPS 通过直接与宿主固有免疫系统(如抗菌肽和补体成分)的相互作用,在疾病的发展过程中发挥重要作用,如LPS 可以通过与Toll 样受体4(TLR4,在某些细菌中为TLR2)的相互作用引起宿主强烈的固有免疫反应,激活一系列宿主免疫细胞,从而引起细胞因子风暴和宿主死亡[11]。疫苗是防控疾病最经济、有效的手段,LPS具有良好的免疫原性,其特异性抗体可介导针对同源菌株和LPS 结构相似菌株的免疫保护,因而LPS成为Pm 疫苗的重要研究对象[12]。羊的巴氏杆菌病主要由荚膜血清D 型和A 型引起,目前对羊源Pm LPS研究较少,对其在Pm 侵入羊机体过程中发挥的具体作用以及引起的宿主免疫学变化还有待研究。
本实验利用荚膜血清D 型和A 型Pm LPS(D-LPS和A-LPS)刺激羊支气管上皮细胞6 h 后,通过转录组学测序与分析获得的转录差异基因,并对转录差异基因进行GO功能注释和KEGG富集分析,为Pm LPS与宿主相互作用及其致病机制和疫苗的研发提供参考依据。
1 材料与方法
1.1 主要实验材料D 型Pm HN01 株(cp037861)和A 型Pm HN02 株(cp037865.1)由本实验室分离;LPS Extraction Kit 购自iNtRON 公司;羊支气管上皮细胞SHP-iCell-a008、双抗(青霉素/链霉素)和胰酶均购自赛百慷(上海)生物技术股份有限公司;RPMI 1640 液体培养基(含双抗)购自博士德生物工程有限公司;胎牛血清(用于配制含10% FBS 的培养基)购自美国Gibco 公司;O111:B4 血清型大肠杆菌LPS冻干粉购自Sigma 公司;cDNA 文库建库试剂盒购自诺唯赞公司;荧光定量PCR 引物由武汉天一华煜基因科技有限公司合成。D-LPS 和A-LPS 由实验室制备,并由银染法鉴定[13]。
1.2 LPS 刺激羊支气管上皮细胞将羊支气管上皮细胞以5×105个细胞/孔铺于六孔细胞培养板中。分为实验组和对照组,每组各作3 个重复(A-LPS-1~A-LPS-3、D-LPS-1~D-LPS-3、NC-1~NC-3)。实验组加入2 mL 含LPS 的DMEM 完全培养基使其终浓度为1 μg/mL,对照组加入等体积的DMEM 完全培养基,刺激细胞6 h 后,每孔加1 mL 裂解液裂解细胞后移至冻存管中,迅速放入液氮冷冻,邮寄至上海派森诺生物科技有限公司。并由其构建各组细胞的cDNA 文库及基于Illumina HiSeqTM6000 测序平台,对构建的文库经双末端(Paired-end,PE)测序。
1.3 数据质控为保证数据的可靠性对测序结果采用下述方式过滤,(1)采用Cutadapt 去除3'端带接头的序列;(2)去除低质量reads[Q20(%)或Q30(%)低于90%];(3)去除含N(即无法识别的碱基)比例大于5%的reads。同时统计有效测序量(Clean data)、高质量序列reads(Clean reads No.)、Q30(碱基识别准确率在99.9%以上的碱基总数)、N(%)(模糊碱基所占百分比)、Q20(%)(碱基识别准确率在99%以上的碱基所占百分比)和Q30(%)(碱基识别准确率在99.9%以上的碱基所占百分比)。
1.4 转录差异基因的筛选及聚类分析采用DESeq2(R 语言软件包,用于测序数据的标准化、可视化和差异分析)筛选各组之间转录差异的基因(筛选标准log2(Fold Change)>1,P<0.05),利用ggplots2绘制转录差异基因的火山图。利用Pheatmap 分析各组的组内重复性,并绘制热图对各组转录差异基因并集和对样品进行双向聚类分析。
1.5 转录差异基因的GO 功能注释和KEGG 富集分析利用top GO 对转录差异基因进行GO 聚类分析,分析时利用GO term 注释的差异基因计算每个term 的基因列表和基因数目,筛选出与整个山羊参考基因组背景(Capra hircus.ARS1.dna.toplevel.fa)相比,差异基因显著富集的GO term(显著富集的标准为P<0.05),从而确定差异基因行使的主要生物学功能。按照分子功能(Molecular function,MF)、生物过程(Biological process,BP)和细胞组分(Cellular components,CC)对转录差异基因的GO 功能注释分析结果进行GO 分类,将P值由小到大选出每组前10 的GO term。采用KEGG 富集分析转录差异基因(P<0.05),并根据该结果,挑选P值最小即富集最显著的前20 个信号通路。
1.6 转录差异基因的RT-qPCR 验证从D-LPS 和A-LPS 两组测序数据中各随机选取共13 个转录差异基因进行下述RT-qPCR 验证。LPS 刺激细胞后6 h,收集各组细胞,采用TRIzol 法提取细胞样品的RNA,反转录为cDNA 后作为模板,以GAPDH 作为内参基因(引物序列见表1),经RT-qPCR 验证转录组测序结果的准确性。根据2-ΔΔCt计算各基因的相对转录水平,采用GraphPad Prism8统计软件作图。

表1 RT-qPCR引物Table 1 RT-qPCR primers used in this study
2 结 果
2.1 各组细胞cDNA 文库测序数据的整理与质控结果对构建的各组细胞的cDNA文库(浓度是10 ng/μL~20 ng/μL),采用基于Illumina HiSeqTM6000 测序平台的NGS 经PE 测序。并对原始测序数据经过滤后获得有效测序量和高质量序列碱基数。结果显示平均有效测序量达182 亿个,平均高质量序列reads 数达1.22 亿个且Q20 和Q30 值均大于90%,N 值均小于0.002%(表2),表明质控后得到了高质量的测序数据,证实了转录组测序数据的可靠性。
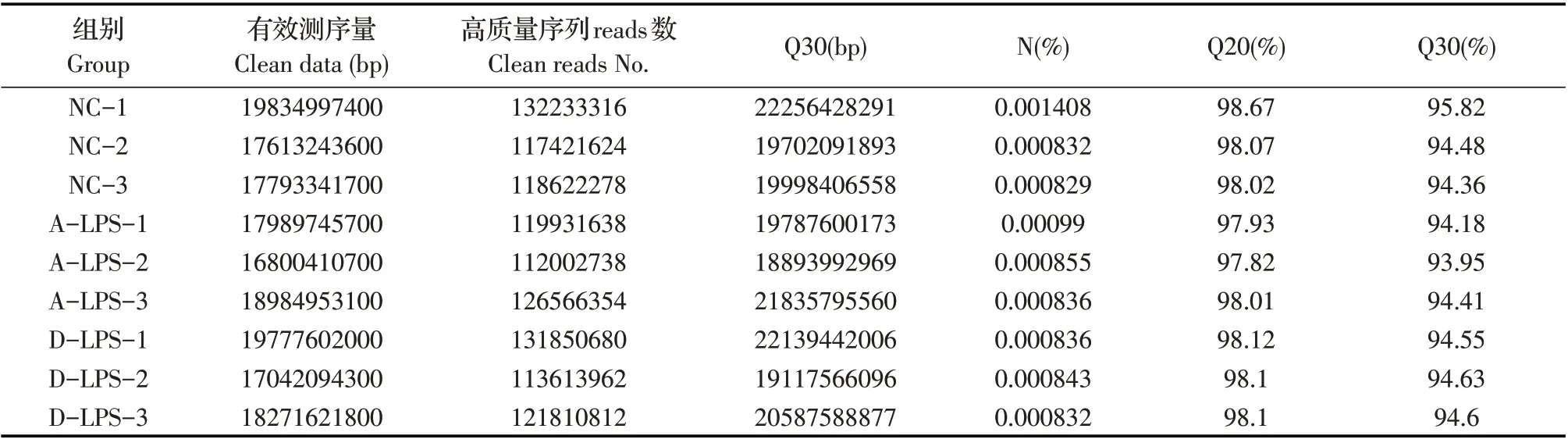
表2 测序数据统计分析Table 2 Statistical analysis of sequencing data
2.2 各组之间转录差异基因的筛选与聚类分析利用DESeq2 对各组转录组数据进行差异分析,设置筛选转录差异基因的标准为log2(Fold Change)≥1 和P<0.05。结果显示,D-LPS 中共有显著转录差异基因86 个,其中转录显著上调的基因62 个,转录显著下调的基因24 个。A-LPS 中共有显著转录差异基因56 个,其中转录显著上调的基因27 个,转录显著下调的基因29 个(图1),两组共同转录差异基因6 个,分别是LOC102172606、EFNA2、NCMAP、ADAMTS5、LRRIQ3、 ENSCHIG00000016421。 采 用Pheatmap 分析各组的组内重复性,并对转录组数据进行转录差异基因的聚类分析,结果显示,实验组和对照组的组内重复性均较好,且羊支气管上皮细胞经LPS 刺激前后基因的转录水平存在明显的差异(图2)。综上表明,经Pm LPS 刺激的羊支气管上皮细胞中存在转录显著差异的基因且各组组内重复性良好,可以进行后续的GO 功能注释和KEGG 富集分析。
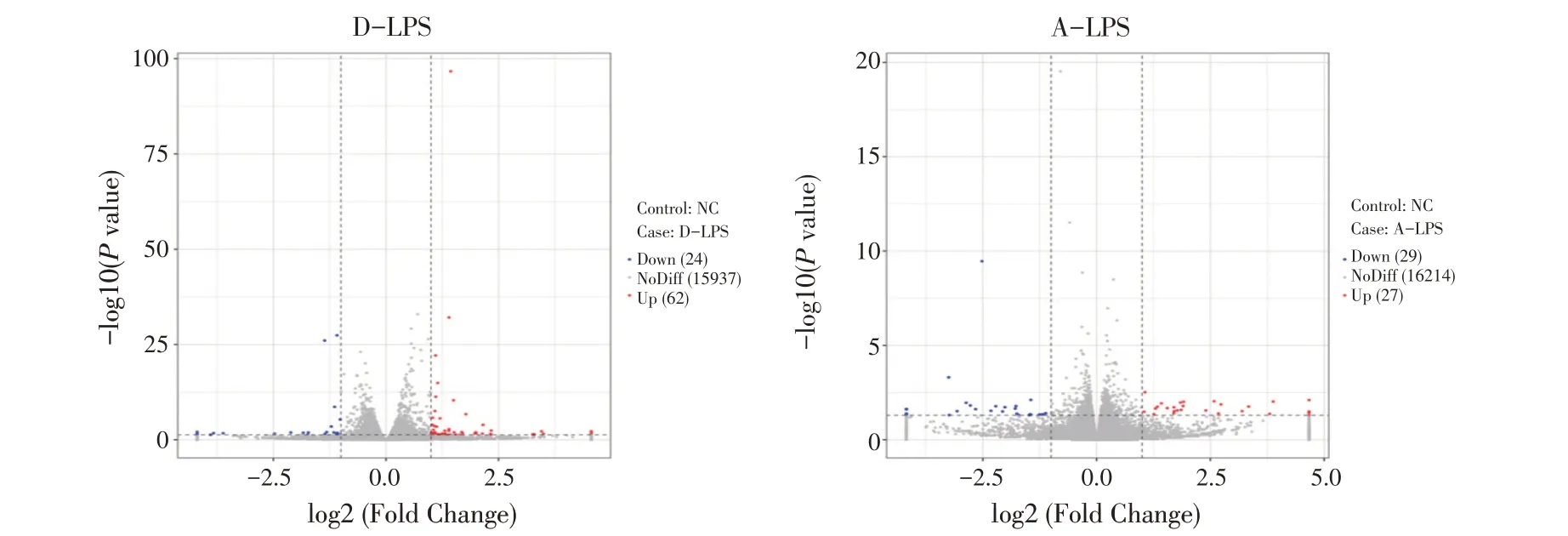
图1 各组转录差异基因的火山图分析Fig.1 Volcano map analysis of transcriptional differential genes between two groups

图2 各组转录差异基因的热图分析Fig.2 Heat map analysis of transcriptional differential genes between two groups
2.3 转录差异基因的GO 功能注释分析对D-LPS和A-LPS 两组中转录差异基因进行GO 功能注释分析。结果显示, D-LPS 组中共显著富集到243 个GO term,包括146 个BP、44 个CC、53 个MF;A-LPS 组中共显著富集到167 个GO term,包括109 个BP、19个CC、39 个MF。按照P值由小到大排列,取每组生物学功能前10的GO term进行分析,结果显示,在DLPS 中显著富集的term 包括RAGE 受体结合(RAGE receptor binding,GO:0050786)、ATP 生物合成过程(ATP biosynthetic process,GO:0006754)、NADH脱氢酶活性(NADH dehydrogenase activity,GO:0003954)、嘌呤核糖核苷三磷酸生物合成过程(Purine ribonucleoside triphosphate biosynthetic process,GO:0009206)、氧化还原酶活性,作用于NAD(P)H、醌或类似化合物作为受体(oxidoreductase activity,acting on NAD(P)H,quinone or similar compound as acceptor GO:0016655)等(图3A),主要与免疫和能量生成代谢相关,表明D-LPS 刺激细胞后,细胞的免疫应答、细胞增殖分化等活动比较活跃;而在A-LPS 中富集的term 包括IL-11 受体结合(Interleukin-11 receptor binding,GO:0005142)、磷脂酶A2 活性(phospholipase A2 activity,GO:0004623)、GTP 酶活性(GTPase activity,GO:0003924)和尿嘧啶分解代谢过程(Uracil catabolic process,GO:0006212)等(图3B),表明A-LPS 刺激羊支气管上皮细胞后可能影响宿主细胞的代谢、免疫应答等通路。
2.4 转录差异基因的KEGG 富集分析对转录差异基因进行KEGG 富集分析,根据P值由小到大排列,每组共展示了前20 条的富集通路。结果显示,D-LPS 组显著富集到细胞氧化磷酸化、产热、疾病以及ECM-受体相互作用途径等通路(图4A);ALPS 组显著富集到Ras 信号通路以及泛酸和辅酶A 生物合成等信号通路(图4B)。两组数据KEGG 分析均富集到了能量生成与细胞增殖分化相关通路,表明D-LPS 和A-LPS 均会影响宿主细胞的能量生成与细胞增殖。

图4 各组转录差异基因的KEGG富集分析Fig.4 KEGG enrichment analysis of transcriptional differential genes between two groups
2.5 转录组测序结果的RT-qPCR 验证为了验证转录组测序数据的准确性,本研究从D-LPS、ALPS 两组中各随机筛选出共13 个转录差异基因经RT-qPCR 验证并分别与转录组数据比较。结果显示,11 个基因转录水平的上下调结果与转录组测序结果完全一致(图5),表明利用转录组测序获得的结果虽存在一定偏差但可靠性仍较高,可以较真实反映经不同血清型Pm LPS 刺激后的羊支气管上皮细胞转录组学的差异水平。
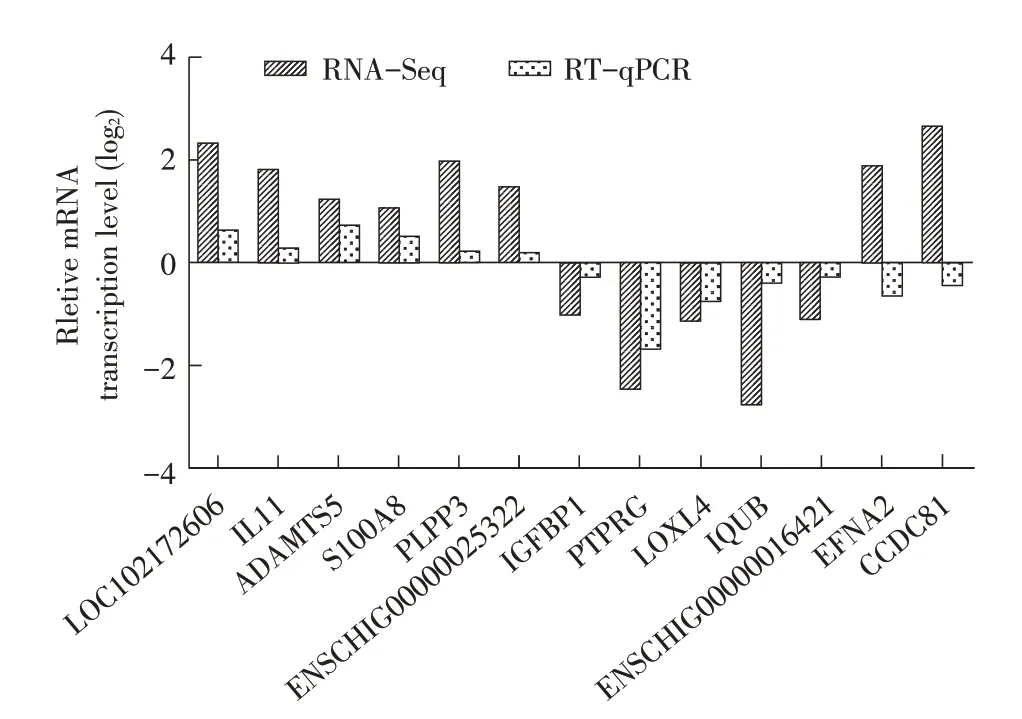
图5 转录差异基因的RT-qPCR验证Fig.5 RT-qPCR verification of transcriptional differential gene
3 讨 论
Pm 是一种常见的动物性致病菌,根据其荚膜抗原分为5 种血清型(A、B、D、E 和F)[14]。在我国主要流行的是A、B、D 这3 种血清型。本实验室前期从病羊中分离到的荚膜血清D 型Pm HN01 株可引起小鼠的肺泡损伤[15],荚膜血清A 型Pm HN02 株经PCR 鉴定发现携带fimA、toxA、exbB、exbD等12 个毒力基因[16]。后续本实验室分别利用D 型和A 型Pm感染小鼠,结果显示D 型菌株毒力强于A 型菌株(文章未发表)。LPS 是Pm 的主要毒力因子,Horadagoda 等将B 型Pm LPS 注射到水牛体内可以引发牛的出血性败血症[17]。Periasamy 利用B 型Pm LPS 刺激能够引起牛白细胞线粒体功能障碍并导致细胞死亡[18],表明Pm LPS 具有内毒素特性。由于目前关于Pm LPS 的相关研究较少,为确定Pm LPS 是否是造成D 型和A 型Pm 毒力不同的关键因子以及探究LPS对宿主的致病机制,本实验分别利用D 型和A 型Pm LPS 刺激羊支气管上皮细胞,6 h 后收获各组细胞,裂解后进行转录组测序,测序数据经过滤后,最终从D-LPS 组筛选出上调的转录差异基因62 个,下调的转录差异基因24 个,A-LPS 组筛选出上调的转录差异基因27 个,下调的转录差异基因29 个,DLPS 组转录差异基因的数量多于A-LPS 组,推测可能与D 型菌株毒力强于A 型菌株有关。D-LPS 组转录差异基因的GO 功能注释结果显示,显著富集且与免疫相关的生物学过程为RAGE 受体结合,该过程包含基因S100A8 和S100A12。S100A8 和S100A12 属于S100家族的钙结合蛋白,S100 家族与多种宿主免疫信号和细胞因子的产生和分泌有关,能引发全身炎症反应和继发性器官衰竭[19]。革兰氏阴性菌可引起患者刺激性休克,其体内高水平的S100A8 可以激活RAGE 信号并导致炎症损伤,这与本实验结果一致,并且在革兰氏阴性菌刺激过程中,S100A8 作为TLR4的配体,被强烈诱导表达[20]。不仅如此,S100A8通常与S100A9以异二聚体的形式存在,在体外,S100A8/A9 可以抑制中性粒细胞的氧化代谢,清除释放的活性氧(ROS),减轻LPS 刺激小鼠肺和肝脏的氧化损伤[21]。并且S100A8 在气道上皮细胞中可降低促炎细胞因子的分泌水平[22]。这或许是D-LPS 组转录差异基因中无氧化应激相关基因和促炎细胞因子基因的原因。对A-LPS 组转录差异基因进行GO 功能注释分析显示,显著富集且与免疫相关的生物学过程为IL-11 与受体的结合,该过程涉及到细胞因子IL-11。IL-11是糖蛋白(GP)130细胞因子家族的成员,与其他促炎细胞因子不同,IL-11是一种抗炎细胞因子[23],其抗炎作用的机制是抑制LPS 介导的NO、肿瘤坏死因子-α(TNF-α)、IL-1β、IL-12、IL-10、转化生长因子-β(TGF-β)和IL-6的释放,以及刺激可溶性的肿瘤坏死因子-αR1(TNF-αR1)直接拮抗巨噬细胞/单核细胞诱导的TNF-α 信号转导[24]。在体内和体外模型中,IL-11 也被证明通过激活内皮细胞来减少炎症对其的相关损伤,从而在免疫介导的损伤中起到保护宿主细胞的作用[25]。本实验中是否因为IL-11 的显著上调导致炎症相关基因与通路均无显著变化,后续还值得探究。Mao 的研究表明人类磷脂磷酸酶3(PLPP3)启动子包含3 个功能性NF-κB 响应元件,因此人类PLPP3 启动子对NF-κB 通路的激活高度敏感[26]。多种细胞被刺激后的PLPP3 表达水平显著上调[27-28],这与本实验中D-LPS 组的结果一致。
KEGG 富集分析结果显示,在D-LPS 组中显著富集到的通路有氧化磷酸化、产热、ECM-受体相互作用、视黄醇代谢、铂类耐药等,涉及到能量生成与细胞增殖分化;在A-LPS 组中显著富集到的通路有泛酸和辅酶A、Ras 信号通路等,同样也涉及到能量生成与细胞增殖。本实验中,D-LPS 组中与细胞凋亡相关的基因MAP2K6 显著上调,与抑制细胞凋亡相关的基因BIRC5 显著下调; A-LPS 组中与细胞凋亡相关的基因MXRA8 和BEX3 均显著下调。Periasamy 的研究结果显示,A、B 型Pm LPS 均能够诱导牛白细胞(包括淋巴细胞、中性粒细胞、单核细胞和单核巨噬细胞)的凋亡,导致组织损伤[18],与本实验D-LPS 组的结果一致。据此推测D-LPS 会引起细胞凋亡,从而导致宿主损伤;但A-LPS 组中与细胞凋亡相关基因显著下调是否和A 型菌株毒力较弱有关,还有待深入研究。GO 和KEGG 分析结果表明,两组转录差异基因均与细胞免疫、细胞增殖分化、能量产生代谢等信号通路和功能有关。表明DLPS 和A-LPS 均能影响宿主细胞的免疫、增殖分化和能量的生成与代谢。
本研究选取了D-LPS、A-LPS 两组中13 个转录差异基因进行RT-qPCR 验证,其中11 个基因的检测结果与转录组测序结果一致,表明转录组测序结果基本可靠。并且RT-qPCR 结果验证了与免疫相关的基因IL-11、S100A8 转录水平显著上调,与氧化还原酶活性相关的基因LOXL4 转录水平显著下调,与能量代谢相关的基因IGFBP1 转录水平显著下调,进一步表明Pm LPS 刺激羊支气管上皮细胞会影响其免疫功能和能量的生成与代谢。
综上所述,本实验采用转录组测序技术筛选并分析了D-LPS 和A-LPS 刺激羊支气管上皮细胞后的免疫、能量生成与代谢以及细胞凋亡的相关基因变化及其所富集的通路。为进一步探究Pm LPS 的致病机理及Pm 疫苗的研发奠定了基础。
