肾气丸减轻糖尿病ZDF大鼠的肾损伤研究
2022-10-03刘雨梦李姝玉冯婧车宇娥张晓凤刘嘉鹏王
刘雨梦李姝玉冯 婧车宇娥张晓凤刘嘉鹏王 谦
(北京中医药大学中医学院,北京 100029)
糖尿病肾脏疾病(diabetic kidney disease,DKD)是终末期肾病的主要病因之一,可见肾小球系膜基质增多,基膜增厚,间质纤维化等病变[1]。DKD的发病机制复杂,研究认为血流动力学改变、促炎因子、氧化应激反应以及遗传因素等均与其发生发展有关[2]。内质网应激(endoplasmic reticulum stress,ERS)的激活是引起DKD的机制之一,通过调节细胞ERS,可以改善肾组织病变[3]。
DKD在中医学中属于“消渴”“消肾”“虚劳”“关格”等范畴,中医病机复杂,但其本虚标实各家已经达成共识,肾气丸作为《金匮要略》的代表方剂之一,有填精益髓、滋肾阴补肾阳的功效,对于阴阳两虚的消渴有较好疗效[4]。基于网络药理学和现代药理学研究,肾气丸成分复杂,相辅相成,存在58个活性靶点和107条信号通路与2型糖尿病直接相关[5],在这其中肾气丸可能通过氧化应激,内质网应激,自噬等通路来发挥治疗作用。在我们以往的研究中也发现肾气丸可以保护2型糖尿病小鼠的肾功能,降低GRP78、PERK等因子的表达,减轻内质网应激。因此本研究以糖尿病ZDF大鼠为模型,观察在其病情进展过程中肾气丸对其血糖及肾组织的影响并探讨其作用机制,是否可能通过调节PERK通路缓解ERS,从而减轻糖尿病肾损伤。
1 材料和方法
1.1 实验动物
SPF级雄性ZDF(fa/fa)大鼠和ZDF(fa/+)大鼠,其中ZDF(fa/fa)大鼠20只,体重400~420 g;ZDF(fa/+)大鼠7只,体重350~370 g;所有大鼠均为12周龄,购自北京维通利华实验动物技术有限公司[SCXK(京)2021-0011]。动物饲养于中日友好医院临床研究所动物实验平台[SYXK(京)2016-0043],饲养环境为屏障内独立通风系统,室温23℃~25℃,相对湿度50%~60%,每日光照时间不超过12 h。饲养期间各组大鼠进食饮水不受限制,ZDF(fa/fa)大鼠是经5C08优质啮齿类饲料诱导4周建立糖尿病模型后改用普通饲料饲养,ZDF(fa/+)大鼠一直用普通饲料饲养。5C08优质啮齿类饲料进口登记证号:(2017)外饲准字354号,普通饲料由中日友好医院临床研究所动物实验平台提供。动物操作及取材在北京中医药大学实验室进行[SYXK(京)2020-0033]。本研究经北京中医药大学伦理委员会批准(BUCM-4-2021102801-4034),并按实验动物使用的3R原则给予人道的关怀。
1.2 主要试剂与仪器
根据2015年第一版《伤寒论方药剂量与配伍比例研究》[6]得出实验所需组方剂量为:熟地黄24 g、山药12 g、山茱萸12 g、泽泻9 g、茯苓9 g、牡丹皮9 g、桂枝3 g、炮附子3 g。生药购于北京同仁堂股份有限公司。制备肾气丸水煎液,生药蒸馏水浸泡2 h后,炮附子先煎30 min,剩余药物一起煎煮1~1.5 h,待药液降至室温后浓缩并用无菌纱布过滤,过滤液分装并于-20℃冻存。每只大鼠每日给药量为8.12 g/kg,给药浓度为0.812 g/mL,约为人用量的6倍。生理盐水,规格:500 mL,由山东华鲁制药有限公司提供,批准文号:国药准字H37022749,产品批号:H17100912。
血糖试纸(上海罗氏诊断产品有限公司,批号24697833);改良Masson三色染色液,糖原PAS染色试剂盒(北京索莱宝科技有限公司,批号分别为G1345、G1281);六胺银染色液(北京雷根生物技术有限公司,批号DG0090);Magic SYBR Mixture(江苏康为世纪生物科技股份有限公司,批号29120);mRNA反转录试剂盒(美国Thermo Fisher Scientific公司,批号32220);TRIzol(北京索莱宝科技有限公司,批号16021);抗GRP78抗体(美国Proteintech公司,批号00098232);抗PERK、eIF2α、ATF4抗体(美国Cell Signaling Technology公司,批号分别为10,8,5);辣根过氧化物酶(HRP)标记的抗兔II抗(北京柏奥易杰科技有限公司,批号80790602)。
血糖试纸型血糖测量仪(上海罗氏诊断产品有限公司)RM2165切片机,光学显微镜(德国Leica公司);台式冷冻离心机(美国Beckman公司);移液枪(0.1~1000 μL)(德国Eppendorf公司);Synergy Ⅱ型酶标仪(美国Bio-Tek公司);ME303E千分之一电子天平(上海梅特勒-托利多国际贸易有限公司);荧光定量PCR仪(CFX96)、Bio-Rad垂直电泳系统、Bio-Rad湿法电转印系统(伯乐生命医学产品有限公司)。
1.3 实验方法
1.3.1 动物分组及给药
实验组别分为对照组、模型组与肾气丸组3组。对照组选用7只12周龄ZDF(fa/+)大鼠;模型组与肾气丸组选用20只同周龄雄性ZDF(fa/fa)大鼠。肾气丸组每日灌服肾气丸水煎液(8.12 g/kg),对照组和模型组每日灌服等量生理盐水。
1.3.2 大鼠一般状态的观察
记录每日观察并记录各组大鼠体重、毛光泽度、饮食饮水量、活动情况及给药前后状态等。
1.3.3 大鼠空腹血糖检测
用尾尖取血法对12周龄和16周龄的各组大鼠进行空腹血糖检测。取血前大鼠禁食8 h,不禁水,随后用罗氏血糖仪及配套试纸检测。
1.3.4 大鼠尿微量白蛋白检测
于16周龄取材前收集各组大鼠24 h尿液,将尿液3500 r/min室温离心10 min,取上清用ELISA试剂盒检测各组大鼠尿微量白蛋白水平。
1.3.5 肾组织标本收集
各组大鼠饲养至16周龄,禁食8 h,不禁水,打开大鼠腹腔,暴露肾位置,取出完整肾并剥离被膜。一侧肾置于含有预冷生理盐水的培养皿上,将肾水平切开,切下肾组织浸入4%多聚甲醛中固定,随后进行肾组织石蜡切片制作。另一侧肾切分为小块组织保存于-80℃冰箱中,用于后续Real-time PCR与Western blot检测。
1.3.6 肾组织形态学染色
肾组织石蜡切片分别进行PAS、Masson和PAM-HE染色。切片脱蜡:石蜡切片浸泡于二甲苯两次,各15 min;后依次置于100%、95%、80%、70%乙醇中各浸泡10 min,蒸馏水漂洗2次,各5 min。
PAS染色:切片脱蜡入水,滴加氧化剂,4℃冰箱避光静置8 min,水洗,滴加Schiff Reagent染液,4℃冰箱避光染色10 min,水洗,滴加苏木素染液,室温避光静置1 min,酸性分化液分化3 s,水洗后70%、80%、90%、95%、100%梯度乙醇脱水,二甲苯透明,中性树胶封片。
Masson染色:切片脱蜡入水,滴染Bouin液10 min,轻缓冲洗至黄色消失,Mayer苏木素染色液滴染1 min,酸性乙酸分化液分化5 s,丽春红品红染色液滴染8 min,滴加磷钼酸溶液分色10 min,苯胺蓝染色液滴染3 min,冰醋酸染液分化至切片无蓝色脱出,70%、80%、90%、95%、100%梯度乙醇脱水,二甲苯透明,中性树胶封片。
PAM-HE染色:切片脱蜡入水,滴加氧化剂15 min,铁明矾染色,水洗,入六胺银工作液60℃水浴染色25~30 min,冲洗,氯化金调色1 min,套染HE:苏木素染色10 min,水洗,1%盐酸乙醇分色液5 s,水洗,1%氨水返蓝数秒,水洗,伊红染色2 min,水洗后70%、80%、90%、95%、100%梯度乙醇脱水,二甲苯透明,中性树胶封片。
1.3.7 Real-time PCR检测大鼠肾组织中GRP78、PERK、eIF2α、ATF4 mRNA的表达水平
取100 mg冻存肾组织匀浆,加1 mL TRIzol试剂提取总RNA,按照HiFiScript gDNA Removal RT MasterMix(CW 2020 M)进行逆转录操作。cDNA合成体系:RNA Template 10 μL,5×HiFiScript RTMaster Mix 4 μL,RNase-Free Water 6 μL。cDNA合成反应条件:37℃孵育15 min,85℃孵育5 s。逆转录反应结束测定cDNA浓度和浓度,PCR扩增GRP78、PERK、eIF2α、ATF4片段,以甘油醛-3-磷酸脱氢酶(GAPDH)作为内参,PCR反应条件:95℃ 30 s →95℃ 5 s,60℃ 30 s(40 cycles)→ 95℃ 15 s,60℃ 1 min,95℃ 15 s,50℃ 30 s;记录图表中的Ct值结果,计算得出各个目的基因的表达比率,记录数值。引物由上海生工生物工程股份有限公司代为合成,序列见表1。

表1 PCR引物序列Table 1 Primer sequence for Real-time PCR
1.3.8 Western blot检测大鼠肾组织中GRP78、PERK、eIF2α、ATF4蛋白的表达水平
提取肾组织总蛋白,BCA蛋白定量试剂盒对各组蛋白量进行测定,浓度测定后用Loading Buffer进行稀释,最终上样体积统一为10 μL。SDS-PAGE凝胶电泳,封闭1 h,按照说明书分别加入GRP78一抗(1∶5000),PERK一抗(1∶1000),eIF2α一抗(1∶2000),ATF4一抗(1∶2000),GAPDH一抗(1∶5000),4℃冰箱过夜,洗膜,加入HR标记山羊抗兔二抗(1∶10000),化学发光(ECL)法显像曝光。运用Image J软件分析各目的蛋白条带灰度值,计算目的蛋白灰度值与内参(GAPDH)灰度值的比值,比较各组肾组织中目的蛋白的相对表达量。
1.4 统计学方法
使用SPSS 20.0软件分析数据,数据以平均数±标准差(±s)表示,组间均数根据数据正态分布与否与方差齐性结果,选择单因素方差分析或非参数检验进行比较,P<0.05表示差异有统计学意义。
2 结果
2.1 大鼠一般状态
饲养过程中,见对照组大鼠体重增长正常,行动活跃,精神状态良好,毛发光亮;模型组大鼠体重增长缓慢,精神萎靡,毛色发黄缺少光泽,饮水量和尿量均显著增多而引起垫料潮湿并有较大异味。治疗组相较模型组情况有明显改善。见图1。

图1 各组大鼠一般状态Figure 1 General state of each group rats
2.2 空腹血糖和体重水平
12周龄、16周龄大鼠模型组与肾气丸组空腹血糖均较对照组明显升高,差异具有统计学意义(P<0.05);16周龄肾气丸组空腹血糖相较模型组明显降低,差异具有统计学意义(P<0.05)。16周龄大鼠模型组体重增长缓慢,肾气丸组较模型组体重增长恢复正常,差异具有统计学意义(P<0.05)。见表2、图2。
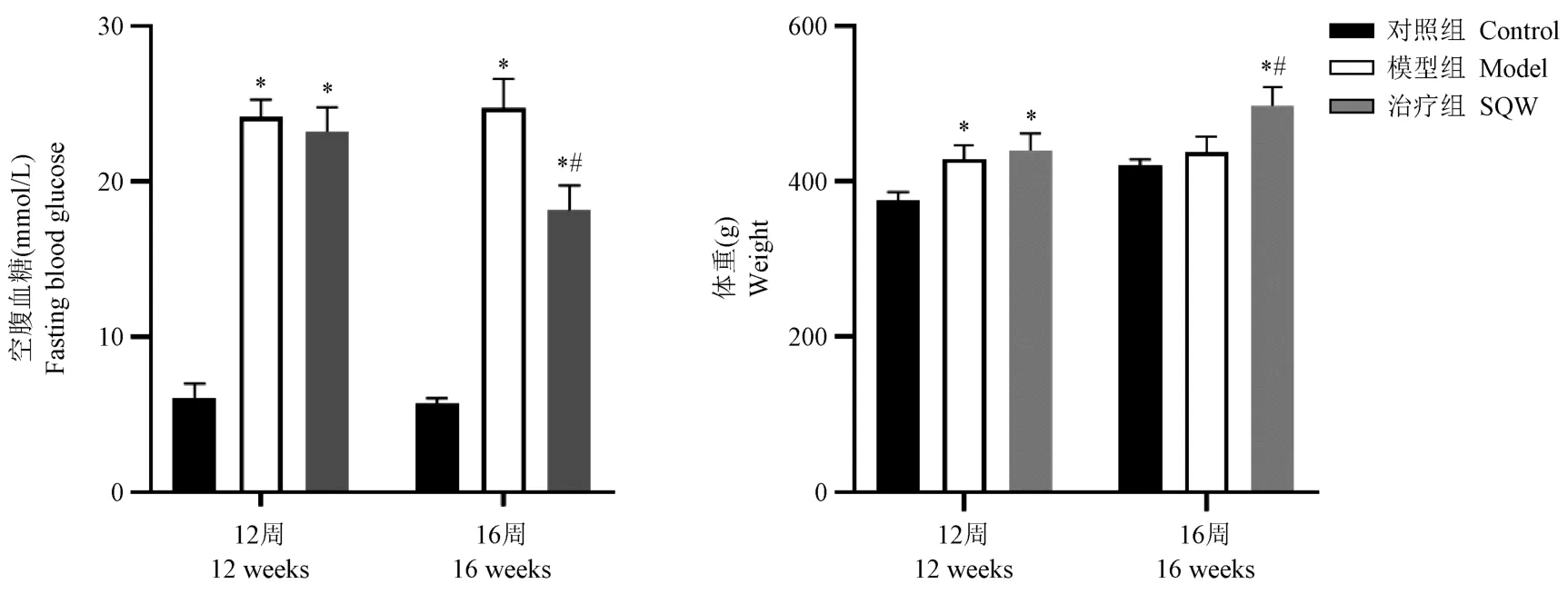
图2 各组大鼠空腹血糖和体重(±s)Note. Compared with control group, *P<0.05. Compared with model group, #P<0.05.Figure 2 Comparison of fasting blood glucose and weight of each group rats
表2 各组大鼠空腹血糖和体重(±s)Table 2 Fasting blood glucose and weight of each group rats

表2 各组大鼠空腹血糖和体重(±s)Table 2 Fasting blood glucose and weight of each group rats
注:与对照组相比, *P<0.05;与模型组相比, #P<0.05。Note. Compared with control group, *P<0.05. Compared with model group, #P<0.05.
?
2.3 各组大鼠24 h尿微量白蛋白检测结果
16周龄模型组和肾气丸组的24 h尿微量白蛋白值均较对照组升高,但肾气丸组较模型组明显下降,差异具有统计学意义(P<0.05)。见表3、图3。

图3 各组大鼠24 h尿微量白蛋白(±s,mg/mL)Note. Compared with control group, *P<0.05. Compared with model group, #P<0.05.Figure 3 Comparison of 24 h urinary microalbumin of each group rats
表3 各组大鼠24 h尿微量白蛋白(±s,mg/mL)Table 3 24 hour urinary microalbumin of each group rats

表3 各组大鼠24 h尿微量白蛋白(±s,mg/mL)Table 3 24 hour urinary microalbumin of each group rats
注:与对照组相比, *P<0.05;与模型组相比, #P <0.05.Note. Compared with control group, *P<0.05. Compared with model group, #P<0.05.
?
2.4 肾组织结构观察
PAS染色可见对照组肾小球结构正常,基膜结构薄而规则,系膜清晰。模型组肾小球毛细血管扩张,系膜区不规则增宽,肾小管上皮细胞胞浆疏松,有明显糖原沉积;肾气丸组上述情况均有所改善。Masson染色显示对照组肾小球和肾小管结构正常;模型组肾小球毛细血管扩张充血,系膜区有胶原沉积,肾间质纤维化;肾气丸组上述情况有所改善。PAM-HE染色可见对照组肾小球结构清晰完整,形状规则,基膜无增厚。模型组可见系膜区增宽,系膜基质增多,基膜不规则增厚,部分小球有节段硬化,肾小管上皮细胞萎缩;肾气丸组上述情况均有所改善。见图4。

图4 各组大鼠肾组织Note. Blue arrows, Glomerular pathological changes. Green arrows, Tubular and interstitial pathological changes.Figure 4 Kidney histopathology of each group rats
2.5 Real-time PCR检测大鼠肾组织GRP78、PERK、eIF2α、ATF4 mRNA表达水平
结果显示各目标基因的引物扩增状态良好,引物特异性高,如图5。
图5 各目标基因引物扩增曲线Figure 5 Primer amplification curve of each target gene
16周龄模型组GRP78 mRNA表达显著高于对照组,肾气丸组显著低于模型组(P<0.05)。模型组PERK mRNA表达显著高于对照组,肾气丸组显著低于较模型组明显降低(P<0.05)。模型组eIF2α mRNA表达显著高于对照组,肾气丸组较模型组明显降低(P<0.05)。模型组和肾气丸组ATF4 mRNA表达无明显差异(P>0.05),两组均显著高于对照组(P<0.05),这两组之间无明显差异(P>0.05)。见图6。
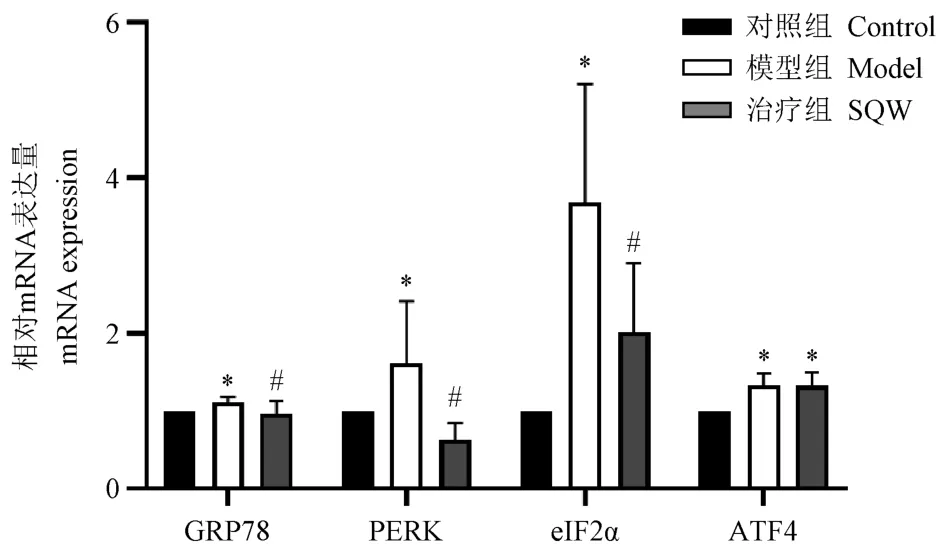
图6 各组大鼠肾组织ERS相关因子mRNA表达Note. Compared with control group, *P<0.05. Compared with model group, #P<0.05.Figure 6 mRNA expression of ERS related factors in each group rats’ kidney
2.6 Western blot检测大鼠肾组织GRP78、PERK、eIF2α和ATF4蛋白表达水平
结果显示,16周龄时模型组大鼠肾组织GRP78、PERK、eIF2α和ATF4的蛋白表达均显著高于对照组,肾气丸组较模型组则显著降低(P<0.05)。见图7。

图7 各组大鼠肾组织ERS相关因子蛋白表达Note. Compared with control group, *P<0.05. Compared with model group, #P<0.05.Figure 7 Protein expression of ERS related factors in each group rats’ kidney
3 讨论
糖尿病是严重危害人类健康的重要疾病之一,DKD是其最主要的慢性并发症之一。目前,在全球范围,引起终末期肾脏疾病(end-stage renal disease,ESRD)发生的原因中,DKD占30%~50%;而在我国,引起中老年ESRD发生的首要病因是DKD[7-9]。DKD不仅对我国广大居民的身体健康产生着严重危害,也为我国的经济发展带来了严重影响。由此可见,积极寻求DKD新的治疗方法和思路尤为重要。
张仲景《金匮要略·消渴小便不利淋病脉证并治篇》载:“男子消渴,小便反多,以饮一斗,小便一斗,肾气丸主之。” 肾气丸补肾之虚,温肾之气,对于治疗本虚标实之消渴具有很好的效果。肾气丸组方包括熟地黄、山药、山茱萸、牡丹皮、茯苓、泽泻、桂枝、炮附子,诸药合用,共奏温经助阳、滋肝补肾的功效。基于临床应用的观察,肾气丸治疗DKD的疗效显著,可以改善患者形寒肢冷、大便泄泻、腰酸耳鸣等症状,改善糖代谢,降低尿蛋白排泄率,延缓肾功能进行性损害[10]。
Zucker糖尿病肥胖大鼠(zucker diabetes fatty,ZDF)是一种新型的自发性2型糖尿病动物模型,广泛应用于2型糖尿病及其并发症的研究中[11]。我们在实验中观察到肾气丸可以明显改善糖尿病ZDF大鼠活动迟缓、毛色缺乏光泽、尿量增多等一般状态,并且降低大鼠空腹血糖水平。通过肾组织PAS、Masson和PAM-HE染色发现肾气丸能够减轻糖尿病ZDF大鼠部分肾小球毛细血管扩张充血状态,改善其肾小球基膜不规则增厚、系膜细胞增生等肾小球病变,减少肾间质纤维组织增生和肾小管萎缩。
DKD作为糖尿病进展相关的缓慢进行性疾病,在肾功能改变上,多从微量白蛋白尿开始,随后出现大量白蛋白尿和肾功能明显下降,而其在肾活检所观察到的形态变化对于确诊DKD有重要价值[9]。我们对16周龄ZDF大鼠24 h尿微量白蛋白检测发现,模型组尿微量白蛋白水平显著高于对照组,提示ZDF大鼠出现明显肾损伤,而灌服肾气丸四周后,尿微量白蛋白水平明显降低,结合我们观察到肾气丸对于大鼠体重、空腹血糖水平以及病理损伤都有所改善,可见肾气丸对于减轻糖尿病ZDF大鼠肾损伤具有一定的作用。
内质网(endoplasmic reticulum,ER)在蛋白质、脂质和糖代谢以及细胞钙稳态和信号转导中起着关键作用,其功能紊乱和ERS发生与许多代谢性疾病有关,包括糖尿病[12]。当发生ERS时,错误折叠或未折叠蛋白积聚,诱发分子伴侣蛋白糖调节蛋白(glucose-regulated protein,GRP)78等表达量增高,调节蛋白合成来缓解应激状态。所以它被用作检测ERS发生的标志蛋白,GRP78表达增加即代表ERS发生[13]。研究表明2型糖尿病小鼠出现GRP78、ATF6等内质网应激标志蛋白表达的增加,提示ERS可能参与糖尿病发生发展,且增强ERS可明显加重肾组织的病理损害,加速病程进展,而中药能够通过缓解ERS发挥治疗作用[14-16]。本课题组先前的实验也证明2型糖尿病小鼠表现ERS增强,GRP78、PERK和eIF2α等相关因子表达的增加,中药或其主要成分可通过下调相关因子表达,缓解ERS来发挥作用[17-18],所以我们进一步检测了肾气丸是否可能通过影响ERS的PERK-eIF2α-ATF4通路对糖尿病ZDF大鼠病情进展过程中发生的肾损伤起到干预作用。
此次实验结果显示模型组ZDF大鼠肾组织GRP78基因及蛋白表达均高于对照组,提示模型组大鼠发生ERS,而肾气丸组大鼠肾组织ERS则得到缓解。有实验表明2型糖尿病导致ERS过强时会引起PERK、ATF4表达增强,中药可以下调相关蛋白表达量,抑制PERK通路[19],这与我们的结果相符。我们实验检测到模型大鼠肾组织PERK、eIF2α、ATF4的基因和蛋白表达均较对照组显著增加,而肾气丸组大鼠肾组织PERK、eIF2α、ATF4的蛋白表达水平均出现明显下降,这表明肾气丸可能通过抑制PERK-eIF2α-ATF4信号通路缓解糖尿病ZDF大鼠病情进展过程中所发生的ERS引起的损伤。
综上所述,我们的实验表明,肾气丸可减轻在糖尿病ZDF大鼠出现的肾组织病理损伤,降低24 h尿微量白蛋白水平,在一定程度上保护了肾功能,其机制可能是通过影响ERS所介导的PERK通路。但是,在实验中,我们仅观察了肾气丸影响下的肾组织不同光镜染色方法下的形态变化,同时也看到PERK通路下游因子ATF4的基因水平变化不明显。因此,后续实验有必要进一步明确肾气丸对糖尿病动物肾组织中不同种类细胞及细胞超微结构的影响,明确其对PERK通路相关因子转录后水平调控的影响,为肾气丸在DKD治疗过程中的早期应用提供实验基础。
