基于nNOS/CAPON相互作用探讨参枝苓口服液对拟散发性AD小鼠海马突触的影响
2022-10-03田梅静高晨艳郑明翠和雁南王蓬文
田梅静高晨艳郑明翠和雁南王蓬文
(北京中医药大学东直门医院中医内科学教育部和北京市重点实验室,北京 100700)
年龄相关的阿尔茨海默病(Alzheimer’s disease,AD)患者95%为散发性AD(sporadic AD,SAD),目前尚无切实有效的干预药物[1],基于AD特征性病理改变的核心发病假说仍然是β-淀粉样蛋白(Amyloid beta,Aβ)级联假说,但与Aβ生成和降解相关的药物开发以及针对Aβ单克隆抗体的临床试验结果并不乐观[2]。因此,有必要对Aβ毒性信号传递的下游进行探索。Aβ过度激活突触后膜上的N-甲基-D-天冬氨酸受体(NMDARs),导致Ca2+内流增多,引起神经元过度兴奋损伤突触。NMDARs被激活时,神经元型一氧化氮合酶(neuronal nitric oxide synthase,nNOS)与神经元型一氧化氮合酶羧基末端PDZ配体(carboxy-terminal PDZ ligand of neuronal nitric oxide synthase,CAPON)形成复合物传递NO信号,影响细胞外信号调控激酶(extracellular signal-regulated kinases,ERK)/环磷腺苷反应元件结合蛋白(cAMP-response element binding protein,CREB)信号途径,损伤突触,进而影响小鼠的学习记忆能力[3]。因此阻断nNOS与CAPON的相互作用可能为AD的治疗策略提供新的途径。
参枝苓口服液是治疗AD的中药复方新药(批准文号:国药准字Z20120010),临床可有效改善患者的轻度认知损害与精神行为症状,在控制AD早期症状上表现出明显的优势[4-5]。课题组前期发现参枝苓口服液可以改善AD小鼠髓鞘损伤,增加突触前膜α7-nAchR和突触后膜mGluR5两种功能蛋白的表达,发挥早期神经保护作用[6-7],进一步研究发现,参枝苓口服液可以减少Aβ沉积,改善AD模型小鼠的学习记忆能力,但是否是通过影响Aβ毒性信号下游nNOS与CAPON的相互作用尚不清楚。因此本实验采用隔日双侧侧脑室注射链脲佐菌素(streptozotocin,STZ)的方法制备拟SAD模型小鼠,探究参枝苓口服液对拟SAD模型小鼠海马nNOS与CAPON相互作用及其下游ERK/CREB通路的影响,为参枝苓口服液的临床应用提供更多的实验数据支持。
1 材料和方法
1.1 实验动物
雄性3月龄SPF级C57BL/6J小鼠72只,体重22~25 g,由北京华阜康实验动物技术有限公司提供[SCXK(京)2019-0008],饲养于北京中医药大学东直门医院屏障环境动物室[SYXK(京)2020-0013],温度为(22±2)℃,湿度为(45±5)%,自由饮水与摄食。本实验已通过北京中医药大学东直门医院实验动物伦理委员会批准(伦理号:19-46),实验遵循3R原则。
1.2 主要试剂与仪器
参枝苓口服液(山东沃华药业,国药准字Z20120010);盐酸多奈哌齐(卫材(中国)药业有限公司,批号140635)。
STZ(美国Sigma公司,S0130);鼠单抗β-actin、兔单抗nNOS、CAPON(英国Abcam公司,ab8826,ab76067、ab190686);兔单抗ERK、p-ERK、CREB、p-CREB(美国CST公司,#4370、#4695、#9197、#9198);Protein A/G PLUS-Agarose(美国Santa公司,sc-2003);Rabbit IgG(H+L)(北京博奥森生物技术有限公司,bs-0295P);5×蛋白上样缓冲液、脱脂奶粉、SDS-PAGE凝胶配制试剂盒、5×Tris-甘氨酸电泳缓冲液、10×电转液、1×PBS缓冲液(pH 7.2~7.4)、20×TBST、SDS(北京索莱宝科技有限公司);BCA蛋白定量试剂盒(北京博奥森生物技术有限公司,C05-02001);超敏ECL化学发光试剂盒(新赛美生物科技有限公司,P10100);兔免疫组化试剂盒(福州迈新生物技术开发有限公司,KIT-9707);DAB显色试剂盒(北京中杉金桥生物技术有限公司,ZLI-9018)。
Morris水迷宫实验仪器(上海移数信息科技有限公司);Mini-PROTEAN3电泳仪(美国BIORAD公司);JEM-2100F型透射电镜(日本日立电子公司);4℃低温高速离心机(美国 Thermo公司);CB-128C酶标仪(奥地利);EG1150H石蜡包埋机、RM2235石蜡切片机(德国Leica);Tanon-4600全自动化学发光图像分析系统。
1.3 实验方法
1.3.1 动物分组、模型制备及给药
72只C57BL/6J雄性小鼠随机分为对照组12只、造模组60只。造模组第1天及第3天双侧侧脑室注射用人工脑脊液配制的,浓度为3 mg/kg的STZ,制作拟SAD小鼠模型,对照组同等条件注射人工脑脊液。在前囟后0.8 mm、矢状缝旁开1.5 mm处用牙科钻打开颅骨,暴露出硬脑膜,微量注射器垂直进针2 mm,缓缓注入5 μL液体,注射时间5 min,注射完毕后用无菌线缝合切口[8-9]。将造模组的小鼠随机分为模型组、多奈哌齐组和参枝苓高、中、低剂量组。
以成人临床剂量的10倍为中剂量组,参枝苓高、中、低剂量组分别按照50 g/(kg·d)、25 g/(kg·d)、12.5 g/(kg·d)的剂量灌胃,多奈哌齐组按0.92 mg/(kg·d)的剂量灌胃给药。对照组和模型组均给予0.5% CMC灌胃给药,给药体积为0.1 mL/10 g,每日晨8时给药,连续给药3个月。
1.3.2 Morris水迷宫检测各组小鼠的空间学习记忆能力
圆形水池被分为四个象限,平台位于第3象限。实验共进行6 d,前2 d为训练时间,每天训练3次,每次120 s。从1、2、4象限的边缘中央将动物面向池壁放入水中,记录小鼠找到站台的游泳时间。如果动物在120 s内未找到平台,则将其引至平台停留10 s,逃避潜伏期记为120 s。第3~5天重复如上操作进行测试,但不再对未找到站台的小鼠进行引导。第6天撤除平台,选择第1象限将动物放人水中,动物在水中游泳120 s,测量120 s内小鼠穿越目标平台次数。
1.3.3 透射电镜观察各组小鼠海马CA1区突触数量
行为学实验结束后,每组3只小鼠三溴乙醇(350 mg/kg)腹腔麻醉后进行灌注固定,完成后用剪刀断头,取出小鼠完整脑组织后剥离出海马,用手术刀片切取海马CA1区,置于装有2.5%戊二醛溶液的EP管中,4℃静置2 h以充分固定。之后用0.1 mol/L PBS缓冲液每隔15 min冲洗1次,重复3次后将标本放在装有0.1 mol/L PBS缓冲液的EP管中,立即将标本送至北京陆军总医院八一脑科医院电镜室进一步制作超薄切片。在×1500倍数的视野下随机取3个神经毡计算突触数量的平均值。
1.3.4 免疫共沉淀检测nNOS与CAPON的相互作用
每组3只小鼠处死后取新鲜海马磨碎,PBS洗涤,4℃ 12000 r/min离心3 min,弃上清,重复2次。样本中加入1 mL IP裂解液冰上裂解30 min,4℃12000 r/min离心10 min小心吸取上清于新1.5 mL离心管中,即为提取好的蛋白,于提取好的蛋白中取100 μL于新的1.5 mL离心管中加入适量蛋白上样缓冲液(5×)煮沸变性10 min作为Input样本,-20℃保存待用;另取500 μL蛋白加入10 μL一抗(兔单抗nNOS);再另取200 μL蛋白加入Rabbit IgG 4℃旋转预敷育2 h,预敷育结束后样本中加入40 μL Protein A/G PLUS-Agarose,4℃旋转敷育过夜。第2天4℃ 3000 r/min离心5 min,小心弃掉上清,加入1 mL IP裂解液清洗磁珠,4℃ 3000 r/min离心5 min,重复3次,尽量吸尽上清,沉淀中加入100 μL 蛋白上样缓冲液(1×)煮沸变性10 min作为IP样本,-20℃保存待用。
1.3.5 免疫组化检测ERK与CREB的阳性表达细胞数
每组3只小鼠麻醉后用4%的多聚甲醛进行灌注固定取材。将固定的脑组织进行冠状面取材、脱水、石蜡包埋。随后对海马组织进行连续地冠状切片,切片厚度约为4 μm。然后进行烤片(56℃ 60 min)、二甲苯脱蜡、复水、枸橼酸缓冲液修复抗原、阻断内源性过氧化物酶、滴加正常山羊血清封闭、滴加1∶500的一抗4℃过夜、滴加二抗、DAB显色、脱水、透明、中性树胶封片。显微镜下(×20)观察,海马CA1区选取3个视野,用Motic 6.0 软件系统拍摄图片,并用ImagePro Plus软件计算目的蛋白阳性表达细胞数的平均值。
1.3.6 Western blot检 测ERK、p-ERK、CREB、p-CREB的表达
每组3只小鼠处死后立即置于冰板上迅速剥离出小鼠的海马,放入冻存管中置于液氮罐中储存备用。检测时,将海马从液氮罐中取出转移至EP管中,加入高效RIPA组织裂解液,使用超声匀浆仪将组织匀浆之后进行离心,取上清液。按照BCA蛋白定量试剂盒说明,配制工作液和蛋白标准品,对海马组织进行蛋白浓度测定。按照制胶上样后电泳(60 V 1 h,90 V 40 min,120 V 20 min),使用PVDF膜进行转膜(200 mA 90 min),5%脱脂牛奶封闭、加入1∶1000的一抗过夜、加二抗、加发光液、曝光的顺序进行操作。用Image J软件对蛋白条带进行灰度值分析,各组目标蛋白分别与内参β-actin(1∶10000)进行比较,计算其百分数,得出结果。
1.4 统计学方法
使用统计软件SPSS 20.0进行统计分析,实验结果用平均数±标准差(±s)表示,若数据满足正态分布且方差齐,则采用单因素方差分析(ANOVA)进行多组间数据的统计分析,组间两两比较采用LSD检验;若不符合正态分布或方差不齐则采用非参数检验。以P<0.05为有统计学差异,P<0.01为有显著统计学差异。
2 结果
2.1 参枝苓口服液对各组小鼠空间学习记忆能力的影响
2.1.1 各组小鼠的逃避潜伏期
Morris水迷宫显示,随着训练天数增加,从第1~5天各组小鼠的逃避潜伏期均缩短。与对照组相比,从第1~5天,模型组小鼠的逃避潜伏期显著增加(P<0.01)。与模型组相比,第4天和第5天,参枝苓高剂量组小鼠的逃避潜伏期明显缩短(P<0.05),多奈哌齐组和参枝苓中、低剂量组小鼠的逃避潜伏期显著缩短(P<0.01)。见表1。
表1 各组小鼠的逃避潜伏期(±s,n=12)Table 1 Escape latency of mice in each group
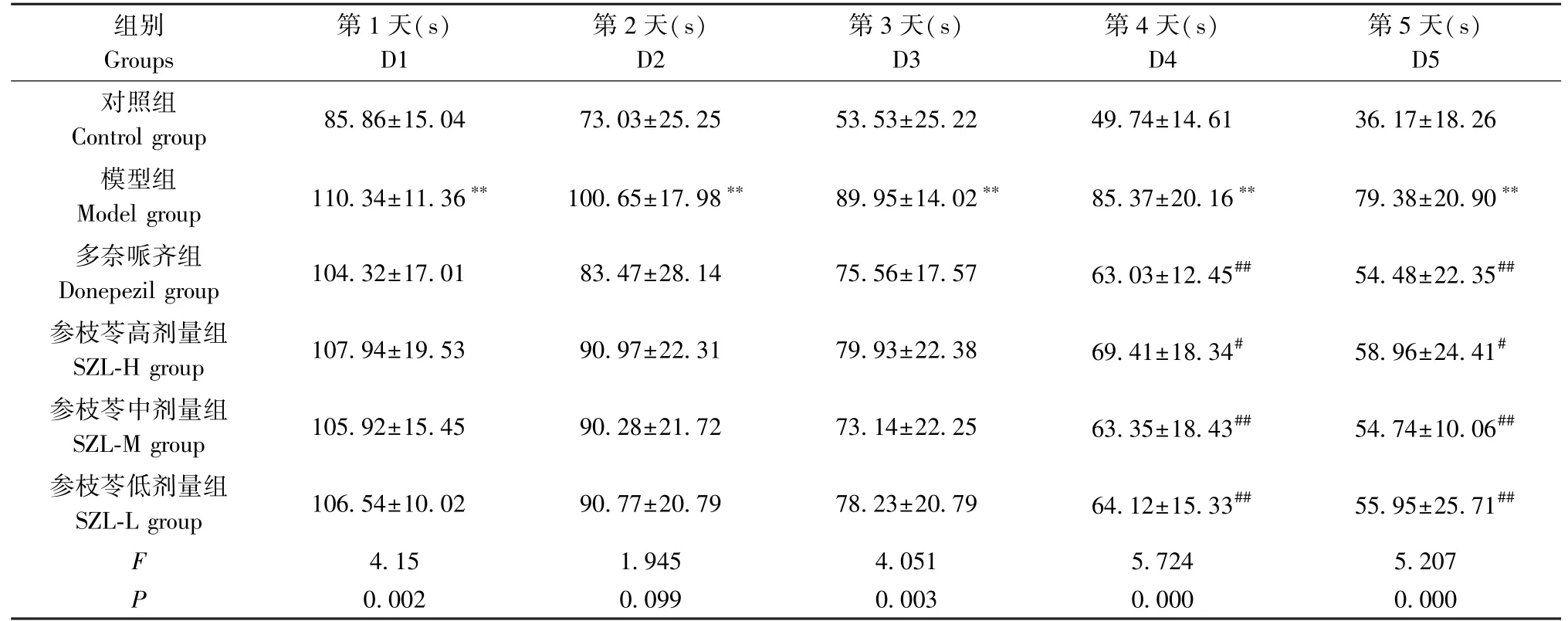
表1 各组小鼠的逃避潜伏期(±s,n=12)Table 1 Escape latency of mice in each group
注:与对照组比较, **P<0.01;与模型组比较, #P<0.05, ##P<0.01。Note. Compared with the control group, **P<0.01. Compared with the model group, #P<0.05, ##P<0.01.
?
2.1.2 各组小鼠撤台后穿越平台的次数
第6天撤台后,与对照组相比,模型组小鼠穿越平台的次数显著减少(P<0.01)。与模型组相比,多奈哌齐组和参枝苓中、低剂量组小鼠穿越平台的次数显著增加(P<0.01),参枝苓高剂量组小鼠穿越平台的次数明显增加(P<0.05)。见表2。
表2 撤台后各组小鼠穿越平台次数 (±s,n=12)Table 2 Number of crossing platform in each group

表2 撤台后各组小鼠穿越平台次数 (±s,n=12)Table 2 Number of crossing platform in each group
注:与对照组比较, **P<0.01;与模型组比较, #P<0.05, ##P<0.01。Note. Compared with the control group, **P<0.01. Compared with the model group, #P<0.05, ##P<0.01.
?
2.2 参枝苓口服液对各组小鼠海马CA1区突触数量的影响
在×1500视野下,与对照组相比,模型组小鼠海马CA1区神经毡突触数量显著减少(P<0.01);与模型组相比,多奈哌齐组和参枝苓高、中、低剂量组小鼠海马CA1区突触数量均显著增加(P<0.01)。见图1、表3。

图1 各组小鼠海马CA1区神经毡的超微结构Note. A, Control group. B, Model group. C, Donepezil group. D, SZL-H group. E, SZL-M group. F, SZL-L group. →, Synapses (the caterpillar-like black postsynaptic membrane density in the nerve felt is the site of the synapse).Figure 1 Ultrastructure of nerve felt in the hippocampal CA1 region of mice in each group
表3 各组小鼠海马CA1区突触数量(±s,n=3)Table 3 Number of synapses in the hippocampal CA1 region of mice in each group表4 各组小鼠海马nNOS与CAPON的相互作用(±s,n=3)Table4 Interaction between nNOS and CAPON in hippocampus of mice in each group
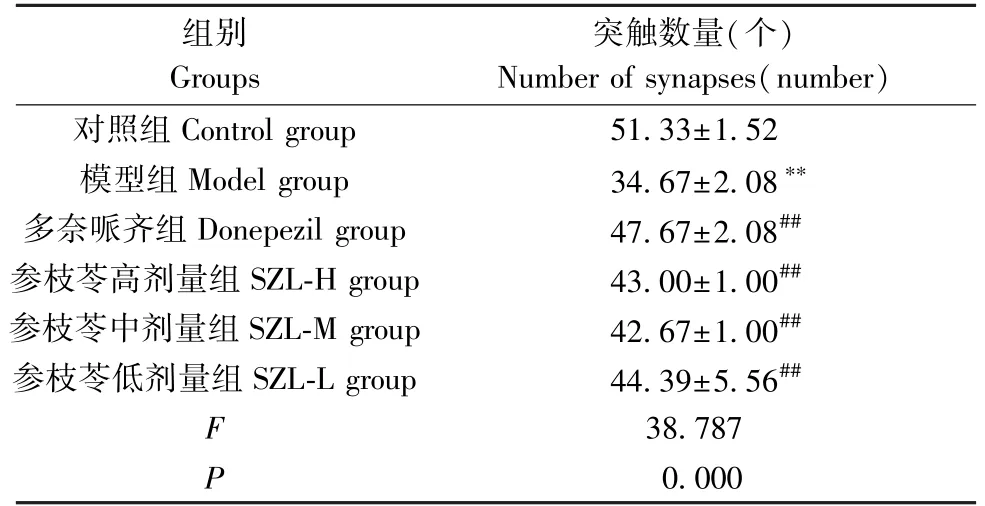
表3 各组小鼠海马CA1区突触数量(±s,n=3)Table 3 Number of synapses in the hippocampal CA1 region of mice in each group表4 各组小鼠海马nNOS与CAPON的相互作用(±s,n=3)Table4 Interaction between nNOS and CAPON in hippocampus of mice in each group
注:与对照组比较, **P<0.01;与模型组比较, ##P<0.01。Note. Compared with the control group, **P<0.01. Compared with the model group, ##P<0.01.
?
2.3 参枝苓口服液对各组小鼠海马nNOS与CAPON相互作用的影响
免疫共沉淀结果显示,与对照组相比,模型组小鼠nNOS与CAPON的相互作用显著增加(P<0.01);与模型组相比,各干预组小鼠nNOS与CAPON的相互作用均明显下降(P<0.05或P<0.01)。见图2、表4。

图2 各组小鼠海马nNOS与CAPON的相互作用Note. A, Control group. B, Model group. C, Donepezil group. D,SZL-H group. E, SZL-M group. F, SZL-L group.Figure 2 Co-immunoprecipitation of nNOS and CAPON in hippocampus of mice in each group
2.4 参枝苓口服液对各组小鼠海马CA1区ERK、CREB阳性表达细胞数的影响
免疫组化染色结果显示,ERK、CREB蛋白免疫反应阳性表达产物多分布在胞质,为棕黄色颗粒。各组小鼠海马CA1区ERK的阳性表达细胞数没有差异。见图3a、表5。而与对照组相比,模型组小鼠CREB阳性表达细胞数显著减少(P<0.01);与模型组相比,参枝苓高、中剂量组小鼠CREB阳性表达细胞数均显著增多(P<0.01),多奈哌齐组和参枝苓低剂量组小鼠CREB阳性表达细胞数明显增多(P<0.05)。见图3b、表5。
表5 各组小鼠海马CA1区ERK和CREB阳性表达细胞数(±s,n=3)Table 5 Positive cells of ERK and CREB in the hippocampal CA1 region of mice in each group

表5 各组小鼠海马CA1区ERK和CREB阳性表达细胞数(±s,n=3)Table 5 Positive cells of ERK and CREB in the hippocampal CA1 region of mice in each group
注:与对照组比较, **P<0.01;与模型组比较, #P<0.05, ##P<0.01。Note. Compared with the control group, **P<0.01. Compared with the model group, #P<0.05, ##P<0.01.
?
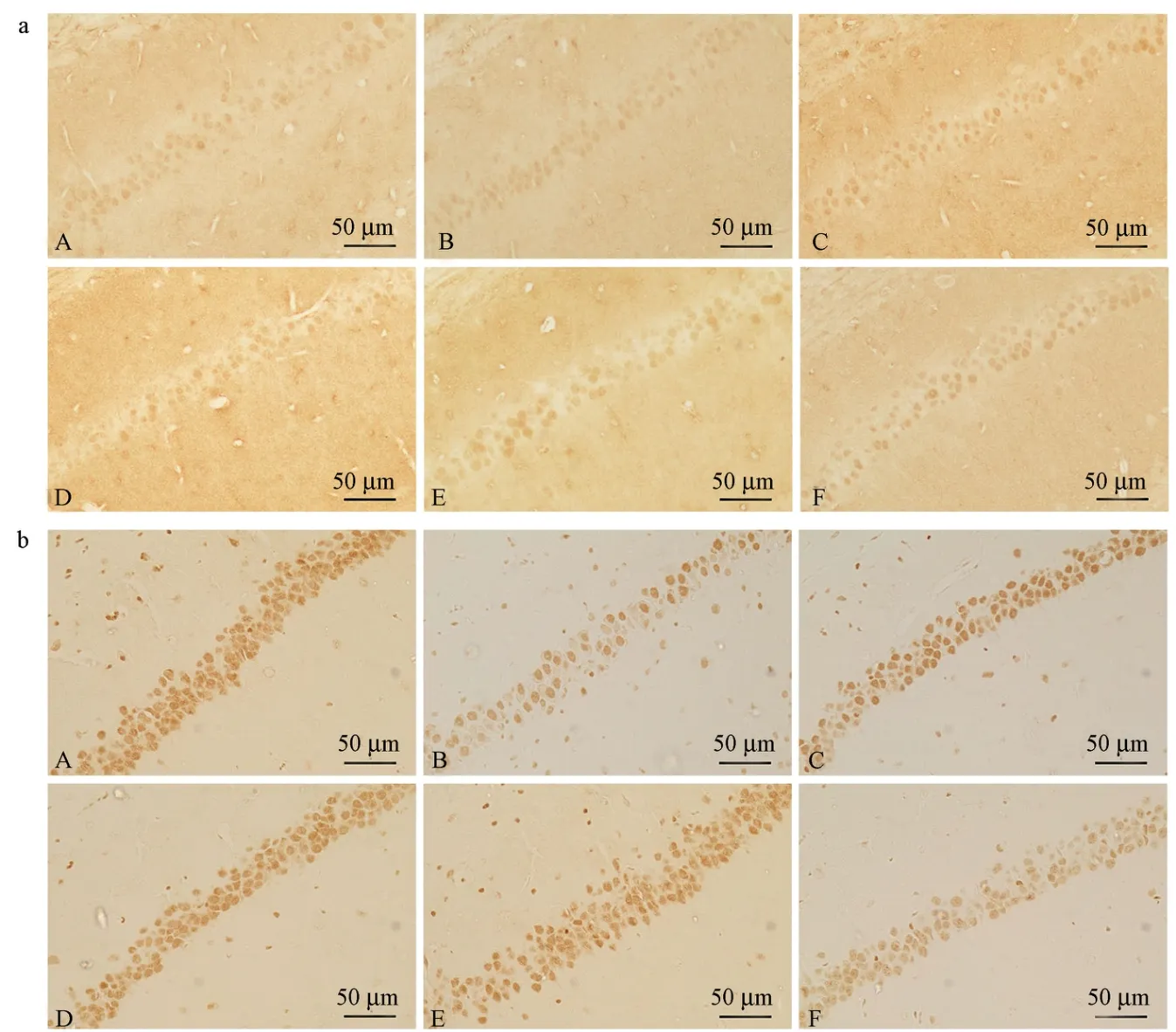
图3 各组小鼠海马CA1区ERK和CREB免疫组化染色Note. a, Distribution and positive expression of ERK in the hippocampal CA1 region of mice in each group. b, Distribution and positive expression of CREB in the hippocampal CA1 region of mice in each group. A, Control group. B, Model group. C, Donepezil group. D, SZL-H group. E, SZL-M group. F, SZL-L group.Figure 3 Immunohistochemical staining of ERK and CREB in hippocampal CA1 region of mice in each group
2.5 参枝苓口服液对各组小鼠海马ERK、p-ERK蛋白表达的影响
Western blot结果显示,各组小鼠海马ERK的表达趋势与免疫组化染色一致,各组小鼠无差异。但与对照组相比,模型组小鼠p-ERK表达显著降低(P<0.01),p-ERK/ERK水平显著降低(P<0.01);与模型组相比,多奈哌齐组与参枝苓各干预组小鼠p-ERK表达均显著增加(P<0.01),p-ERK/ERK水平也显著增加(P<0.01)。见图4、表6。
表6 各组小鼠海马ERK和p-ERK蛋白表达(±s,n=3)Table 6 Protein expression of ERK and p-ERK in hippocampus of mice in each group

表6 各组小鼠海马ERK和p-ERK蛋白表达(±s,n=3)Table 6 Protein expression of ERK and p-ERK in hippocampus of mice in each group
注:与对照组比较, **P<0.01;与模型组比较, ##P<0.01。Note. Compared with the control group, **P<0.01. Compared with the model group, ##P<0.01.
?
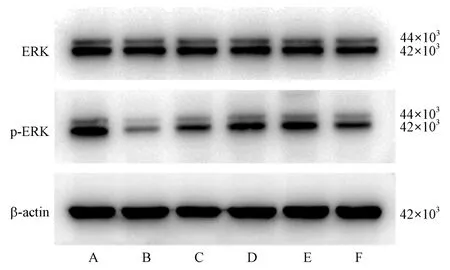
图4 各组小鼠海马ERK、p-ERK蛋白表达Note. A, Control group. B, Model group. C, Donepezil group. D,SZL-H group. E, SZL-M group. F, SZL-L group.Figure 4 Band of ERK and p-ERK protein expression in hippocampus of mice in each group
2.6 参枝苓口服液对各组小鼠海马CREB、p-CREB蛋白表达的影响
Western blot结果显示,各组小鼠海马CREB的表达趋势与免疫组化染色大体一致,与对照组相比,模型组小鼠CREB的表达显著下降(P<0.01);与模型组相比,参枝苓高、低剂量组小鼠CREB的表达明显增加(P<0.05),多奈哌齐组和参枝苓中剂量组小鼠CREB的表达显著增加(P<0.01)。并且与对照组相比,模型组小鼠p-CREB的表达显著降低(P<0.01),p-CREB/CREB水 平 显 著 降 低(P<0.01);与模型组相比,多奈哌齐组与参枝苓各干预组小鼠p-CREB的表达均显著增加(P<0.01),p-CREB/CREB水平也均显著增加(P<0.01)。见图5、表7。
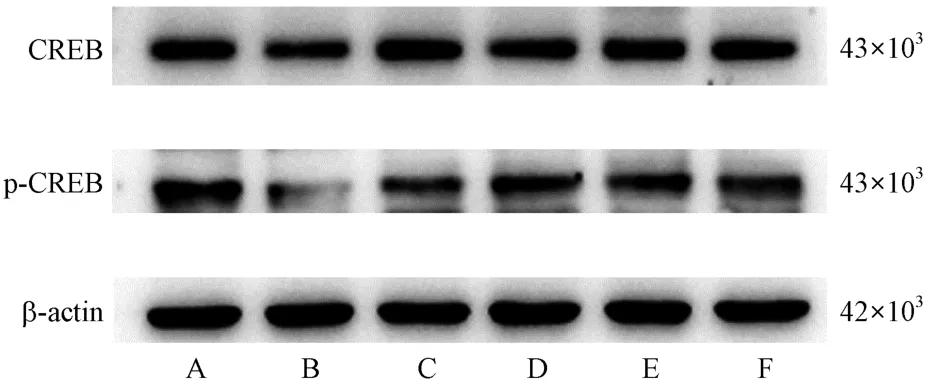
图5 各组小鼠海马CREB、p-CREB蛋白表达Note. A, Control group. B, Model group. C, Donepezil group. D,SZL-H group. E, SZL-M group. F, SZL-L group.Figure 5 Band of CREB and p-CREB protein expression in hippocampus of mice in each group
表7 各组小鼠海马CREB和p-CREB蛋白表达(±s,n=3)Table 7 Protein expression of CREB and p-CREB in hippocampus of mice in each group

表7 各组小鼠海马CREB和p-CREB蛋白表达(±s,n=3)Table 7 Protein expression of CREB and p-CREB in hippocampus of mice in each group
注:与对照组比较, **P<0.01;与模型组比较, #P<0.05, ##P<0.01。Note. Compared with the control group, **P<0.01. Compared with the model group, #P<0.05, ##P<0.01.
?

注:与对照组比较, **P<0.01;与模型组比较, #P<0.05, ##P<0.01。Note. Compared with the control group, **P<0.01. Compared with the model group, #P<0.05, ##P<0.01.
3 讨论
STZ是一种氨基葡萄糖亚硝基脲化合物,向啮齿类动物侧脑室注射亚糖尿病剂量的STZ会损伤大脑中的胰岛素受体,形成脑内胰岛素抵抗状态,引起糖原合成酶激酶的改变,造成脑葡萄糖代谢低下、氧化应激、胆碱能缺陷、神经炎症等与人类SAD相似的病理生理改变,但动物外周血糖水平在此过程中并无改变,故在国内外被广泛应用于SAD的实验研究[10-12]。课题组前期实验也证明,双侧侧脑室注射STZ 3个月后,小鼠出现学习记忆能力下降以及Aβ沉积、tau蛋白的磷酸化增加、突触传递障碍与功能紊乱等AD病理改变[13-14],因此本次实验选用STZ诱导的SAD 动物模型。
AD是一种中枢神经系统退行性疾病,在中医中归属于“痴呆”范畴,AD病位在脑,与心、肝、脾、肾等脏腑有关,其中与心的关系最为密切。《素问·灵兰秘典论》云:“心者,君主之官,神明出焉”,心主宰着人的意识与思维活动[15]。若心气不足,无力推动血液在脉中运行,营养物质不能随血液到达脑部,大脑失于濡养,则会出现一系列精神活动的改变。若心血不足,心神失去活动的物质基础,也会导致心主神志的功能下降。参枝苓口服液以“心主神明”立方,君药党参补益元气,增智安神;臣药桂枝、干姜温通血脉;佐药远志、茯苓、菖蒲开窍化痰,龙骨、牡蛎固涩宁神,使药白芍、甘草养血和营,全方共奏补益心气,益智化痰之功。本研究中用参枝苓口服液治疗STZ诱导的拟SAD小鼠3个月后,参枝苓各干预组小鼠的逃避潜伏期均明显减少,撤台后穿越平台的次数明显增加,说明参枝苓口服液可以提高拟SAD模型小鼠的学习记忆能力。
CAPON是nNOS的一个接头蛋白,间接结合到NMDARs,是许多神经系统疾病的危险因素,如精神分裂症、自闭症、双相情感障碍、创伤后应激障碍和抑郁症[16-17]。CAPON还可以调节树突形态、树突模式和树突棘的发育,原位杂交技术发现CAPON与nNOS在空间上有共定位现象[18]。当NMDARs被Aβ激活时,CAPON与nNOS形成一个复合物传递NO信号给Dexras1,S-亚硝基化激活的Dexras1会抑制其下游ERK的磷酸化,进而影响CREB的活化[19]。研究发现,在APP/PS1双转基因小鼠海马中nNOS与CAPON的相互作用增加,用Aβ1-42孵育原代神经元24 h后,nNOS与CAPON的相互作用也显著增加[3]。本研究免疫共沉淀结果表明,与对照组比,模型组小鼠nNOS与CAPON的相互作用显著增加,经过3个月的药物干预,参枝苓不同剂量组nNOS与CAPON的相互作用均有不同程度的减少。
丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)级联反应是将胞外信号从细胞表面传导到细胞内部的重要信号系统,在细胞增殖、分化、存活和凋亡过程中发挥着重要作用[20]。ERK是MAPK信号的重要组成部分,ERK1和ERK2是ERK的两种亚型,p-ERK 激活下游CREB的表达,转录因子CREB在认知中起着至关重要的作用,是学习和记忆的关键分子,CREB介导的基因表达是长期记忆和突触可塑性所必需的[21]。研究报道,CREB介导的基因表达在AD患者的大脑中明显受损[22]。本研究发现,与对照组相比,模型组小鼠ERK的表达无明显变化,但p-ERK、CREB、p-CREB的表达显著降低,p-ERK/ERK、p-CREB/CREB水平显著降低,海马CA1区突触数量显著减少,经过3个月的治疗,参枝苓不同剂量组p-ERK、CREB、p-CREB的表达均明显增加,p-ERK/ERK、p-CREB/CREB水平显著增加,海马CA1区突触数量均显著增加。
综上所述,参枝苓口服液改善拟SAD小鼠的学习记忆能力可能与减少nNOS与CAPON的相互作用,增加p-ERK、CREB、p-CREB的表达以及p-ERK/ERK、p-CREB/CREB水平,进而增加突触数量有关,但由于中药复方多成分多靶点的治疗作用,因此参枝苓口服液治疗AD的更多潜在机制还需进一步探讨。
