基于SDF-1/CXCR4轴观察济生肾气汤对肝硬化大鼠BMSCs归巢的影响
2022-10-03周晓玲王月明吴腾陈峭余静芳李灿李泽鹏陆世银张悦覃凤传沈新辉
周晓玲王月明吴 腾陈 峭余静芳李 灿李泽鹏陆世银张 悦覃凤传沈新辉
(1.柳州市中医医院(柳州市壮医医院),广西 柳州 545001;2.广西中医药大学,南宁 530200)
肝硬化是由各种损伤因素导致的以肝细胞损伤坏死、胶原沉积、窦周纤维化及纤维间隔增宽等为主要病理性改变的疾病[1]。对于失代偿期的肝硬化,目前最有效的治疗手段为肝移植,但临床上受到多种因素的限制[2]。而间充质干细胞移植具有可及性强、安全性高、单次治疗费用较低等优势,有望成为缺乏肝移植条件时的替代治疗之一[3]。但干细胞移植后的迁徙方向、能否存活等问题亟待解决[4]。目前的研究中多通过促红细胞生成素预处理干细胞、联合使用粒细胞集落刺激因子等方式,提高干细胞归巢效率,从而增强疗效,但这些方式的安全性与有效性未得到临床验证。
SDF-1/CXCR4轴在干细胞动员、归巢中发挥着关键作用[5],既往课题组应用中药联合骨骼间充质干细胞(BMSCs)移植治疗肝硬化,发现经典补肾方济生肾气汤可增加BMSCs向肝归巢,促进干细胞分化为功能肝细胞,加速肝再生,恢复肝功能[6],但济生肾气汤对干细胞归巢的影响及具体作用机制尚不明确。因此,本研究旨在探究济生肾气汤对移植BMSCs迁徙、定植及增殖的影响,并初步研究其与SDF-1/CXCR4轴的关联,为提高干细胞移植对肝硬化的治疗效率提供参考。
1 材料和方法
1.1 实验动物
SPF级SD雄性大鼠,体重220~250 g,50只,由湖南斯莱克景达实验动物有限公司提供[SCXK(湘)2019-0004],饲养温度(25±2)℃,相对湿度50%~60%,予12 h光照,自由饮食;无菌手术在广西中医药大学动物实验中心屏障动物实验设施进行[SYXK(桂)2019-0001]。动物实验通过广西中医药大学实验动物福利伦理委员会审核(DW20190105-034),实验涉及动物饲养及实验操作均遵守实验动物管理与保护3R原则。
1.2 主要试剂与仪器
济生肾气汤颗粒(熟地黄40 g、山茱萸20 g、山药20 g、泽泻15 g、茯苓15 g、丹皮15 g、肉桂5 g、附子5 g、车前子10 g、牛膝10 g)由培力(南宁)药业有限公司提供,蒸馏水稀释至8.75 g/2 mL,4℃保存备用;胎牛血清(批号:2335473CP)、DMEM培养基(批号:8121342)购于Gibco公司;CXCR4兔单克隆抗体(批号:GR3231217-19)购于abcam公司;SDF-1兔单克隆抗体(批号3503 S)购于CST公司;抗CD44抗体(批号:746123)购于BD公司;CD34鼠单克隆抗体(批号:9471PABX191031032420-PE)、抗CD105抗体(批号:532059040320-PE)购于Novus公司;ELISA试剂盒(批号:202102)购于武汉华联科生物技术有限公司;PKH67常规细胞膜标记试剂盒(批号:DCM210707)购于北京富百科生物技术有限公司;DAPI溶液(批号:20210420)、Mayer1苏木精染 料(批 号:20210419)、伊 红 染 液(批 号:20200927)购于索莱宝有限公司。
低温高速离心机购自美国Beckman coulter公司;全自动生化分析仪购自日本Olympus公司;流式细胞仪购自美国BD公司;荧光显微镜购自美国Thermo Fisher Scientific公司;酶标仪购自美国Thermo Scientific公司。
1.3 实验方法
1.3.1 分组与干预方法
40只SD大鼠适应性喂养7 d后,随机分为正常组、模型组、BMSCs移植组(BMSCs组)、BMSCs移植联合济生肾气汤组(联合组),每组10只。采用40%四氯化碳橄榄油溶液(四氯化碳溶液与橄榄油比例为4∶6)以0.2 mL/100 g剂量腹腔注射,每周3次,同时予高脂饲料(普通饲料颗粒90%,猪油8%,胆固醇2%)喂养,共诱导8周建立肝硬化大鼠模型。与正常组比较,模型组大鼠血清ALT、AST及GGT水平显著升高,且肝组织病理学观察到假小叶生成及炎症细胞浸润等提示造模成功。造模后,BMSCs组采用荧光标记的BMSCs悬浮液经鼠尾静脉注入大鼠体内,每周1次,连续注射4周;联合组在此基础上,根据“体表面积折算的等效剂量比率表”给予中药混悬液8.75 g/(kg·d)灌胃,每日1次,连续4周;正常组与模型组不予干预。
1.3.2 BMSCs提取、培养及鉴定
取4周龄SD大鼠,处死后置于75%乙醇中浸泡10 min,超净工作台上分离股骨与胫骨,PBS液冲洗骨髓腔,收集冲洗液,常温下1500 r/min离心10 min,弃去上清液,以含10%胎牛血清DMEM/F12培养液重悬制备成单细胞悬浮液,接种于25 cm2培养瓶中,置于37℃、5% CO2饱和湿度培养箱中,72 h后首次换液,之后每2 d换液1次,3~4 d按1∶2进行传代。
第3代BMSCs生长融合达90%时,用0.25%胰蛋白酶消化,1000 r/min离心5 min并以PBS洗涤2遍,洗涤完后加入PBS重悬细胞。血细胞计数板计数过滤后的细胞数量,每管取106个细胞重新悬于200 μL PBS中,加入CD34、CD44、CD105抗体,进行流式细胞仪分析。
1.3.3 BMSCs荧光标记、移植、追踪
0.25%胰蛋白酶消化并收集生长状态良好的第3代BMSCs。稀释适量PKH67染色工作液用于重悬细胞,重悬后浓度约每毫升106个。4℃孵育30 min,加入胎牛血清终止反应,离心后去除上清,沉淀用PBS洗涤2遍后加入完全培养液重悬,转移至25 cm2培养瓶中,24 h后荧光显微镜下观察细胞染色情况。
将荧光标记的第3代BMSCs用生理盐水稀释配置成细胞悬浮液1.5 mL(约含细胞数量2×106个)经大鼠尾静脉缓慢注入体内,每周1次,从第9周起,连续注射4周,至12周末取肝组织制作冰冻切片。DAPI染液常温下复染10 min,流水冲去染液,加入抗荧光淬灭剂封片,置于荧光显微镜下观察归巢情况。
1.3.4 肝功能检测
肝功能检测禁食24 h,不禁水,将大鼠麻醉后,取腹主动脉血,静置30 min后离心分离血清,全自动生化仪检测ALT、AST、ALB、γ-GGT及TBIL等指标。
1.3.5 HE染色
取大鼠肝组织,4%多聚甲醛固定、脱水、透明、石蜡包埋切片,进行HE染色,置于光学显微镜下观察肝组织病理学形态,参照《肝纤维化中西医结合诊疗指南(2019年版)》[7]对肝组织炎症活动度及纤维化分期进行评分。
1.3.6 ELISA实验
取大鼠腹主动脉血,离心,分离血清用于ELISA检测GCSF、EPO、HGF及SCF,检测过程依照ELISA试剂盒说明进行,经自动计数程序得出浓度。
1.3.7 免疫组化分析实验
大鼠肝组织石蜡切片经常规脱蜡处理后,高压抗原修复,依次滴加过氧化物酶阻断液37℃封闭、10%非免疫血清37℃孵育、加入一抗工作液4℃过夜,生物素标记二抗工作液37℃孵育及链酶亲和素-生物素-辣根过氧化物酶工作液37℃孵育,DAB显色,苏木素复染,脱水透明,中性树胶封片。显微镜下观察并拍照,用Image pro plus软件计算IOD值。
1.4 统计学方法
采用SPSS 23.0软件进行统计分析。计量资料以平均数±标准差(±s)表示,两样本均数间的比较采用t检验;多个样本间的比较采用单因素方差分析(One-way ANOVA),以P<0.05为差异具有统计学意义。
2 结果
2.1 大鼠BMSCs表面抗原鉴定
流式细胞仪检测全骨髓贴壁法培养的第3代BMSCs表面抗原CD34(-),CD44(+),CD105(+),见图1。以上检测结果证明提取的细胞符合骨髓间充质干细胞特征。
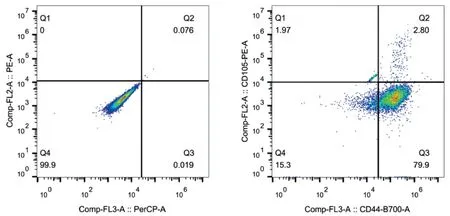
图1 细胞表面抗原检测结果Figure 1 Cell surface antigen results
2.2 BMSCs的形态特征
镜下见第三代细胞生长旺盛,形态均一,呈现旋涡样结构排列。见图2。

图2 倒置显微镜下观察BMSCs形态特征Figure 2 Morphological characteristic of BMSCs under the inverted microscope
2.3 各组大鼠肝功能情况
与正常组比较,其余各组大鼠血清ALT、AST、γ-GGT及TBIL水平均增高,血清ALB水平下降;与模型组比较,BMSCs组与联合组大鼠ALT、AST、γ-GGT及TBIL不同程度下降,ALB不同程度升高,差异具有统计学意义(P<0.05);与BMSCs组比较,联合组大鼠血清ALT、AST、γ-GGT、TBIL水平降低,ALB水平升高,差异有统计学意义(P<0.05)。见图3。

图3 各组大鼠血清ALT、AST、ALB、γ-GGT及TBIL比较Note. Compared with normal group, *P<0.05. Compared with model group, ▲P<0.05. Compared with BMSCs group, △P<0.05.Figure 3 Comparison of ALT, AST, ALB, γ-GGT and TBIL in serum of rats
2.4 大鼠肝组织病理学观察
正常组大鼠肝小叶的结构、形态正常,无明显的炎症及纤维化病理表现。模型组大鼠肝索排列紊乱,肝小叶结构破坏,中央静脉偏离或消失,部分组织呈炎性细胞浸润像,纤维结缔组织增生,形成许多大小不等的假小叶且假小叶结构紊乱。BMSCs组大鼠肝组织纤维化程度减轻,仍可见炎症细胞浸润。联合组肝小叶结构修复,假小叶的数量有明显的减少,肝索排列的整齐度改善,见少量的炎性细胞浸润。见图4。

图4 各组大鼠肝组织病理学情况Figure 4 Liver pathology of rats in each group
肝病理学评分:与正常组比较,模型组大鼠肝组织炎症及纤维化情况明显;与模型组比较,BMSCs组、联合组炎症活动度及纤维化情况均有不同程度改善,差异有统计学意义(P<0.05),与BMSCs组比较,联合中组改善情况明显,差异具有统计学意义(P<0.05)。见表1。
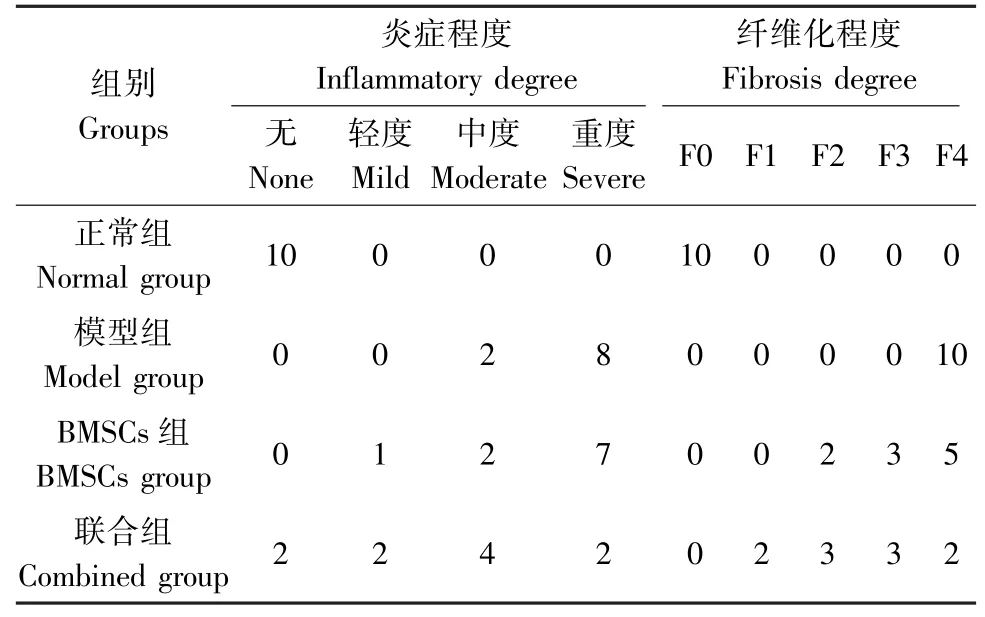
表1 各组大鼠肝组织炎症活动度及纤维化分期评分(n=10)Table 1 Liver inflammatory degree and fibrosis staging scores of rats
2.5 荧光显微镜观察BMSCs 标记及归巢情况
荧光显微镜下见BMSCs呈长梭形、三角形,胞膜发绿色荧光,细胞标记率为99.5%。阴性对照组仅见肝组织细胞着色的DAPI蓝色荧光。BMSCs组与联合组切片上可见组织细胞非特异着色的DAPI呈蓝色荧光,及散在分布点状绿色荧光。其中联合组较BMSCs移植组同倍数视野下绿色荧光光点增多。见图5。

图5 BMSCs移植后在肝中的分布情况Figure 5 Distribution of BMSCs in liver after transplantation
2.6 血清GCSF、EPO、HGF及SCF表达情况
比较各组间大鼠血清GCSF、EPO、HGF、SCF,与正常组比较,模型组表达下调,差异具有统计学意义(P<0.05)。与模型组大鼠比较,BMSCs组及联合组均有上调(P<0.05);与BMSCs组比较,联合组血清GCSF、EPO、HGF、SCF表达水平更高,差异具有统计学意义(P<0.05)。见图6。
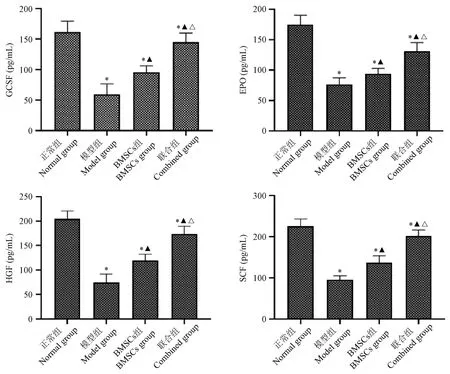
图6 各组大鼠血清GCSF、EPO、HGF及SCF表达情况比较Note. Compared with normal group, *P<0.05. Compared with model group, ▲P<0.05. Compared with BMSCs group, △P<0.05.Figure 6 Comparison of GCSF, EPO, HGF and SCF expressions in serum of rats in each group
2.7 SDF-1、CXCR4蛋白在肝组织中定位表达
SDF-1蛋白在肝组织中阳性表达为细胞膜呈棕黄色颗粒状染色;CXCR4蛋白在肝中阳性表达为胞浆或者浆膜呈棕黄色颗粒状染色。见图7、图8。

图7 各组大鼠肝组织SDF-1表达Figure 7 Comparison of SDF-1 expression in liver of rats in each group

图8 各组大鼠肝组织CXCR4表达Figure 8 Comparison of CXCR4 expression in liver of rats in each group
平均光密度值分析结果:与正常组比较,模型组肝SDF-1、CXCR4蛋白表达均有所下调,差异具有统计学意义(P<0.05);与模型组比较,BMSCs组与联合组SDF-1、CXCR4蛋白均有所上调,联合组表达高于BMSCs组差异具有统计学意义(P<0.05)。见表2。

表2 各组大鼠肝组织SDF-1、CXCR4蛋白表达情况比较Table 2 Comparison of SDF-1 and CXCR4 protein expression in liver of rats in each group
3 讨论
肝硬化是常见的临床综合征,流行病学调查发现,全球范围内肝硬化患者高达1.12亿[8],每年4%~12%患者进展为失代偿期肝硬化[9],5年内死亡率可升高至88%[10]。对于对症支持治疗无法改善的失代偿期肝硬化、肝衰竭,肝移植是目前最有效的治疗方式但存在许多限制临床应用的问题如:供体紧缺、器官分配、免疫排斥等。间充质干细胞移植作为可及性较强的移植治疗方法,可重复、单次费用低、安全性高,被视为肝移植的有效替代手段,但如何促进干细胞归巢的问题亟待解决[11]。有学者提出中药具有促进干细胞归巢的作用,如鳖甲煎丸、软肝化纤方等中药组方促进干细胞向肝迁徙定植的作用已得到证实[12-13]。
中医并无“肝硬化”病名,但在肝硬化治疗领域有一定的文献记录,从“臌胀”、“黄疸”、“胁痛”等疾病的诊疗中可见一斑。中医在肝病的治疗中格外重视肝肾关系,如藏象理论中的“肾藏精”学说认为,肾精聚而为髓,精髓化生血液充养肝,以供其维持生理功能,而肾精亏虚则是慢性肝病进展的关键环节之一,因此中医在慢性肝病的治疗强调“补益肾精”[14]。骨髓间充质干细胞是一类具有多分化潜能的细胞,可分化为各种功能细胞和组织器官,符合中医理论中“肾精”和“髓”的范畴[15]。干细胞移植通过外源性增加干细胞来源治疗肝硬化的方式,与中医“补肾生髓生肝”理论吻合。本次研究运用的济生肾气汤,源自《济生方》,此方补泻兼施,水火既济,诸药合用共同达到补肾益髓,温化输布精气的功效。临床应用中,济生肾气汤治疗肝硬化已取得了明显疗效[16-17],并且在实验研究也有一定研究成果[18-19]。本次实验联合济生肾气汤与BMSCs移植,发现模型大鼠肝功能指标下降,病理检查见肝硬化改善明显,肝组织炎症及纤维化评分显著下降,说明BMSCs移植联合济生肾气汤确有治疗肝硬化疗效;在肝组织冰冻切片中观察到联合组的干细胞数量多于BMSCs移植组,初步验证了济生肾气汤可促进BMSCs迁移至肝内定植和存活。
BMSCs移植的疗效取决于归巢与长期定植的能力,但BMSCs从骨髓向靶组织迁徙受到微环境中的多种因素复合影响。SDF-1/CXCR4轴是调节干细胞迁徙所需内外环境的关键环节,SDF-1是高度表达于炎症损伤的组织或器官中的一种炎症趋化因子,CXCR4是其特异性受体[20]。肝组织炎症损伤形成了SDF-1α浓度梯度,CXCR4阳性的干细胞沿着此浓度梯度由外周血向损伤肝组织迁徙则为干细胞归巢过程[21]。研究发现,细胞因子GCSF、EPO参与调控SDF-1/CXCR4轴活性[22-23],进而诱导SCF、HGF等因子的表达,促进干细胞生长、迁徙并向肝细胞分化[24-25]。本次研究检测了各组大鼠血清中GCSF、EPO、SCF及HGF的水平,结果发现BMSCs移植联合济生肾气汤组大鼠血清水平较模型组明显升高,说明济生肾气汤具有调控干细胞增殖、迁徙相关因子,激活SDF-1/CXCR4轴促进BMSCs归巢的潜能。再而通过检测各组大鼠肝中干细胞归巢相关蛋白SDF-1、CXCR4的表达及定位,发现联合济生肾气汤干预后可显著提高肝内两种蛋白的表达量,说明其在BMSCs在植入体内向损失部位迁徙并定植的过程中,对SDF-1/CXCR4轴起了调节作用。因此我们推测济生肾气汤联合BMSCs移植治疗肝硬化的机制为,济生肾气汤通过促进植入的BMSCs在肝中定植并增殖,以及与其他细胞发生融合或直接分化为肝细胞以代替修复损失的肝组织,增强肝再生能力,恢复肝细胞功能。
综上所述,本研究再次验证了SDF-1/CXCR4信号生物轴与干细胞迁徙并定植密切相关,证明了济生肾气汤可以促进GCSF、EPO、SCF、HGF等干细胞动员因子分泌,激活SDF-1/CXCR4轴,提高受损肝组织募集干细胞的水平,修复受损肝,从而在肝硬化大鼠治疗中发挥作用。
