多指标优选地黄提取工艺及抗氧化活性研究
2022-10-02许海燕彭修娟陈衍斌刘艳红侯敏娜
许海燕,王 珊,彭修娟,陈衍斌,刘艳红,侯敏娜,王 青,刘 峰,*
(1.陕西国际商贸学院医药学院,陕西 咸阳 712046;2.陕西步长制药有限公司,陕西 西安 710075)
地黄为玄参科植物地黄(Rehmannia glutinosaLibosch.)的新鲜或干燥块根,始载于《神农本草经》,被列为上品[1],全国各地均有栽培,是我国常用的大宗中药树之一,应用非常广泛,具有清热凉血,养阴生津等功效。查阅文献发现[2]地黄的主要活性成分为多糖、环烯醚萜、苯乙醇苷、核苷等,其中多糖和环烯醚萜类化合物梓醇含量较高。现代药理研究表明[3-6],地黄多糖具有增强免疫力、抗肿瘤、抗衰老、调节血糖、血脂、抗疲劳焦虑等作用。梓醇具有治疗心脑血管疾病、糖尿病及其并发症、骨质疏松症以及神经保护等作用[7]。目前,对于地黄的提取工艺研究多以地黄多糖或梓醇为测定指标,很少以多指标联合来考察。故本研究以地黄中多糖和梓醇的提取率为评价指标,采用响应面-满意度函数优化提取工艺,确定最佳工艺参数,建立共提取方法,并对地黄的抗氧化活性进行研究,以期为地黄的提取及进一步发展提供参考依据。
1 材料与方法
1.1 材料与仪器
1.1.1 材料
生地黄购自河南省焦作市,经陕西中医药大学杨新杰教授鉴定为玄参科地黄的干燥块根[Rehmannia glutinosa(Gaertn.)Libosch];梓醇对照品(110808-202011,纯 度≥98%)及葡萄糖对照品(110833-202008,纯度≥99.8%)购自中国食品药品检定研究院;乙腈、甲醇为色谱纯,其它均为分析纯。
1.1.2 仪器
Waters-2695高效液相色谱仪(美国waters公司);TU-1810紫外分光光度计(北京普析通用仪器有限责任公司);旋转蒸发仪(上海亚荣生化仪器厂);FA1004分析天平(上海力辰邦西仪器科技有限公司);XY-200粉碎机(永康市松青五金工具厂)。
1.2 地黄多糖含量测定
1.2.1 葡萄糖标准曲线绘制
精密称取葡萄糖对照品5 mg,置于50 mL的容量瓶,用蒸馏水溶解并定容,配制成浓度为0.10 mg/mL的葡萄糖标准溶液,吸取上述溶液2、4、6、8、10 mL置于10 mL容量瓶中,再分别加入蒸馏水定容至刻度,即得浓度为0.02、0.04、0.06、0.08、0.10 mg/mL的标准品溶液。分别取1 mL不同浓度标准品溶液加入5%苯酚1 mL及5 mL浓硫酸振荡均匀,80℃水浴加热30 min后取出,放凉至室温待测,蒸馏水为空白对照,在488.5 nm处测得吸光度值并记录试验数据,浓度为横坐标(X),吸光度为纵坐标(Y),绘制标准曲线,结果显示,葡萄糖浓度在0.02~0.10 mg/mL时,线性关系良好,其回归方程为Y=6.356 1X-0.025 5,相关系数R2=0.993 8。
1.2.2 供试品溶液的制备与测定
称取适量地黄粉末,乙醇为提取溶剂,超声提取后取滤液。滤液于4℃冰箱静置过夜后离心,上清液减压浓缩后的干燥物做多糖含量测定。加入适量蒸馏水将多糖溶解并定容,采用“1.2.1”项下方法测定多糖含量,计算多糖提取率。

1.3 梓醇含量测定
1.3.1 色谱条件
色谱条件[8]:色谱柱Waters XBridge C18(250 mm×4.6 mm,5μm);柱温30℃;检测波长210 nm;流动相:乙腈/0.1%磷酸(1:99);进样体积10μL;流速1 mL/min,对照品和样品色谱图如下。
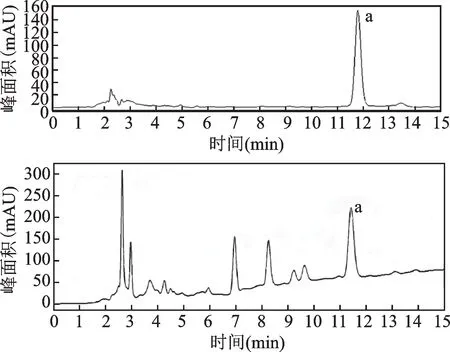
图1 梓醇对照品、地黄样品HPLC图谱(a为梓醇色谱峰)Fig.1 HPLC chromatogram of catalpol standard solution and Rehmannia sample(a is catalpol chromatographic peak)
1.3.2 梓醇标准曲线绘制
精密称取梓醇对照品1 mg,用流动相定容于100 mL的容量瓶中,配制成浓度为0.01 mg/mL的标准溶液,分别移取标准溶液2、3、4、5、6、7、8 mL置于10 mL容量瓶中,用流动相定容至刻度,按照“1.3.1”项下色谱条件进样,以浓度(X)为横坐标,以峰面积(Y)为纵坐标,绘制标准曲线。结果显示,梓醇在浓度为0.002~0.008 mg/mL时线性关系良好,回归方程为Y=304 693X-71 265.7,相关系数R2=0.999 2。
1.3.3 供试品溶液的制备与测定
按“1.2.2”项下供试品溶液的提取方法,取上清液减压浓缩后用流动相溶解并定容,按“1.3.1”项下的色谱条件,测定梓醇含量,计算梓醇提取率。

1.4 单因素试验
本试验使用控制变量法,在保证其他条件不变的情况下,分别考察乙醇浓度(10%、20%、30%、40%、50%、60%、70%、80%)、提取时间(10、15、20、25、30、35、40、45 min)、料液比(5∶1、10∶1、15∶1、20∶1、25∶1、30∶1、35∶1、40∶1 mL/g)对同时提取地黄中多糖和梓醇提取率的影响。分别称取8份相同质量的地黄粉末,试验时固定两个单因素,考察其中一个单因素的变化对地黄多糖和梓醇提取率的影响,最终得到最佳乙醇浓度、提取时间、液料比。
1.5 响应面-满意度函数
1.5.1 满意度函数
满意度函数常常被用于多目标优化,操作方便,运用比较广泛,能智能反映出多因素影响下试验设计方案的最佳结果,这种方法,是将不同响应值转化为0到1之间的无量纲数值,可以将多响应值优化转变为单响应值优化,易于寻求整体最优[9-10]。满意度函数公式参考如下:

其中Di(Yi)为总体满意度,Yi(x)表示对应某个响应值,Yi,min与Yi,max分别表示指标中最低与最高响应值,Wi表示权重,W1+W2+……Wn=1,设W1多糖权重,W2为梓醇权重,通过查阅相关文献[11-12],地黄活性成分梓醇较多糖重要,故设定W1为0.4,W2为0.6。
1.5.2 响应面分析法
以地黄多糖和梓醇的提取率为指标,以单因素试验为基础,根据Box-Behnken中心组合设计原理,选取乙醇浓度、提取时间、液料比三因素进行响应面分析,每次试验平行三次,取平均值。每次试验得到的多糖及梓醇提取率根据满意度函数转化为总体满意度值,对试验结果进行方差分析,确定地黄多糖和梓醇的最佳共提取条件并进行验证,最终得到最佳提取工艺方案。
1.6 抗氧化活性研究
1.6.1 供试品溶液制备
将“1.2.2”项下得到的上清液浓缩干燥后用30%乙醇制成0.1、0.3、0.5、0.7、0.9、1.1、1.8、2.1 mg/mL的溶液,进行抗氧化活性试验。
1.6.2 对照品溶液制备
分别称取适量的维生素C(VC)与二丁基羟基甲苯(Butylated hydroxytoluene,BHT)对照品按供试品溶液同浓度配制,作为抗氧化的对照品溶液备用。
1.6.3 DPPH自由基清除率测定
精密称取适量DPPH用无水乙醇配制成浓度为0.04 mg/mL的DPPH自由基溶液。取不同浓度的供试品溶液2.0 mL与2.0 mL的DPPH自由基溶液,在室温下充分混合均匀,避光反应30 min后在波长为517 nm处测定混合溶液的吸光度记为Ai,样品溶液和无水乙醇溶液的吸光度值Aj,无水乙醇和DPPH溶液吸光度值Ao,无水乙醇为空白对照,Vc及BHT溶液做阳性对照,按下列公式计算DPPH自由基清除率。

1.6.4 ABTS自由基清除率测定
精密称取适量的ABTS配制成10 mmol/L的溶液和浓度为4 mmol/L的过硫酸钾溶液混合摇匀,避光放置10小时制得ABTS自由基阳离子(ABTS+)原液。取不同浓度供试品溶液各0.1 mL,同ABTS工作液3.9 mL混合后在室温下避光反应6 min,在734 nm处测定吸光度值(A1),供试品与无水乙醇混合溶液吸光度(A2),无水乙醇做空白对照,以VC及BHT溶液做阳性对照。按下列公式计算ABTS+清除率。

1.7 统计学分析
所有数据采用SPSS 17.0软件处理,采用邓肯氏法进行显著性分析,P<0.05为显著性差异。所有试验重复3次,结果以平均值±标准差(±S)表示。
2 结果与分析
2.1 单因素试验结果
2.1.1 乙醇浓度对地黄多糖及梓醇共提取的影响
图2(a)为乙醇浓度对地黄多糖和梓醇提取率的影响。从图中可直观看出,随着乙醇浓度的增加,地黄多糖的提取率逐渐下降,10%~40%之间下降的比较明显,40%以后下降比较缓慢,说明地黄多糖在40%后的乙醇中溶出较少。但地黄梓醇提取率随着乙醇浓度的增加有所升高,当乙醇浓度达到40%时,梓醇提取率最高,乙醇浓度40%以后梓醇提取率又缓慢下降,综合考虑同时提取地黄中多糖和梓醇两种有效成分,故选取30%乙醇浓度为最优。
2.1.2提取时间对地黄多糖及梓醇共提取的影响
图2(b)为提取时间对多糖和梓醇提取率的影响。从图中可看出,随着提取时间的延长地黄多糖和梓醇的提取率也随之增加,多糖和梓醇均在20 min时提取率最高,说明地黄多糖和梓醇在提取20 min时药材内外浓度达到平衡,故选择提取时间20 min为最优。
2.1.3 液料比对地黄多糖及梓醇共提取的影响
用相同的分析方法解析图2(c)液料比对地黄多糖及梓醇共提取的影响,从图中看出,地黄多糖和梓醇在液料比5∶1至10∶1时提取率逐渐上升,在10∶1后提取率不再有显著提高,趋于平稳,可能在液料比10:1时,地黄多糖和梓醇几乎提取完全,故液料比确定10∶1为最佳。

图2 不同条件对地黄多糖及梓醇共提取的影响Fig.2 Effects of different conditions on extraction of the co-extraction of polysaccharide and catalpol yield
2.2 响应面-满意度函数优化结果
用响应面软件对地黄多糖、梓醇共提取工艺进行优化。在多糖(Y1)、梓醇(Y2)得率的基础上计算总体满意度(D)值,以D为响应值,优化地黄多糖和梓醇的共提取条件。设计试验方案见表1,试验结果见表2。

表1 因素水平表Tab.1 Factors and level coding of test

表2 试验设计方案及结果Tab.2 Experimental design of response surface methodology
依据Box-Behnken响应曲面法对地黄中多糖及梓醇提取率共提取工艺进行优化,以满意度为响应值,结果设计17组试验。应用Design-Expert 10软件分析数据,得到了多元二次回归模型方程:D=0.42+0.026×A+2.838×10-3×B-0.28×C-6.625×10-3×AB-0.044×AC+0.046×BC-0.010×A2-0.011×B2+0.12×C2。方程式中D为满意度,A为乙醇浓度,B为提取时间,C为液料比。
回归方差分析见表3,从表中可以看出P模型<0.000 1,说明模型极显著。F失拟项=2.03>0.05,由此可见,失拟项不显著,模型可信[13-14]。调整确定系数R2Adj=0.991 9,说明99.19%的响应值变化能够用该模型解释。此外,从表3可以明显看出,各因素的一次项中只有B对响应值的影响无显著性差异(P>0.05),说明提取时间对多糖和梓醇提取率影响不显著;交互项中AB对响应值影响不显著(P>0.05),说明乙醇浓度与提取时间之间无影响。以上分析可以看出各因素与响应值间并非单纯的线性关系。由一次项P值的大小可以得出各因素对响应值满意度的影响排序为:液料比(C)>乙醇浓度(A)>提取时间(B)。
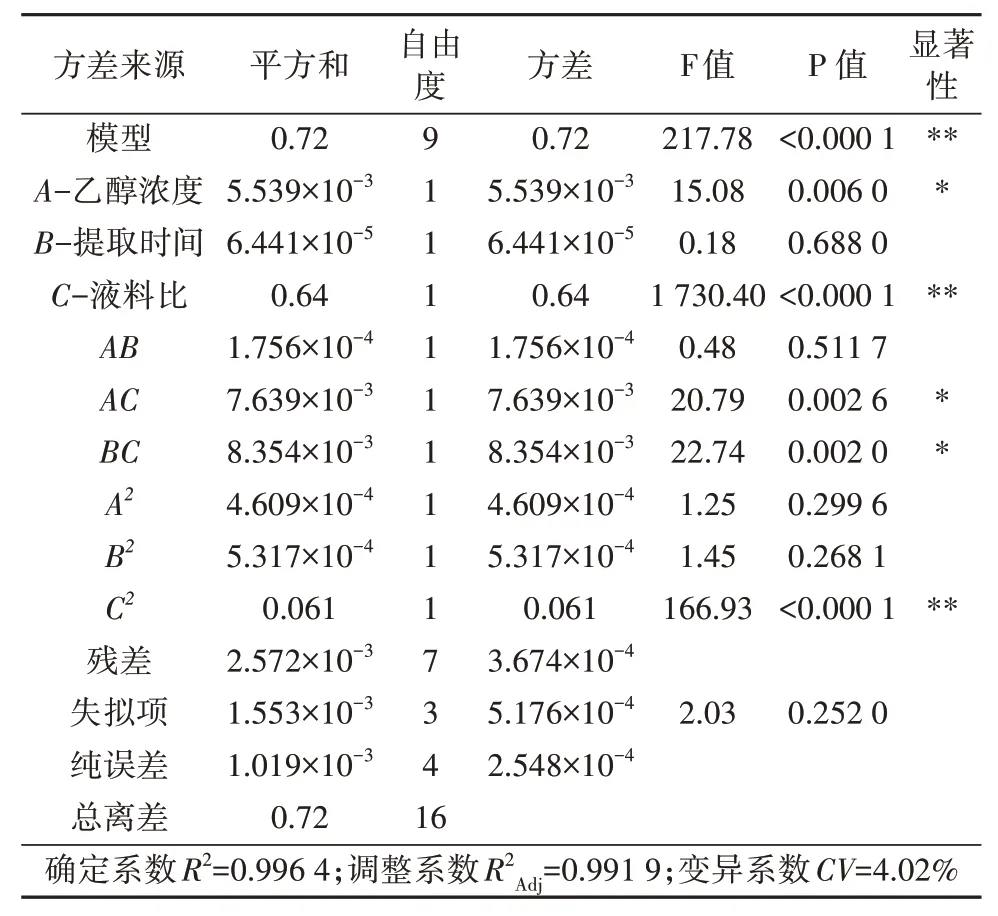
表3 方差分析表Tab.3 Regression equation analysis of variance table
使用Design-Expert 10软件绘制而成的响应曲面及等高线图如图3(a~c)所示,从这些图中可以看到3因素的最佳参数和各因素之间的交互作用。从图中可看出液料比最佳范围为5∶1~15∶1,最佳乙醇浓度为25%~35%,最佳提取时间范围为17~23 min。由图3(b~c)可明显看出,其曲面图较陡峭,说明提取时间与液料比及乙醇浓度与液料比之间的交互作用较显著,与表3方差分析结果相吻合。

图3 各因素响应面与等高线分析图Fig.3 Response surface and contour plot analysis diagram of each factor
根据Design-Expert 10软件对模型方程计算整理,可以得出地黄多糖和梓醇的共提取最佳提取工艺为:乙醇浓度为30%,提取时间为15.57 min,液料比为10.05∶1,在此工艺条件下,多糖提取率为17.31%,梓醇提取率为0.94%,为考虑试验的可操作性,现将工艺调整为乙醇浓度30%,提取16 min,液料比10∶1,多糖提取率最高为16.15%,梓醇提取率为0.92%,分别比预测值下降1.16%与0.02%,验证试验结果与预测值接近,说明本研究建立的回归模型可较好反映地黄共提取条件,优化的工艺结果准确可行。
2.3 抗氧化活性结果分析
2.3.1 DPPH自由基清除率测定结果
图4(a)为不同浓度地黄对DPPH自由基清除率的关系图,并与Vc及BHT对照品进行对比。从图中可以看出,不同浓度供试品对DPPH自由基清除率具有显著性差异,随着供试品浓度的增加对DPPH清除率也逐渐增加(P<0.05),当地黄浓度为0.3 mg/mL时,地黄对DPPH的清除率为52.16%,清除作用大于标准品抗氧化剂BHT的45.38%(P<0.05)。从图中也可看出地黄清除DPPH自由基能力一直小于VC对照品,但从0.3 mg/mL后大于BHT清除率,说明地黄对DPPH自由基有很好的清除能力。
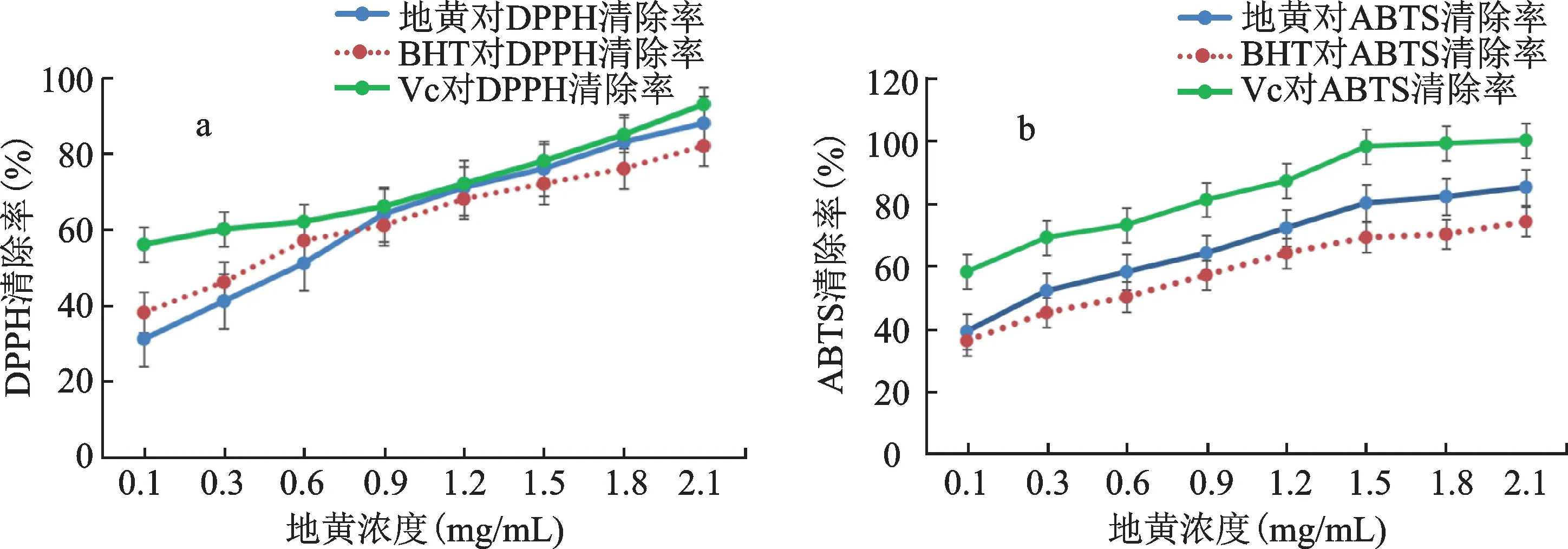
图4 地黄对不同自由基清除率的影响Fig.4 Effects of different free radical scavenging rates of R.glutinosa
2.3.2 ABTS自由基清除率测定结果
图4(b)表示不同浓度地黄对ABTS自由基清除率的关系图,并与Vc、BHT对照品进行对比。从图中可以明显看到,不同浓度地黄对ABTS自由基清除率之间具有显著性差异,且清除率随着样品浓度的增加而逐渐增大(P<0.05),虽然从图中也可直观的看出Vc对ABTS自由基清除效果优于地黄,但地黄对ABTS自由基的清除率一直高于BHT(P<0.05)。故地黄对ABTS阳离子自由基也具有一定的清除能力。
3 结论和讨论
多糖和梓醇同为地黄中的功效物质,实际操作中常对其中一种成分进行提取,同时提取地黄多糖和梓醇的文献报道较少,故将二者同时提取具有一定的实际意义。虽然地黄多糖可溶于热水,梓醇在水中也有一定的溶解性,但由于水提液不易保存且杂质多,故本试验采用含水乙醇为提取溶剂,并考察了不同浓度乙醇、提取时间、液料比三种影响因素下多糖和梓醇共提取的提取率,希望能为地黄中多糖和梓醇的共提取方法提供参考,也为地黄的进一步研究提供理论价值。
药理学研究发现,地黄对免疫系统、血液系统、神经系统等有一定调节作用,此外,还可抗衰老、降三高、抑菌、抗肿瘤,保护胃黏膜及抗胃溃疡等作用[15]。但对于其抗氧化活性鲜少报道,本研究结果发现,地黄具有显著的抗氧化活性,且随着浓度的增加抗氧化活性也随之增加,这为地黄活性及药理作用的进一步研究提供一定的参考。
地黄多糖和梓醇的活性及药理作用得到了越来越多的科学证实,使得地黄的市场需求不断增大。目前,地黄多糖和梓醇已应用于各种药理、临床及保健品领域。另一方面,由于地黄中多糖及梓醇含量均相对较低,直接食用地黄的保健和药用效果仍相对较差。本研究的显著特点为地黄多糖和梓醇同时提取,即可获得提取物中较高含量的多糖和梓醇,因此,本研究所得提取物将为地黄保健品及药品生产提供生产原料,可有效提高地黄药效。将为地黄的发展提供更好的研究思路。
