低温保存对猪精子的损伤研究
2022-10-02黄清松韩雪峻张宏亮王申元刘羿羿刘春霞张焱如周欢敏曹俊伟
黄清松 ,韩雪峻 ,张宏亮 ,王申元 ,凌 宇 ,刘羿羿 ,刘春霞 ,张焱如 ,周欢敏 ,李 璐 ,曹俊伟
(1.内蒙古农业大学生命科学学院,内蒙古 呼和浩特 010018;2.内蒙古自治区生物制造重点实验室,内蒙古 呼和浩特 010018;3.上海祥欣畜禽有限公司,上海 200000;4.内蒙古赤峰市元宝山区农牧局,内蒙古 赤峰 024076)
1 前言
目前生猪养殖业人工授精主要使用的是鲜精,冻精使用比例仅占1%左右。猪精液的低温保存研究早在18世纪60年代就开始了,研究初期复苏精子的活力仅达到30%,随着研究的不断进行,20世纪初冷冻后复苏猪精子活力可达到60%,但仍然达不到生产要求,无法应用于商品猪养殖。20世纪70年代,我国开始以液氮作为冷冻源进行精液冷冻保存的研究,20世纪90年代以后冷冻精液从颗粒型转变为细管型。1977年,我国成立猪精液冷冻技术研究相关小组,对猪精液冷冻问题展开深入研究相关规范操作。由于猪每次射精量大,精子质膜不饱和脂肪酸比例高等特殊的生物学特性,冷冻—解冻过程中容易受到损伤,与鲜精相比还具有很大差距。低温保存精液用于人工授精后,母猪的受胎率、分娩率、窝产仔数均低于鲜精,其繁殖效果不尽人意。
国外许多研究报道,在精液稀释液中添加其他物质,如糖类、抗氧化类、蛋白类、维生素类等可对提高低温保存精液品质产生一定作用。国内对于猪精子低温保存主要集中在保护剂的探究和冷冻方法的研究。李青旺等、周佳勃等和李井春等均对冷冻保护剂、冷冻程序和不同精液稀释液对猪精子活力的影响进行了研究,其最终目的均为了提高冻精的品质,扩大冻精在人工授精中的使用比例,降低生猪养殖成本。
2 材料与方法
2.1 实验材料
本实验的猪精液均来自位于陕西省榆林市的上海祥欣榆林公猪站,选取3头优质杜洛克公猪,精子活力为70%以上的,精子形态正常的,精子密度为0.6×108/mL,于37.5℃条件下将精液运输到实验室。
2.2 实验方法
2.2.1 0.5mL细管冻精制备与精液解冻
将样品经过筛选后混匀在一起,以消除个体间差异对实验造成的影响,首先将样品放入室温下平衡1 h,接着放进4℃环境缓慢降温2 h,将470 uL降温后的样品小心注入0.5 mL细管中,使用配套的封口粉将注入样品的细管封住,之后将细管置于液氮面上2 cm处熏蒸10 min,最后将熏蒸好的样品投入到液氮中保存两周。处理后的细管冻精将用于实验组,鲜精用于对照组。解冻时,快速将充满精液的细管从液氮中取出并投入到37 ℃水浴中缓慢震动,并观察精液溶解情况,待精液完全溶解时,马上取出细管,剪开两端,取出精液并在室温下800 g×离心5 min,去掉上清液。
2.2.2 猪精子质膜完整率检测
采用双荧光染色流式细胞术对精子质膜进行检测(B DTM,Annexin V-FITC,货号C1062M)。将对照组和复苏后的实验组精子样品分别收集到1.5 mL离心管中,800 g×离心5 min,将上清丢弃,用37 ℃预热的PBS缓冲液将其分别稀释,使精子细胞浓度为2×106~3×106/mL,用PBS缓冲液对样品清洗两次后,再使用Annenin V-FITC结合液对样品重新悬浮,使精子细胞浓度为1×106~1.5×106/mL,取195 uL精子悬液,加入5 uLVF I T C充分混匀,室温下孵育10 min,然后加入10 uL PI染色液充分混匀,室温避光孵育15 min。利用N o v e C y t eTM型流式细胞仪(下同)检测每个精子细胞的前向角散射(FSC)和侧向角散射(SSC),使用波长为520 mm的带过滤器检测F I T C荧光信号(BL1),另一波长大于610 mm的带过滤器检测PI(BL3)。每份样品至少检测10 000个精子细胞,使用流式细胞仪自带的软件进行分析。
2.2.3 猪精子顶体完整率检测
采用异硫氰酸酯荧光标记的花生凝集素(FITC-PNA)和碘化丙丁(PI)双染法对猪精子进行顶体完整率检测。操作如下:(1)阴性对照:取200 uL稀释好的样品直接上机;(2)FITC-PNA单染:取200 uL稀释好的样品600 g×离心4 min,弃上清,加入190 uL PBS缓冲液再加入10 uL FITC-PNA染液,轻轻混匀避光37℃孵育20 min,孵育结束后上机;(3)PI单染:取200 uL稀释好的样品600 g×离心4 min,弃上清,加入190 uL PBS缓冲液再加入10 uL PI染液,轻轻混匀避光37℃孵育5 min,孵育结束后上机;(4)双染:取200 uL稀释好的样品600 g×离心4 min,弃上清,加入180 uL PBS缓冲液再加入10 uL FITC-PNA染液,轻轻混匀避光37℃孵育20 min,孵育结束后加入10 uLPI染液,充分混匀避光37℃孵育5 min,孵育结束后直接上机;(5)流式细胞检测:使用配备激发波长488 mm,应用前向散射光(FSC)和侧向散射光(SSC)设门后,绿色荧光采用BL1通道检测,红色荧光采用BL3检测通道每份样品至少检测10 000个精子细胞,使用流式细胞仪自带的软件分析。
2.2.4 猪精子核DNA完整性检测
采用流式细胞仪吖啶橙染色法检测猪精子核完整性,分别将新鲜精子和冻融后的精子样品收集到1.5 mL离心管中,800 g×离心5 min,将上清丢弃,用37℃预热的TNE缓冲液将其分别稀释,使精子样品浓度调整至1×106~2×106/mL,取100 uL样品加入200 uL酸液,充分混匀准确计时30 s,之后加入600 uL吖啶橙染色液充分混匀,利用NoveCyteTM型流式细胞仪检测每个精子细胞的前向角散射(FSC)和侧向角散射(SSC),用一波长为520 mm的带过滤器检测FITC荧光信号(BL1),另一波长大于610 mm的带过滤器检测PI(BL3)。
2.2.5 猪精子抗氧化水平检测
精子的抗氧化水平测定包括4部分,分别是:总抗氧(T-AOC)水平、超氧化物歧化酶(SOD)活性、谷胱甘肽过氧化物酶(GSH-PX)、丙二醛(MDA)含量。采用试剂盒对这4部分进行测定,按照试剂盒说明书操作。
2.2.6 猪精子扫描和透射电镜超微结构观察
2.2.6.1 猪精子的扫描电镜
1)样品固定:取相同浓度、相同体积的鲜精和冻融后的冻精样品,用PBS缓冲液洗涤3次,洗涤后加入一定量的电镜固定液,4℃固定保存及运输。
2)后固定:使用0.1 M磷酸缓冲液(pH 7.4)将固定好的样品漂洗3次,每次15 min。使用0.1 M磷酸缓冲液(pH 7.4)配制1%锇酸溶液,室温避光固定1~2 h。使用0.1 M磷酸缓冲液(pH 7.4)漂洗3次,每次15 min。
3)脱 水:样 品 依 次 入30%→50%→70%→80%→90%→95%→100%的100%无水乙醇中脱水,每次15 min,乙酸异戊酯15 min。
4)干燥:将样本放入临界干燥仪内进行干燥。
5)导电处理:将处理好的样本紧贴于导电碳膜双面胶上放入离子溅射仪,样品进行喷金30 s左右。
6)上机观察:将处理好的样品放入扫描电镜样品台进行观察并进行图像采集。
2.2.6.2 猪精子的透射电镜
1)样品固定:取相同浓度、相同体积的鲜精和冻融后的冻精样品,用PBS缓冲液洗涤3次,洗涤后加入一定量的电镜固定液,4℃固定保存及运输。
2)后固定:使用0.1 M磷酸缓冲液(pH 7.4)配制1%锇酸溶液,室温避光固定2 h。0.1 M磷酸缓冲液(pH 7.4)漂洗3次,每次15 min。
3)室温脱水:样品依次入3 0%→5 0%→7 0%→8 0%→90%→95%→100%的100%无水乙醇上脱水,每次20 min,100%丙酮2次,每次15 min。
4)渗透包埋:将丙酮与812包埋剂按照1比1混匀,37℃ 2~4 h,丙酮与812包埋剂按照1比2混匀,37℃渗透过夜,纯812包埋剂37℃ 5~8 h。将纯812包埋剂倒入包埋板,将样品插入包埋板后37℃烤箱过夜。
5)聚合:包埋板放于60℃烤箱聚合48 h,取出树脂块备用。
6)超薄切片:将铜网于2%醋酸铀饱和无水乙醇溶液避光染色8 min,用70%无水乙醇清洗3次;将2.6%枸橼酸铅溶液避二氧化碳染色8 min;用超纯水清洗3次,用滤纸稍吸干。将铜网切片放入铜网盒内室温干燥过夜。
7)在透射电子显微镜下进行观察,对采集到的图像进行分析。
2.3 数据处理
使用Microsoft Excel软件对实验数据进行统计整理,使用Graph pad Prism 8软件对数据进行配对样本t检验分析差异显著性并作图显示差异分析。P>0.05用ns表示没有统计学差异;P<0.05用*表示有统计学差异;P<0.01用***表示极显著的统计学差异。
3 结果
3.1 低温保存对猪精子质膜的影响
流式细胞仪Annenxin V—PI双荧光染色法检测猪精子质膜完整率实验结果如图1所示。
由图1显示,在a区域,同对照组(99.24%)相比,实验组活的完整精子数量(71.30%)大幅度下降,两者差异显著(P<0.05)。同时实验组D区域死亡破损的精子数量(23.53%)同对照组相比(0.10%)出现大幅度提升,两者差异显著。结果表明,低温冷保存导致猪精子质膜破裂,精子内物质流出,死亡精子数量增多。目前对于这种损伤还不清楚是低温冷冻造成的还是冷冻后精子复苏环节造成的。

图1 流式细胞仪Annenxin V—PI双荧光染色法检测猪精子质膜完整率(A图对照组,B图实验组)
3.2 低温保存对猪精子顶体的影响
如图2所示,图2A是对照组的流式散点图,图2B是实验组的流式散点图,同对照组(70.13%)相比,实验组a区域活(11.33%)的顶体完整的精子数量大幅下降,两者差异显著(P<0.05)。同时,低温保存导致精子顶体破损的数量(b区域和c区域)大幅度上升,从对照组的15.83%升至实验组的82.54%差异显著(P<0.05)。低温冷冻保存对猪精子顶体破损严重,直接导致冻精在应用到实际生产中猪受精率低下。

图2 流式细胞仪FITC—PNA/PI双荧光染色法检测猪精子顶体完整率(A图对照组,B图实验组)
3.3 低温保存对猪精子核DNA完整性的影响
如图3显示,相比于对照组,低温保存对精子的精子核完整率差异不显著。Q2-1象限是正常精子区域;Q2-2是轻度DNA损伤的精子区域;Q2-4是重度DNA损伤的精子。通过对实验组和对照组Q2-1区域数据比较,实验组(94.33%)和对照组(96.29%)的精子核完整率差异不显著(P>0.05),这可能与精子核结构有关。猪精子核是由鱼精蛋白和DNA物质组成的,可以进行受精的成熟精子的精子核DNA是双链结构,鱼精蛋白与DNA通过二硫键(S=S)紧密结合在一起,形成精子核独特的致密结构,使其具有更加稳定的结构,DNA物质很难与核蛋白分离,这也使得DNA双链结构更加稳定。

图3 流式细胞仪AO荧光染色法检测猪精子核完整性的流式散点图(A图对照组,B图实验组)
3.4 低温保存对猪精子抗氧化能力的影响
使用5种抗氧化试剂盒对猪精子样品的各抗氧化水平进行检测,结果如图4所示。同对照组相比,低温保存导致猪精子的总抗氧能力(T-AOC)极显著降低(P<0.01),丙二醛(MDA)含量极显著升高(P<0.01),超氧化物歧化酶(SOD)活性显著降低(P<0.05),谷胱甘肽过氧化物酶(GSH-PX)活性显著降低(P<0.05);低温保存对猪精子过氧化氢酶(CAT)活性无显著性影响(P>0.05)。
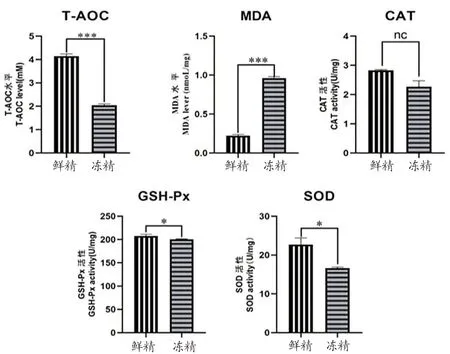
图4 对照组和实验组猪精子的5个不同抗氧化值的柱状图
总抗氧化能力(T-AOC)是指抗氧化分子以及抗氧化酶组成的精子总抗氧化水平,反映精子细胞的抗氧化系统的整体状态。精子细胞内含有多种抗氧化酶,包括谷胱甘肽过氧化物酶(GSH-PX)、超氧化物歧化酶(SOD)等。SOD能够催化活性氧生成过氧化氢,GSHPX可以催化还原型谷胱甘肽还原过氧化氢。低温保存导致精子细胞内抗氧化酶活性降低,精子细胞内有毒物质含量升高。
3.5 低温保存对猪精子超微结构的影响
3.5.1 低温保存对猪精子外部的影响
扫描电镜主要是对精子细胞的外部情况进行拍照分析,通过高分辨率电镜对样品表面变化拍照并且显示出来,如图5所示。
如图5A显示:对照组精子头部整体圆滑,精子头部上方顶体结构与精子头部质膜连接紧密、边界清晰、边缘整齐、精子头部表面无任何附着物,整体饱满。如图5B显示:实验组精子头部呈现一种坍塌状,精子头部的顶体明显破损,精子顶体整体呈现一种破损凹陷的状态,精子顶体内的相关顶体酶丢失;精子头部外的质膜整体呈现褶皱状,质膜粗糙并呈现泡状,质膜外附着一些蛋白物质,这些附着物是精子在低温保存时质膜破损产生的物质并附着在精子表面。
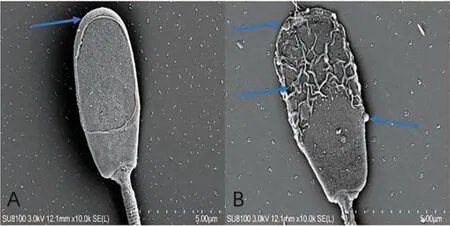
图5 精子样品的头部扫描电镜图(A图对照组,B图实验组)
精子样品的颈部连接处和尾部中段的扫描电镜图如图6所示。
如图6A和图6B显示:对照组精子的颈部连接处连接紧密光滑,精子尾部中段外周致纤维显示清晰,无附着物。如图6C和图6D显示:实验组精子颈部连接处出现明显的外表面部分破损(图6C),甚至整个颈部断裂(图6D),精子的尾部中段显示外表面粗糙模糊,附着有其他物质,外周纤维部分地方破损(图6C)。
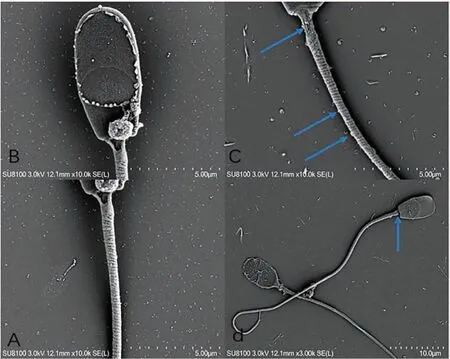
图6 精子样品的颈部连接处和尾部中段的扫描电镜图(A图和B图对照组,C图和D图实验组)
3.5.2 低温保存对猪精子内部的影响
透射电镜主要通过电子枪发射的电子束照射到样品上,透过样品的电子束将携带样品内部的结构信息,通过高分辨率透射电镜将精子样品内部细致的变化拍摄并显示出来,如图7所示。
如图7A显示:对照组精子的整个图,基本上无模糊状区域。如图7B显示:实验组精子的整个图上部分呈模糊状。

图7 精子样品整体透射电镜图(A图对照组,B图实验组)
精子样品头部透射电镜图如图8所示。
如图8A显示:对照组精子头部顶体与精子头部结合明显,顶体呈光滑的椭圆形,紧紧与头部质膜结合,顶体颜色深,头部的质膜结构完整清晰,无破损。如图8B显示:实验组精子顶体外膜明显呈囊泡状,部分精子的头部甚至顶体丢失,精子头部外的质膜也比较模糊,部分精子头部外的质膜呈破损状,精子顶体外膜与精子头部分离,部分精子头部质膜也呈现囊泡化。

图8 精子颈部连接处透射电镜图(A图对照组,B图实验组)
精子颈部连接处透射电镜图如图9所示。
如图9A显示:对照组精子颈部连接处连接完好,无肿胀破裂。如图9B显示:实验组精子精颈部连接处明显肿胀,部分连接处破损。
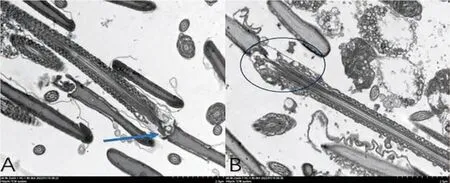
图9 精子颈部连接处透射电镜图(A图对照组,B图实验组)
精子尾部中段透射电镜图如图10所示。
如图10A显示:对照组精子尾部的9+2结构显示清晰,尾部中段的9+2结构外的线粒体鞘呈基本圆形显示清晰,分布均匀。如图10B显示:实验组精子尾部的9+2结构显示模糊,呈模糊状,9+2结构外的线粒体鞘呈模糊的椭圆形,分布不均匀,部分线粒体肿胀。
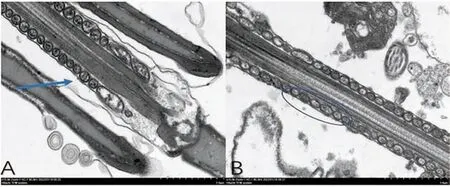
图10 精子尾部中段透射电镜图(A图对照组,B图实验组)
精子尾部与9+2结构和线粒体鞘透射电镜横切图如图11所示。
如图11显示:对照组(A、B、C)精子尾部显示清晰完好,无肿胀破裂,精子的9+2结构横切面图显示清晰,内部的微管分布均匀,精子尾部末端纤维鞘分布均匀光滑,微管外环抱的线粒体鞘颜色程度一致。实验组(D、E、F)精子尾部线粒体鞘有明显间隙,精子的9+2结构切面图显示模糊,有的微管之间连接在一起,部分出现紊乱,9+2结构外的线粒体鞘显示模糊,分布不均匀,精子尾部末端纤维鞘蜷缩,纤维鞘之间分布不均匀。

图11 精子尾部与9+2结构和线粒体鞘透射电镜横切图
4 结论
1)猪精子低温保存复苏后精子的质量显著降低,死亡精子数量显著上升,精子活率显著降低。精子抗氧化能力降低,其中精子总抗氧化能力(T-AOC)、丙二醛(MDA)含量、超氧化物歧化酶(SOD)活性、谷胱甘肽过氧化物酶(GSH-PX)活性差异显著。
2)冷冻-解冻后猪精子超微结构受到一定的损伤,损伤主要表现在精子顶体外膜肿胀呈囊泡状,顶体内物质流出,部分顶体完全脱落;精子质膜肿胀破裂,精子头部物质流出;精子颈部连接处外膜破损,部分颈部连接处完全断裂,造成精子头部和尾部分离;精子尾部中段线粒体鞘模糊,分布不均匀,部分线粒体肿胀,甚至破损,精子尾部末端纤维鞘蜷缩,纤维鞘和外周致密纤维之间分布不均匀,贯穿于尾部9+2结构的微管紊乱。
