DiGeorge综合征合并先天性心脏病患儿的围术期管理▲
2022-10-01潘焕媛易容松
潘焕媛 韩 咏 易容松 梁 彪
[柳州市妇幼保健院(广西科技大学附属妇产医院、儿童医院)1 儿内科,2 儿外科,广西柳州市 545001]
DiGeorge综合征也称为染色体22q11.2缺失综合征,是常染色体显性遗传病,以新发突变为主,国外文献报告,其患病率为1 ∶6 000~1 ∶3 000[1]。DiGeorge综合征的主要临床表现包括先天性心脏畸形、特殊面容、学习困难、免疫缺陷、异常低钙血症、肾功能异常等,还可以表现为智力异常、精神疾病、自闭症等。先天性心脏畸形是DiGeorge综合征最常见的表型之一,常见的畸形包括法洛四联症、室间隔缺损、主动脉弓离断、房间隔缺损、动脉干异常、动脉导管未闭等。DiGeorge综合征合并先天性心脏病患儿常需接受手术治疗,手术方式包括姑息性手术、心脏外科手术。但目前国内外尚无文献报告患儿接受此类手术治疗后的预后情况,而临床上发现,除心脏自身原因外,气道异常、低钙血症、免疫缺陷也会增加手术风险。我国关于DiGeorge综合征合并先天性心脏病患儿手术治疗效果及围手术期管理经验的报告较少。本研究回顾性分析8例DiGeorge综合征合并先天性心脏患儿的临床资料,以期为该病的围术期管理和治疗提供参考。
1 资料与方法
1.1 临床资料 回顾性分析2013年1月至2020年4月我院收治的8例DiGeorge综合征合并先天性心脏病患儿的临床资料,其中男童3例、女童5例,年龄2.9~96.3个月,中位年龄8.4个月,体重3.8~19.0 kg,中位体重5.4 g。纳入标准:(1)经外显子检测明确诊断为DiGeorge综合征;(2)经胸超声心动图明确诊断先天性心脏病;(3)年龄<18岁;(4)采用胸骨正中切口行心内直视手术治疗。排除标准:合并其他类型染色体病的先天性心脏病儿童。患儿家长均对本研究知情同意,本研究已经医院医学伦理委员会批准。
1.2 资料收集 收集患儿术前人口学资料、临床表型特征资料、围术期资料。人口学资料包括性别、年龄、身长/高、体重。临床表型特征资料包括面容特征、营养状况、生长发育情况,以及术前心脏彩色多普勒超声或心脏增强CT结果、心功能评估结果、肺动脉高压评估结果、胸片或肺部CT结果、血钙水平、免疫球蛋白水平等。围术期资料包括术中麻醉情况、气道管理情况、心脏起搏器使用情况、输血情况、低钙血症发生情况、需要干预的心律失常发生情况、难以止血或意外血管损伤的发生情况,以及术后血流动力学支持情况(如正性肌力药物使用时间等)、感染发生情况、机械通气时间、术后住院天数等。
1.3 诊断标准或定义 (1)DiGeorge综合征:抽取患儿及父母外周血标本,送至广州嘉检医学检测有限公司,采用临床外显子测序技术进行单核苷酸变异(single nucleotide variation,SNV)分析和拷贝数变异(copy number variation,CNV)分析。根据基因组DNA制备测序文库,将捕获探针(美国Roche NimbleGen)与目标区域序列进行特异性杂交,目标区域包括与在线《人类孟德尔遗传》(Online Mendelian Inheritance in Man,OMIM)相关的约含5 000个靶基因的全部外显子区及其上下游各个30 bp内含子区和已知致病的深度内含子区变异。随后在 Illumina NovaSeq 6000平台上进行二代测序,使用NextGENe软件将测序Reads与人的参考基因组(GRCh37/hg19)序列进行比对。SNV分析方法:通过变异的人群频率数据库(dbSNP、ExAC、gnomAD等)对高频变异进行过滤,应用SIFT、Polyphen2、MutationTaster、FATHMM等预测软件对变异的保守性和致病性进行预测。CNV分析方法:对编码序列平均覆盖度小于3×的基因组数据进行剔除,均一化分析出单(多)个外显子的拷贝数变化,参考DGV、DECIPHER和OMIM等多种数据库和已发表文献[2]对CNV的致病性进行评估。根据美国医学遗传学学会指南[2]对SNV和CNV的致病性进行分类。(2)先天性心脏病:根据经胸超声心动图结果明确诊断。(3)肺动脉高压:参考美国超声心动图协会指南[3]的标准明确诊断。(4)心功能:婴儿(0~12个月)的心功能评估参考改良ROSS心衰分级计分法[4],1岁以上患儿心功能评估参考美国纽约心脏病学会标准[4]。(5)延长通气定义:术后机械通气时间超过24 h。(6)延长性肌力支持定义:正性肌力药物使用时间延长至术后72 h以上。(7)感染定义:体温≥38.0 ℃,需使用抗生素治疗。(8)抗生素治疗指征:感染指标升高或血液、痰液、尿液等病原学检测结果阳性。(9)感染性并发症:主要包括呼吸系统感染、脑膜炎、泌尿系统感染、败血症、心肌炎等,以及有/无体温升高的孤立性胸骨伤口感染[5]。(10)低钙血症诊断标准:血红蛋白正常情况下,血清总钙离子≤2.13 mmol/L(8.5 mm/dL)。低钙性抽搐是指低钙血症导致神经肌肉兴奋性增高,出现全身惊厥、手足肌肉抽搐、喉痉挛等症状。
1.4 手术方法 所有患儿均完善术前准备,术前30 min使用头孢呋辛预防感染,在气管插管静脉复合全身麻醉下建立低流量体外循环,取胸骨正中切口进行心内直视手术。对于室间隔缺损患儿,采用自体心包补片连续缝合;对于房间隔缺损患儿,采用直接连续缝合或自体心包补片连续修补;对于法洛四联症患儿,采用右心房联合右心室流出道切口,加宽右心室流出道,补片闭合室间隔缺损;对于动脉导管未闭患儿,取经胸骨正中切口进行动脉导管结扎术。术中均使用体外膜肺氧合器监测血浆渗透压及血气电解质变化,术中注意保护传导束,避免损伤喉返神经、膈神经、胸导管,术中应用正性肌力药物改善循环,术后进行改良超滤,予呼吸机辅助通气。
1.5 统计学分析 采用SPSS 18.0软件进行统计学分析。符合正态分布的计量资料以(x±s)表示,不符合正态分布的计量资料以中位数表示,计数资料以例数和百分比表示。
2 结 果
2.1 患儿术前人口学资料和临床表型特征资料 8例DiGeorge综合征合并先天性心脏病患儿中,有4例术前存在不同程度低钙血症,其中1例存在低钙性抽搐,需静脉使用葡萄糖酸钙;有1例合并慢性心功能不全(心功能3级),于术前给予口服地高辛强心治疗;有2例中度肺动脉高压及1例重度肺动脉高压者,均于术前给予口服卡托普利治疗,以降低肺动脉阻力,减轻心脏后负荷。见表1。
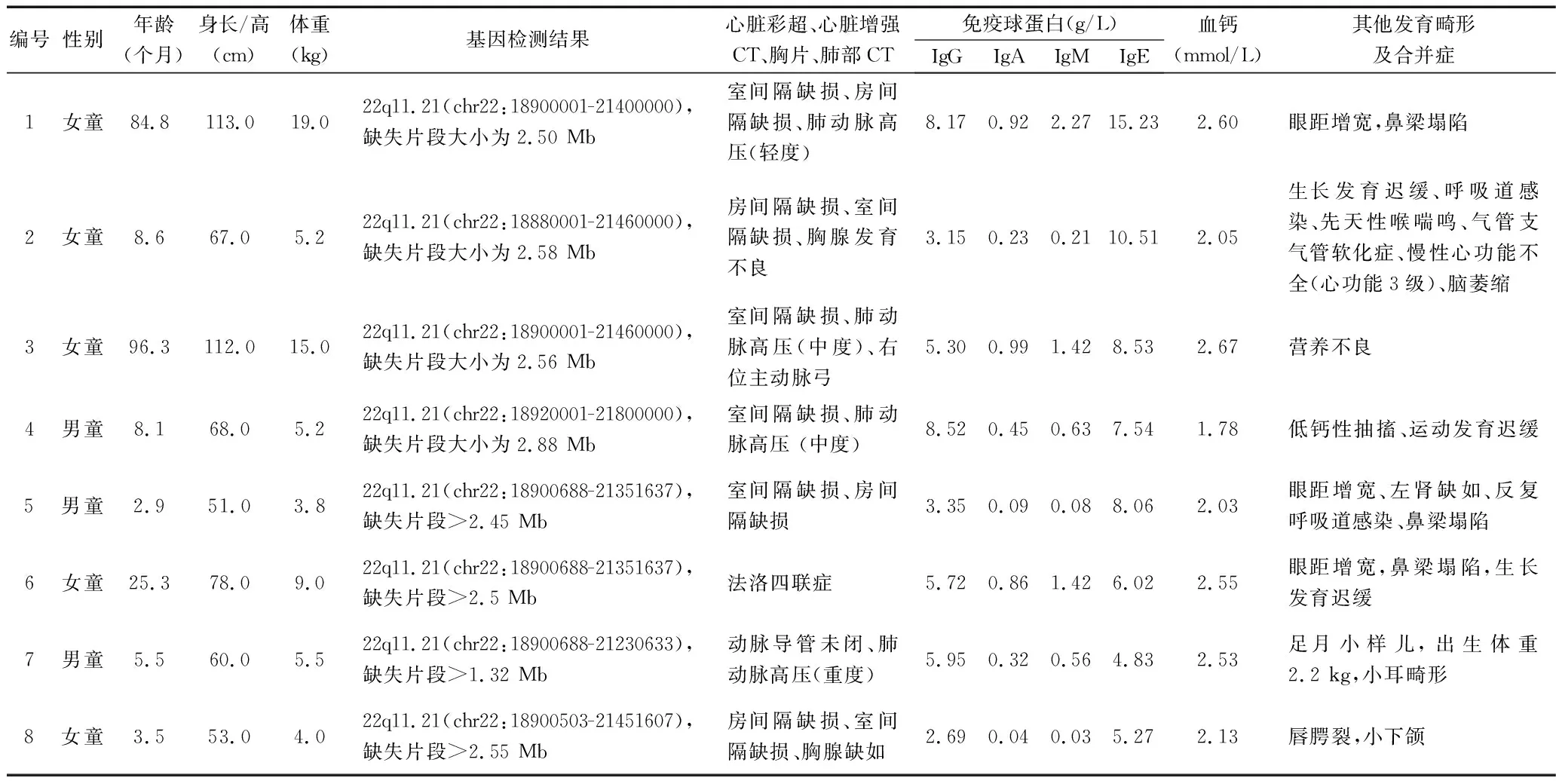
表1 8例DiGeorge综合征合并先天性心脏病患儿的术前人口学资料和临床表型特征资料
2.2 患儿围术期资料 8例DiGeorge综合征合并先天性心脏病患儿术中体外循环时间为37~95(58.26±18.10)min,主动脉阻断时间为25~65(35.12±13.06)min;全部患儿术中均输注去白细胞悬浮红细胞及冰冻血浆。4例(2、4、5、8号)患儿术中出现持续性低钙血症,给予其静脉注射葡萄糖酸钙注射液纠正低钙血症。所有患儿均无须植入心脏起搏器,术中未出现需要干预的心律失常及难以止血的意外血管损伤情况;开放主动脉阻断、恢复冠脉循环后,心脏自动复跳,均呈窦性心律。
8例DiGeorge综合征合并先天性心脏病患儿术后需要延长正性肌力药物的使用时间,正性肌力药物使用时间为5.0~61.0 d,中位时间为8.5 d;呼吸机使用时间为5.8~1 056.0 h,中位时间为108.3 h,有5例(2、4、5、7、8号)患儿需延长通气治疗时间,其中1例(2号)患儿合并先天性喉喘鸣、气管支气管软化症,表现为反复喘息、呼吸困难、喉头水肿、喉响,拔管后需再次气管插管2次,给予呼吸机辅助通气;有4例患儿(2、4、5、8号)因贫血、低血压需要进行输血治疗,其中2例(4、8号)患儿伴低钙血症,需静脉输注葡萄糖酸钙;有4例(2、4、5、8号)患儿出现感染,以呼吸道感染为主,使用抗生素时间为7.0~61.0 d,中位时间为13.0 d,其中3例(2、5、8号)患儿为免疫球蛋白水平偏低,需使用静注人免疫球蛋白。8例患儿均治愈出院,术后住院时间为10.0~71.0 d,中位时间为15.5 d,其中1例(2号)患儿术后住院时间超过30 d。
2.3 随访 随访时间截至2021年4月30日,随访时间为15.0~108.8个月,中位时间为80.0个月。8例患儿均无须再次手术,随诊复查心脏彩超提示无残余分流,无心包积液,心功能正常;有5例(2、4、5、6、8号)患儿出现不同程度生长发育迟缓;有3例(2、5、6号)患儿智力低下;有3例(2、5、8号)患儿反复感染,主要为呼吸道感染;有2例(4、8号)患儿需要口服补钙1年以上,其中有1例(4号)患儿继发癫痫,反复抽搐;有1例(5号)患儿左肾缺如,输尿管扩张。
3 讨 论
有研究表明,DiGeorge综合征患儿常合并喉、气管、支气管畸形,如喉软化、气管软化、支气管软化、喉噗等[6]。DiGeorge综合征患儿颅面畸形(如小颌、后颌和腭裂等),导致气道畸形,使插管难度增大,但本研究中8例患儿的气管插管过程较为顺利,原因可能为术前进行了充分的气道评估及插管前准备。本研究中1例患儿的术前纤维支气管镜检查结果提示先天性喉喘鸣、气管支气管软化症,需使用镇静剂和肌松剂,以避免患儿术中烦躁引起喘憋,增加插管难度。因此,术前应评估患儿气道情况,必要时行纤维支气管镜检查,有利于术中顺利完成气管插管。
DiGeorge综合征患儿通常伴有甲状旁腺发育不全,可导致低钙血症的发生。研究表明,DiGeorge综合征患儿术后低血钙症的发生率高达94.1%[7],且术后低血钙、血流动力学不稳定与癫痫发作有关[8-10]。韩宇等[11]对68例DiGeorge综合征合并法洛四联症患儿进行术后随访,发现低钙血症的发生率为63%,且低钙血症不易纠正,易发生低钙性抽搐。本研究中,有4例患儿术前、术中出现持续性低钙血症,有2例患儿术后出现低钙血症及血流动力学不稳定,均及时给予静脉输注葡萄糖酸钙纠正低钙血症;术后随访中1例患儿出现反复低钙性抽搐,继发癫痫,需使用维生素D、钙剂及抗癫痫药物治疗。因此,监测DiGeorge综合征患儿围术期的血钙水平具有非常重要的意义,可避免低钙血症相关的血流动力学不稳定及其引起的继发性癫痫。
Kyburz等[12]发现,有14%的接受心脏外科手术治疗的DiGeorge综合征患儿术后需要行气管切开术。Simsic等[13]比较了DiGeorge综合征患儿和无遗传相关性异常的新生儿心脏外科手术后的短期结局,发现DiGeorge综合征患儿的机械通气时间、重症监护室停留时间及住院时间均更长,且并发症发生率更高。另外,Yeoh等[5]发现,有18%的DiGeorge综合征合并先天性心脏病患儿术后需要给予延长性肌力支持。本研究中,5例患儿术后需要延长机械通气时间,其中1例合并有先天性喉喘鸣、气管支气管软化症的患儿撤机后反复出现呼吸困难,术后需再次气管插管,住院长达61 d,8例患儿均需给予延长性肌力支持,使用正性肌力药物最长时间为61 d,原因可能为:DiGeorge综合征患儿面部畸形、气道发育异常,导致气道管理难度增大,使其需要长时间的机械辅助通气,甚至需行气管切开或重新气管插管;DiGeorge综合征患儿的低钙血症易引起血流动力学不稳定,使其术后需要延长正性肌力药物的使用时间。
研究显示,DiGeorge综合征患儿常合并胸腺发育不良或胸腺缺陷,可出现不同程度的体液免疫缺陷,表现为IgM水平持续低于0.03 mg/dL、低丙种球蛋白血症和IgA缺乏症,术后表现为反复严重感染[14-16]。Marmon等[17]对10例接受心脏外科手术治疗的DiGeorge综合征新生儿进行研究,其中8例术后死亡,6例死因为败血症。Kyburz等[12]发现,在40例接受心脏外科手术治疗的DiGeorge综合征患儿中,18例患儿术后出现相关感染,包括气管炎、败血症、心内膜炎、肺炎、脑膜炎等。本研究中,有4例患儿术后出现感染,包括肺炎、上呼吸道感染、尿路感染等,经抗生素治疗后均好转,其中3例患儿免疫球蛋白水平降低,1例为胸腺发育不全患儿,1例为胸腺缺陷患儿,均需静注免疫球蛋白治疗。这提示在DiGeorge综合征合并先天性心脏病患儿行心脏外科手术前,了解其免疫功能将有助于指导围术期管理,包括抗感染及免疫支持治疗。
神经发育迟缓、学习障碍也是DiGeorge综合征患儿的主要临床表现[18]。研究显示,染色体22q11.2缺失的小鼠模型表现出记忆、学习和感觉运动方面的缺陷[19-20]。研究显示,染色体22q11.2缺失的患儿进行心脏手术后,其精神和心理选择发育指数得分、智商均低于无染色体22q11.2缺失的同龄儿童,且运动和智力发育延迟率更高[21-23]。本研究中,术后随访时有5例患儿出现不同程度的生长发育迟缓,3例患儿出现智力低下,与术前临床表现一致。这表明DiGeorge综合征患儿的神经发育迟缓、学习障碍不良结局主要与染色体异常相关,而可能与心脏外科手术的相关性较小。因此,除了关注DiGeorge综合征患儿的心脏情况外,也应该关注其智力发育情况,特别是术前应该与家长详细说明智力发育异常的可能性。
总之,DiGeorge综合征患儿常合并先天性心脏病,需要进行心脏外科手术治疗。DiGeorge综合征患儿的气道畸形、低钙血症、免疫功能低下等合并症可能导致围术期气道管理困难;顽固性低钙血症可造成血流动力学不稳定,导致正性肌力药使用时间延长;患儿存在免疫功能缺陷可能导致术后更高的感染率。尽管如此,在术后长期随访中,DiGeorge综合征合并先天性心脏病患儿均取得良好的手术效果,但仍需关注患儿的智力发育情况。
