肉鸡养殖场环境水体中沙门菌的耐药性与噬菌体的抑菌作用
2022-09-30李情园董艺博马翮斯章兴赜陈佳鑫高建帅苑方重
张 佳 , 李情园 , 董艺博 , 马翮斯 , 章兴赜 , 陈佳鑫 , 高建帅 , 苑方重
(河北农业大学动物医学院/中兽医学院 , 河北 保定 071001)
目前,在畜牧养殖业中由于抗生素的频繁使用与不合理利用,导致沙门菌的耐药性日益突出,而耐药沙门菌的严重扩散已经成为影响畜牧业与危害人类公共安全的重要问题[1-2]。在肉鸡养殖过程中,致病性沙门菌多重耐药问题更加严重[3-4]。通常情况下,养殖场内的耐药沙门菌可以通过污染的水体与土壤快速扩散进入环境中并长时间存在[4]。本试验通过分离纯化宿主为耐药沙门菌的噬菌体,寻求消除沙门菌耐药性的可能途径,为临床治疗与防治耐药沙门菌问题提供可能的方法。
1 材料与方法
1.1 细菌分离与鉴定 肠炎沙门菌标准株ATCC14028,由青岛绿谷商贸有限公司提供。试验中分离的耐药沙门菌株,来自5份水样,采集自河北省保定市易县某肉鸡养殖场周围池塘表层水体。将水样静置1 h,让水样自然沉淀,取上层清样10 μL,加入10 mL的RV肉汤中进行增菌培养,于37 ℃培养24 h,取菌液划线接种在SS琼脂培养基上,37 ℃培养24 h。取中心黑色的光滑圆形单个菌落,分别划线接种在SS、MacConkey和HE培养基上,37 ℃培养24 h。取SS培养基上生长特征类似沙门菌的菌株,进行生化试验鉴定,根据结果选择符合沙门菌特征的菌株11株,进行革兰染色观察并保存备用。
为进一步鉴定11株沙门菌,提取其DNA进行PCR扩增,扩增目的片段为肠炎沙门菌特异性DNA标记SdfⅠ,预计扩增片段长度约为333 bp,引物设计参考Tennant等[5]的报道,上游引物:5′-TGTGTTTTATCTGATGCAAGAGG-3′;下游引物:5′-CGTTCTTCTGGTACTTACGATGAC-3′。将本试验分离的沙门菌株分别编号,按顺序暂定编号为Sal-1、Sal-2…Sal-11。
1.2 噬菌体分离增殖与计数 准备SM缓冲液:NaCl 5.8 g,MgSO4·7H2O 2 g,Tris 6 g,2%明胶5 mL,加双蒸水800 mL溶解,调节至pH=7.5,加双蒸水定容至1 L,经高压灭菌后室温放置备用。
废水中噬菌体的分离与纯化采用Luis等[6]报道的方法,并略做调整。将分离细菌的同一批水样,于4 ℃、6 100 r/min离心10 min,取上清液使用0.22 μm 细菌滤器过滤,滤液于4 ℃保存备用。取100 μL上述滤液,加入1 mL预培养的沙门菌液体培养基中,与3 mL预热的上层培养基(含0.4%琼脂)混合,然后均匀覆盖在SS平板培养基上,37 ℃培养24 h。检查噬菌体在细菌培养基上形成的噬菌斑,挑取形状清晰的噬菌斑,混溶入SM缓冲液中;上述过程重复3次,然后将噬菌体液于4 ℃保存备用。
噬菌体计数方法采用Abiyad等[7]报道的方法。取噬菌体保存液,使用SM缓冲液10倍梯度稀释,形成10-1~10-8浓度梯度,每个稀释梯度取10 μL分别点在沙门菌上层培养基上,37 ℃培养24 h,计数培养基上各梯度浓度的噬菌体斑,若噬菌体生长密度大,则选择下一浓度梯度计数。
1.3 沙门菌株药敏试验 准备药敏纸片,包括氨苄西林(AMP)、氧氟沙星(OFX)、阿莫西林(AMX)、头孢噻肟(CTX)、恩诺沙星(ENR)、氟苯尼考(FFC)、左氧氟沙星(LEV)、链霉素(S)、林可-壮观霉素(LS)和磺胺异噁唑(SF)等。将分离的各株沙门菌和标准株菌液各1 mL,与3 mL预热的上层培养基(含0.4%琼脂)混合,然后均匀覆盖在SS平板培养基上,待上层培养基凝固后,将选取的药敏纸片轻贴在培养基表面,37 ℃培养24 h,测量抑菌环直径,按照美国临床实验室标准化协会(Clinical and Laboratory Standards Institute,CLSI)标准(m100-s20)判断药物敏感性:抑菌环直径(φ)≥18 mm为敏感(S),φ≤14 mm为耐药(R)。
1.4 噬菌体感染复数(Multiplicity of infection,MOI)与细菌生长曲线 将营养琼脂NA(成分:蛋白胨10 g,牛肉粉3 g,氯化钠5 g,琼脂15 g,pH 7.4,加水至1 L)高压灭菌,冷却至60 ℃左右,加入96孔细胞培养板,每孔加琼脂100 μL,冷凝后备用。
根据药敏试验结果,选择多重耐药菌株Sal-4进行噬菌体抑菌试验。将噬菌体加入过夜培养的Sal-4菌液中,并分别稀释成不同浓度,使最终MOI为10∶1、1∶1、1∶10、1∶100,分别取10 μL细菌与噬菌体的混合液加入96孔板琼脂培养基上,37 ℃静置培养,使用酶标仪测量各孔OD值,每隔6 h测量1次,连续24 h。
1.5 噬菌体对沙门菌耐药性的影响 根据噬菌体计数与MOI选择结果,将噬菌体稀释,加入1 mL 过夜培养的Sal-4菌液中,使最终MOI为1∶10,重复1.3药敏试验,并测量抑菌环直径。判定方法同1.3。
1.6 动物试验 将1.2纯化分离的噬菌体稀释至浓度为1×108噬菌斑形成单位(Plaques forming unit,PFU)备用。将40只21日龄小鼠随机分为4个组,每组10只,选择沙门菌Sal-4作为试验感染菌株,具体分组和处理见表1。
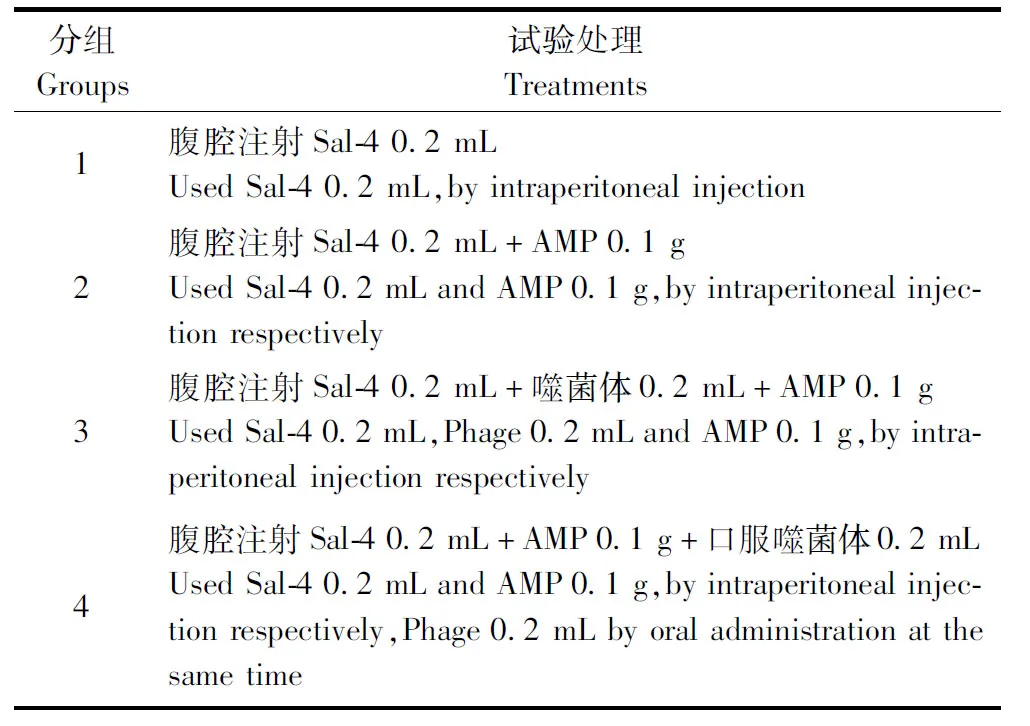
表1 试验分组和处理Table 1 Experimental groups and treatments(n=10)
2 结果
2.1 细菌分离和鉴定 本试验成功分离出沙门菌11株,按顺序分别编号,暂定编号为Sal-1~Sal-11。针对生化试验初步鉴定的11株沙门菌,进行SdfⅠ基因PCR扩增,所有菌株均获得了明亮的DNA条带,片段长度约为333 bp,部分沙门菌分离株的凝胶电泳结果见图1。
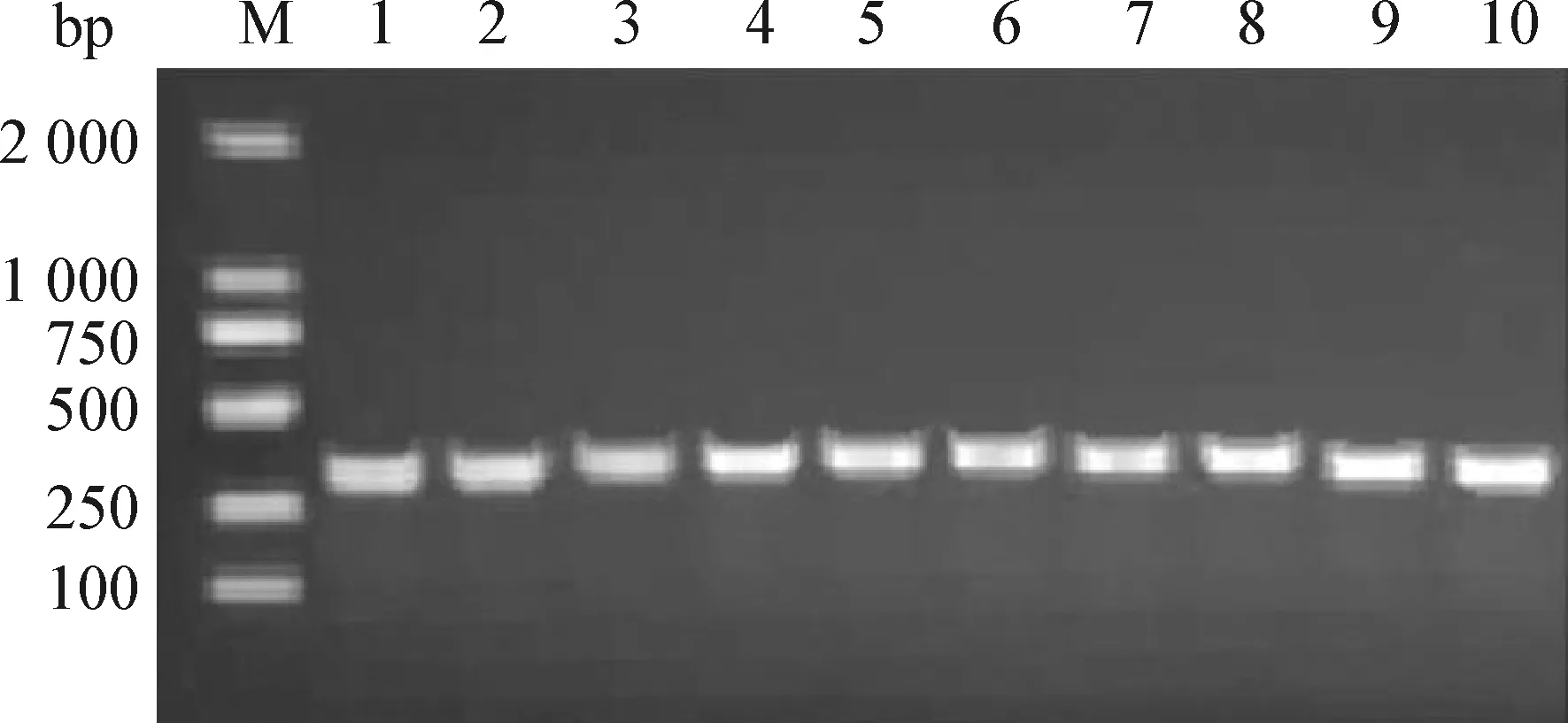
图1 部分肠炎沙门菌分离株Sdf Ⅰ基因的PCR扩增Fig.1 PCR amplification of Sdf Ⅰ gene in some Salmonella enteritis isolatesM:DL-2 000 DNA相对分子质量标准; 1:沙门菌标准株ATCC14028; 2~10:沙门菌分离菌株Sal-1~Sal-9M:DL-2 000 DNA Marker; 1:Salmonella standard strain ATCC14028; 2-10:Salmonella isolates Sal-1-Sal-9
2.2 噬菌体分离增殖与计数 试验中成功分离到宿主为沙门菌的噬菌体毒株,经过噬菌体计数,确定其浓度为3.0×1011PFU。
2.3 沙门菌抗生素耐药分析 使用AMP等10种常用抗生素,针对试验中分离到的11株耐药性沙门菌进行药敏试验,结果显示,其中4株对1种抗生素耐药,2株对2种抗生素耐药,2株对3种抗生素耐药,2株对4种抗生素耐药,1株对6种抗生素耐药(表2)。
由表2结果可知,本试验分离的11株沙门菌多重耐药率为63.64%(7/11)。用于检测的抗生素中,沙门菌株对氨苄西林耐药比例最高(81.82%,9/11),其次为阿莫西林(63.64%,7/11)、链霉素(45.46%,5/11)。头孢噻肟、恩诺沙星、氟苯尼考、林可-壮观霉素和磺胺异噁唑对本试验分离的沙门菌有较好的抑菌效果,其中林可-壮观霉素和磺胺异噁唑对所有菌株均有抑制作用,恩诺沙星和氟苯尼考对分离菌株均呈现高度敏感(但恩诺沙星对Sal-4、Sal-7,氟苯尼考对Sal-4无抑制作用)。试验分离的11株沙门菌中,编号为Sal-4的菌株,对包括氨苄西林、阿莫西林、恩诺沙星、氟苯尼考、头孢噻肟和链霉素在内的6种抗生素明显耐药。
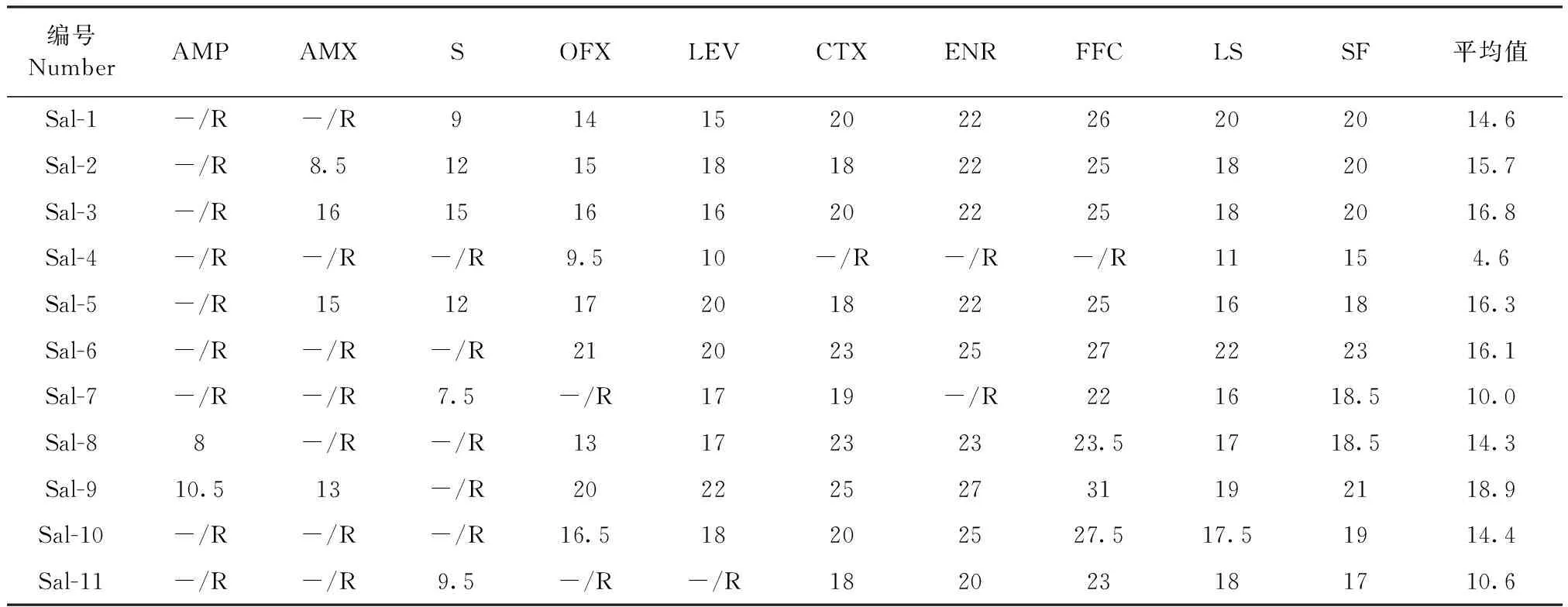
表2 沙门菌药敏试验结果(抑菌环直径φ=mm)Table 2 Results of drug sensitivity test of Salmonella(Diameter of bacteria inhibiting zone,φ=mm)
2.4 噬菌体MOI与细菌生长曲线 根据细菌耐药结果(表2),Sal-4菌株表现多重耐药,因而选择Sal-4作为后续试验菌株,进行噬菌体试验。如图2所示,当噬菌体存在时,Sal-4数量增长缓慢,在MOI分别为1∶1、1∶10和1∶100时细菌增殖趋势无明显差异;但在MOI为10∶1时,细菌增殖明显滞后,此条件下的细菌生长情况不符合做后续药敏试验和动物试验的要求。对比MOI为1∶1、1∶10、1∶100时细菌的生长情况,细菌在MOI为1∶10时,最符合细菌增殖滞后且满足药敏试验和动物试验条件,因此,后续试验中选择MOI为1∶10进行。
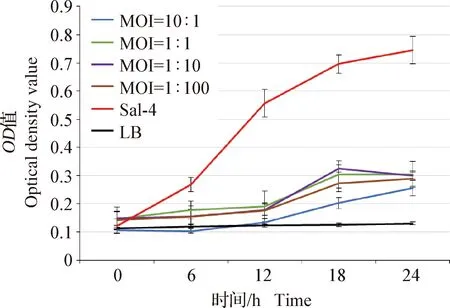
图2 不同MOI下Sal-4生长曲线Fig.2 Growth curve of Sal-4 under different MOI
2.5 噬菌体对沙门菌耐药性的影响 将试验分离的噬菌体与多重耐药沙门菌Sal-4共同培养后,进行药敏试验,结果如表3所示,与未经噬菌体处理的Sal-4菌株相比,处理后细菌对抗生素敏感性增加,表现为抗生素抑菌环直径增加。
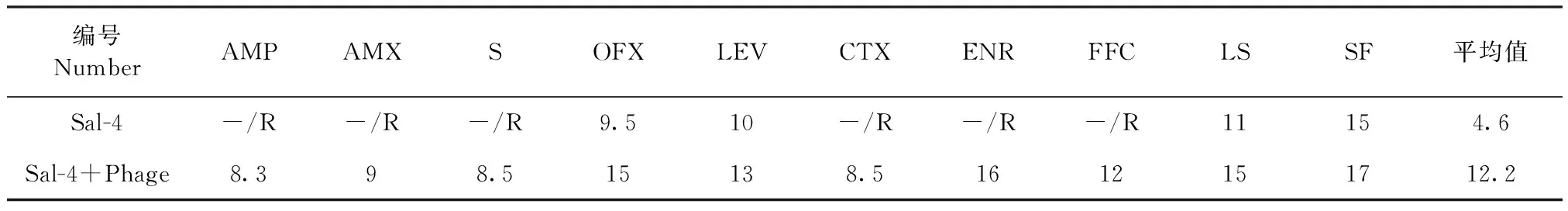
表3 噬菌体作用后Sal-4药敏试验结果(抑菌环直径φ=mm)Table 3 Results of drug sensitivity test of Salmonella Sal-4 treated by phage(Diameter of bacteria inhibiting zone,φ=mm)
2.6 动物试验 结果如表4所示,广谱耐药沙门菌Sal-4对试验小鼠的致死率为90%(组1),使用AMP单独治疗时,小鼠死亡率为70%(组2),与组1无明显差异(P>0.05);单独使用噬菌体治疗Sal-4感染的小鼠(组 3),小鼠死亡率明显下降,与组2比较差异极显著(P<0.01),表明噬菌体可以抑制Sal-4对试验小鼠的损伤;在应用噬菌体和AMP后(组4),小鼠死亡率下降至20%,说明所分离的噬菌体Phage-1可以增强抗生素对Sal-4的抑制作用。

表4 Phage与AMP对Sal-4攻毒小鼠的影响Table 4 The effect of Phage and AMP on mice infected by Sal-4 (n=10)
3 讨论
沙门菌特别是肠炎沙门菌,是最重要的食源性病原菌,常与禽类产品的污染有关。沙门菌每年在全球范围内造成约9 300万胃肠炎病例和155 000人死亡[8]。抗菌治疗是治疗沙门菌感染的首选方法;然而,由于抗生素在人体医药和动物生产中的滥用,抗菌药物的耐药性已成为世界性难题[9]。目前,源于畜牧业的耐药微生物对环境和人类健康构成了严重挑战。因此,弄清这些遗传因子转化为病原菌的来源和机制,不仅对减少治疗中的感染,而且对防止微生物耐药性的威胁具有重要意义[10]。抗生素多重药耐药(多重药耐药、极端耐药和泛耐药)是由适应性进化控制的,在抗生素胁迫条件下,多重药耐药的病原菌克隆可以成为优势菌[11-12]。
有研究表明,对取自环境的水样进行细菌分离和耐药性分析,可以方便准确的评估和检测某一地区的细菌耐药及耐药基因进化情况,是一种高效的病原菌检测方式[13]。本试验在对肉鸡养殖场周围水体取样后,经过对水样进行细菌分离培养,分离并鉴定出11株沙门菌,通过药敏试验评估所分离沙门菌的耐药性;此外,从同一水样中分离噬菌体,选取不同感染复数(MOI)的噬菌体单独应用,以及与3种耐药抗生素联合应用,检测噬菌体及其与抗生素联合应用时对耐药沙门菌的抑制作用。结果显示,自养殖场周围水体中分离的11株沙门菌均对常用抗生素存在耐药现象,并且多重耐药率高达63.64%(7/11)。由于噬菌体的普遍存在性、宿主特异性和无害性,可以与食物一起口服,同时噬菌体疗法作为一种治疗细菌感染的替代疗法被广泛研究,特别是针对抗生素耐药细菌的治疗使用,具有很大的应用潜力[10]。本试验结果还显示,在MOI为1∶10时,噬菌体对沙门菌的抑制效果最好;噬菌体与抗生素联合应用时,可以明显降低耐药沙门菌对抗生素的耐药性,试验选择的耐药沙门菌Sal-4分离株,在噬菌体作用下,对抗生素的敏感性显著增加。动物试验结果显示,同时使用噬菌体与氨苄青霉素治疗沙门菌感染,小鼠死亡率极显著下降(P<0.01),说明所分离的噬菌体Phage-1可以显著降低Sal-4对抗生素的耐药作用。
