基于ISSR 和RAPD 标记的太子参种质遗传多样性研究
2022-09-30陈美霞李萍萍叶祖云
史 辉,陈美霞,李萍萍,叶祖云
(1. 宁德师范学院 生命科学学院,福建 宁德 352100;2. 福建省特色药用植物工程技术研究中心,福建 宁德 352100)
太子参(Pseudostellaria heterophylla)为石竹科多年生草本植物,以块根入药,是我国传统中药,具益气健脾、生津润肺之功效[1]。太子参药用成分主要有多糖、皂甙、氨基酸、环肽等,主要分布于我国福建、江苏、安徽、贵州、山东、湖南等省[2]。太子参的品种选育工作滞后,缺乏规范化的引种和交流,使现有栽培群体混乱,内在质量和药材产量参差不齐[3]。因此,对太子参种源进行遗传分析和鉴定尤为重要。
简单重复序列区间多态性(ISSR)和随机扩增多态性(RAPD)标记具有操作简单和多态性高等特点,且不需要预先知道研究材料的基因组信息[4-5]。现已广泛应用于植物遗传多样性分析[6-9]、品种鉴定[10-11]、亲缘关系分析[12]和辅助育种[13]等工作。已有研究表明,太子参种质资源具有较高的遗传多样性[3,14],但该结论是基于单一分子标记的研究结果。单一分子标记检测多态性信息少,会使各项遗传参数产生偏差,不能全面揭示物种的遗传多样性[15]。ISSR 可以扩增基因组的内含子区域[16],RAPD 可以同时扩增大量位点[17],2 种标记的组合可以更高程度地覆盖基因组。目前,综合多种分子标记对太子参进行遗传分析的研究未见报道。因此,拟采用多态性丰富的ISSR和RAPD 2种标记技术分析不同产地的10个太子参种质的遗传多样性和亲缘关系,以克服单一分子标记对种质遗传分析存在误差的缺点,为太子参种质资源鉴定、科学引种及合理开发利用提供依据。
1 材料和方法
1.1 试验材料
1.1.1 植物材料 供试材料为从国内主要产地收集的10 个太子参种质(表1),种植保存于福建省柘荣县英山乡凤洋太子参良种繁育基地资源圃。经宁德师范学院叶祖云教授鉴定,10个太子参种质均为石竹科太子参。采摘新鲜幼嫩叶,采用康为世纪生物科技有限公司植物基因组提取试剂盒提取各种质的基因组DNA。

表1 太子参名称及来源Tab.1 Name and source of Pseudostellaria heterophylla
1.1.2 试剂 引物由上海捷瑞生物工程有限公司合成;rTaq、DM2000 Marker、dNTP、植物基因组提取试剂盒均购自康为世纪生物科技有限公司;琼脂糖为西班牙Biowest进口。
1.1.3 仪器 试验仪器包括PCR 扩增仪(美国Biometra C-412)、凝胶成像系统(美国Bio-rad GelDoc EZ)、超微量核酸蛋白测定仪(美国ACTGene Nanodrop 2000)、高速冷冻离心机(德国SIGMA 3-30K)、电泳仪(北京六一DYY-10C型)、超纯水仪(美国MILLI-Q)、制冰机(美国Scotsman AF100-AS)、微量移液器(法国Gilson Ppetman 系列)。
1.2 试验方法
1.2.1 太子参ISSR、RAPD 引物筛选 在前期建立的太子参ISSR和RAPD 反应体系[18-19]基础上,以ZS1为模板,分别用100 条ISSR 引物和21 条RAPD 引物进行PCR 扩增。从中筛选扩增清晰且扩增位点丰富的引物作为后续分析的引物。
1.2.2 太子参种质ISSR、RAPD 扩增 利用筛选出的适宜引物和前期建立的ISSR 和RAPD 反应体系[18-19],对不同产地的10 个太子参种质进行扩增。扩增产物经2%琼脂糖凝胶电泳检测,凝胶成像系统拍照记录数据。
1.2.3 数据分析 统计多态性条带并进行赋值,有带为1,无带为0。采用Popgene 32软件计算种质间的观测等位基因数(Observed number of alleles,Na)、有效等位基因数(Effective number of alleles,Ne)、Nei’s遗传多样性指数(Nei’s genetic diversity index,H)、Shannon’s 多态性指数(Shannon’s information index,I)。利用NTSYS-PC 2.1 软件分别计算基于RAPD 标记、ISSR 标记以及综合2 种标记的10 个太子参种质间的遗传相似系数(Genetic similarity coefficient,GS),并基于GS 分别绘制ISSR 标记聚类图、RAPD标记聚类图以及综合2种标记的聚类图。
2 结果与分析
2.1 太子参ISSR、RAPD引物筛选
用100 条ISSR 引 物(UBC801—UBC900)和21条RAPD 引 物 对ZS1 进 行 扩 增,部 分ISSR 和RAPD 引物的扩增结果如图1 所示。从100 条ISSR引物和21条RAPD引物中分别筛选出13、16条扩增位点多、条带明亮清晰的引物。13 条ISSR 引物分别为UBC807、UBC808、UBC811、UBC813、UBC818、UBC836、UBC841、UBC850、UBC866、UBC874、UBC876、UBC890、UBC891。16 条RAPD 引物分别为S1、S8、S10、S12、S13、S22、S24、S28、S30、S33、S90、S98、S145、S146、S147、S167。

图1 太子参ISSR和RAPD适宜引物筛选Fig.1 Screening of ISSR and RAPD primers suitable for Pseudostellaria heterophylla
2.2 太子参ISSR、RAPD标记扩增分析
用筛选出的13 条ISSR 引物和16 条RAPD 引物对10 个太子参种质进行PCR 扩增,扩增片段为250~3 000 bp(图2)。每个引物对大部分种质都表现出多态性,某些引物在特定种质上表现出特异性条带。统计结果(表2)表明,ISSR 和RAPD 引物在10 个太子参种质中分别获得101、89 个扩增位点,其中多态性位点数(Number of polymorphism loci,NPL)分别为58、63 个,多态性位点频率(Percentage of polymorphism loci,PPL)分别为57.37%、70.32%。基于ISSR标记的太子参种质间的Na为1.300 0~1.900 0,平均为1.573 7;Ne为1.143 9~1.723 6,平均为1.344 3;H 为0.215 0~0.450 0,平均为0.353 2;I 为0.368 9~0.642 0,平均为0.529 7。基于RAPD 标记的太子参种质间的Na 为1.250 0~2.000 0,平均为1.703 2;Ne为1.172 5~1.801 6,平均为1.418 1;H 为0.215 0~0.480 0,平均为0.354 9;I 为0.368 9~0.673 0,平均为0.532 1。综上,ISSR、RAPD 2 种标记都能有效地展示太子参种质间的遗传差异。

图2 ISSR引物UBC811(左)和RAPD引物S1(右)对太子参的扩增结果Fig.2 Amplification results of Pseudostellaria heterophylla by ISSR primer UBC811(left)and RAPD primer S1(right)
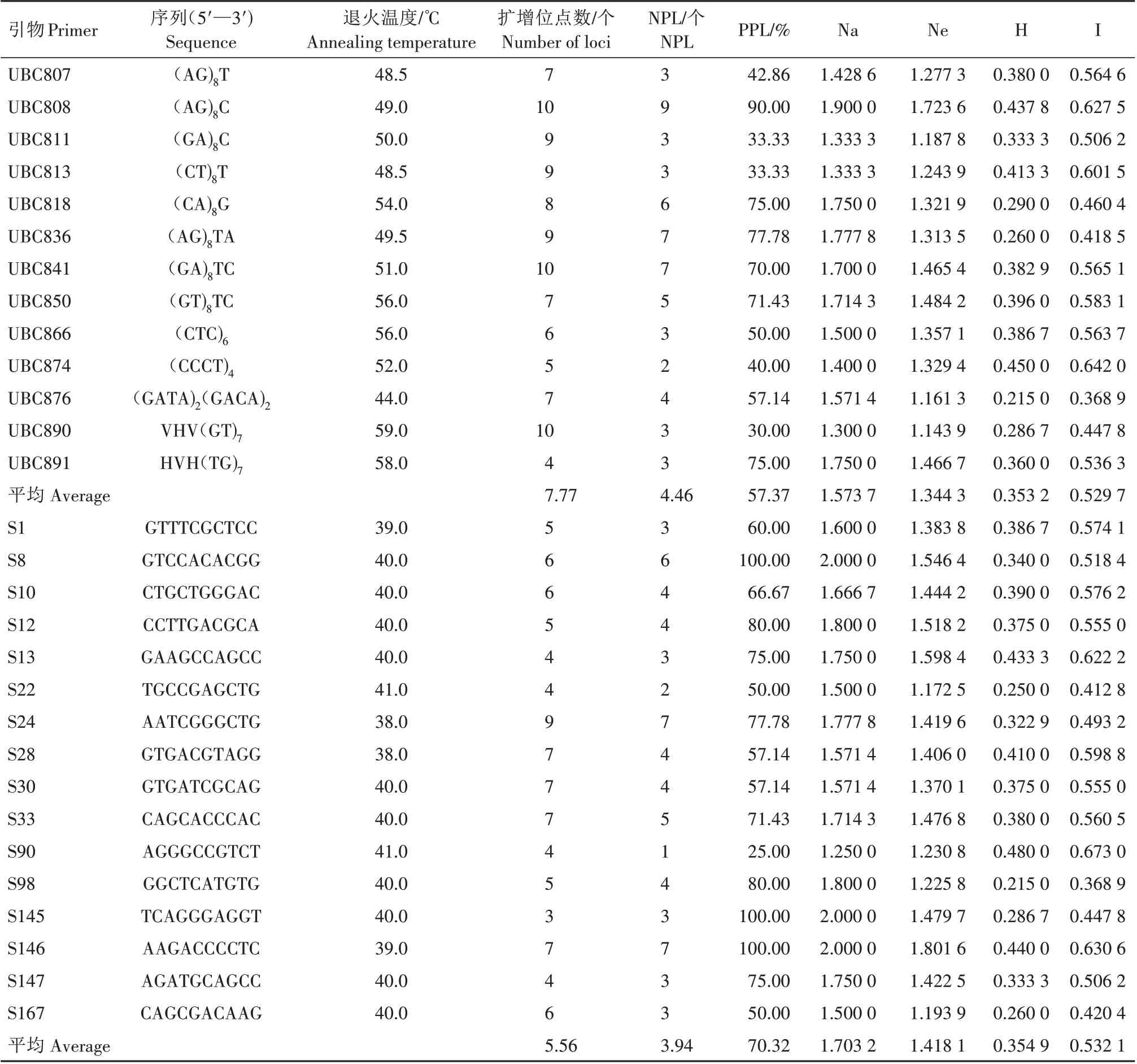
表2 太子参不同引物的扩增结果及多态性Tab.2 Amplification results and polymorphism of Pseudostellaria heterophylla by different primers
2.3 太子参种质ISSR、RAPD标记GS分析
对多态性条带进行统计并赋值,利用NTSYSPC 2.1 软件分别计算出基于ISSR 标记的太子参种质间的GS 为0.673~0.970(表3);基于RAPD 标记的GS 为0.517~0.944(表4);综 合2 种 标 记 的GS 为0.668~0.911(表5)。由表3—5 可知,如果2 个种质在ISSR 标记分析中表现出较高的GS,则它们在RAPD 标记和综合2 种标记分析中也表现出较高的GS,说明3 种分析结果具有较强的一致性。ISSR 与RAPD 标记的GS 相比,RAPD 标记的GS 整体上更低,综合2 种标记的GS 是基于2 种标记的综合统计结果,其GS介于两者之间。综合考量3种标记分析获取的GS,10 个太子参种质间存在着较高的遗传多样性。

表3 基于ISSR标记的太子参种质GSTab.3 GS of Pseudostellaria heterophylla germplasm based on ISSR markers

表4 基于RAPD标记的太子参种质GSTab.4 GS of Pseudostellaria heterophylla germplasm based on RAPD markers

表5 基于ISSR 和RAPD 标记的太子参种质GSTab.5 GS of Pseudostellaria heterophylla germplasm based on ISSR and RAPD markers
2.4 太子参种质ISSR、RAPD标记聚类分析
为客观地展示太子参不同种质间的GS 及其亲缘关系,利用NTSYS-PC 2.1 软件对10 个太子参种质分别绘制ISSR 标记聚类图、RAPD 标记聚类图以及综合2 种标记的聚类图。当GS 以0.780 为界线时,ISSR 标记聚类将10 个太子参种质划分为3 组:第1 组包括福建省柘荣县的3 个种质ZS1、ZS2 和ZS3 以及贵州省施秉县的G2、湖南省隆回县的HN和江苏省句容县的S1;贵州省施秉县的G1 单独聚为第2 组;第3 组包括安徽省宣城市的2 个种质A1和A2以及江苏省句容县的S2(图3)。RAPD标记聚类将10 个太子参种质分为4 组:第1 组包括福建省柘荣县的3 个种质ZS1、ZS2 和ZS3;第2 组包括安徽省宣城市的2个种质A1和A2、贵州省施秉县的2个种质G1 和G2 以及江苏省句容县的S2;湖南省隆回县的HN 单独聚为第3 组;江苏省句容县的S1 单独聚为第4 组(图4)。综合2 种标记的聚类将10 个太子参种质分为4组:第1组包括福建省柘荣县的3个种质ZS1、ZS2 和ZS3;第2 组包括安徽省宣城市的2个种质A1 和A2、贵州省施秉县的G1 以及江苏省句容县的S2;第3组包括贵州省施秉县的G2和湖南省隆回县的HN;江苏省句容县的S1 单独聚为第4组(图5)。综上,不管是单标记还是综合标记进行的聚类,其聚类结果均与太子参种质的地理分布有明显的相关性。

图3 基于ISSR标记的太子参种质聚类Fig.3 Dendrogram of Pseudostellaria heterophylla germplasm based on ISSR markers

图4 基于RAPD标记的太子参种质聚类Fig.4 Dendrogram of Pseudostellaria heterophylla germplasm based on RAPD markers

图5 基于ISSR和RAPD标记的太子参种质聚类Fig.5 Dendrogram of Pseudostellaria heterophylla germplasm based on ISSR and RAPD markers
3 结论与讨论
3.1 讨论
3.1.1 太 子 参ISSR、RAPD 引 物 筛 选 ISSR 和RAPD 均为随机标记,其特点是1 条引物在研究材料的基因组上可能没有结合位点或者有多个结合位点。没有结合位点,就没有扩增产物;有多个结合位点就有多种扩增产物。因此,在用ISSR 和RAPD 标记做遗传分析之前,必须先筛选适宜引物。扩增产物种类越多,说明该引物在基因组上检测的位点越多;扩增条带越清晰,说明该引物在基因组上的非特异性扩增越少。扩增条带清晰且扩增条带种类丰富的引物是适宜进行太子参遗传分析的引物[18,20]。筛选到的引物越多,在基因组上检测的位点就越多,对整个基因组的覆盖程度就越高,结果就越可靠。本研究共筛选出13 条ISSR 引物和16条RAPD 引物,并分别获得101、89 个扩增位点,数量较为丰富,能广泛地覆盖太子参基因组。
3.1.2 太子参ISSR、RAPD 标记扩增分析 不同引物在基因组上检测的位点不同,如果太子参种质的基因组在某些位点上具有较高的多态性,那么这些位点对应的引物就会表现出较高的PPL、Na、Ne、H和I 值;反之,则会表现出较低的PPL、Na、Ne、H 和I值。所以同一种标记的不同引物会表现出不同的PPL、Na、Ne、H和I值[21]。RAPD标记的PPL、Na、Ne、H 和I 的平均值略高于ISSR,说明整体上RAPD 比ISSR 标记具有更高的多态性。但从各个引物的情况 来 看,某 些ISSR 引 物(如UBC808、UBC841、UBC850和UBC891)也展示出较高的PPL、Na、Ne、H和I值。这是因为ISSR 和RAPD 标记检测的位点是不同的[16-17],基因组上一些多态性位点能被某些ISSR 引物检测到,而另一些多态性位点能被某些RAPD 引物检测到。因此,综合2 种标记则可以弥补彼此检测能力的不足。
3.1.3 太子参种质ISSR、RAPD 标记GS分析 种质间GS 的大小表示种质间亲缘关系的远近[22-24]。GS越大,种质间的遗传差异越小,亲缘关系越近;反之,GS 越小,种质间的遗传差异越大,亲缘关系越远[25]。与ISSR 标记相比,RAPD 标记的GS 整体上更低,更能展示太子参种质间的遗传差异。这与RAPD 标记的PPL、Na、Ne、H 和I 的平均值略高于ISSR 标记相吻合。但应具体到种质考量,对于某些种质(如G1、S2、A1、A2)而言,ISSR 比RAPD 标记更能展示其与其他种质间的区别。综上,应综合2 种标记计算种质间的GS 并对其进行聚类,以更客观地展示种质间的遗传差异。
3.1.4 太子参种质ISSR、RAPD 标记聚类分析综合2 种标记的聚类图显示,当GS 以0.780 为界线时,10个太子参种质被划分为4组。20世纪90年代初贵州省施秉县有从福建省柘荣县引种太子参的历史[14],但在本研究中,贵州省施秉县的2 个种质(G1 和G2)与福建省柘荣县的3 个种质(ZS1、ZS2 和ZS3)并没有聚在一组,可能太子参在长期的自然选择和人工选择下经过多代的无性繁殖积累了很多突变。第2 组中安徽省宣城市的2 个种质(A1 和A2)与江苏省句容县的栽培种质(S2)的GS 分别高达0.900、0.911,从地理距离来看,安徽省宣城市与江苏省句容县仅相距约90 km,近地引种的可能性很大[26]。江苏省句容县的2 个种质(S1 和S2)的GS仅为0.679,未聚在一组,推测野生种质S1 不是从安徽省宣城市引种。贵州省施秉县的G2 与湖南省隆回县的HN 虽然聚为第3 组,但GS 仅为0.789,两地间距离约360 km,是否互相引种还需进一步考证。
研究还发现,野生种质(HN 和S1)间以及它们与栽培种质(ZS1、ZS2、ZS3、G1、G2、S2、A1、A2)间的遗传差异都很大,GS都小于0.800(HN与S1的GS为0.737,HN 与栽培种质间的GS 为0.732~0.789,S1 与栽培种质间的GS 为0.679~0.779)。除贵州省施秉县 的2 个 种 质G1 和G2 遗 传 差 异 较 大(GS 仅 为0.768),没有聚在一组外,其他相同产地的栽培种质间的遗传差异都很小(GS 都大于0.800),并按产地分别聚在一组。说明聚类分析结果与太子参种质的地理分布有明显的相关性,但由于引种的原因,使聚类结果与太子参种质的地理分布并不完全吻合,该结果与前人的研究结果[14,27]基本一致。同时,也说明太子参经过长期相同生态环境下的人工栽培驯化,使相同地理分布的栽培种质间的遗传差异减小,降低了种质的遗传多样性。
3.1.5 随机标记的不足和后续研究展望 ISSR 和RAPD 均为随机标记,随机标记的缺点是引物可能会在材料的基因组上出现非特异性的结合,导致出现非特异性扩增。尽管在本研究中设置了多次重复,但对扩增条带进行统计时,不可避免会存在误差。按照不同的标准进行赋值,得出的GS 和聚类图均会有所不同。尽管前期已经对各个引物的扩增体系进行了优化,但仍存在少量非特异性扩增产生的弱带,对统计结果造成干扰。幸运的是RAPD标记引物异常丰富,且在本研究中RAPD 标记在太子参种质间展示出较高的多态性,后续可加大对RAPD 引物的筛选,并结合其他分子标记以及形态特性指标,以获得更准确的分析结果。本研究还发现,一些ISSR 和RAPD 引物对某些太子参种质扩增出特异性条带。后续可在本研究基础上,对种质特异性条带进行回收克隆、测序,再根据序列信息设计特异引物。实现由ISSR 或RAPD 标记向序列特异扩增区域(Sequence characterized amplified region,SCAR)标记的转化[28],以便更精确地鉴定太子参种质。
3.2 结论
本研究采用ISSR 和RAPD 标记对来自不同产地的10 个太子参种质进行遗传多样性研究。13 条ISSR 引物和16 条RAPD 引物分别获得101、89 个扩增位点。其中NPL 分别为58、63 个,PPL 分别为57.37%、70.32%。基于ISSR 标记的太子参种质间的Na、Ne、H 和I 的平均值分别为1.573 7、1.344 3、0.353 2、0.529 7。基于RAPD 标记的太子参种质间的Na、Ne、H 和I 的平均值分别为1.703 2、1.418 1、0.354 9、0.532 1。说明2 种标记都能有效地展示太子参种质间的遗传差异。因为单标记所能检测的位点数量有限,不能充分覆盖太子参基因组,使遗传分析产生偏差,为更客观地展示太子参种质间的遗传差异,应综合2 种标记计算太子参种质间的GS并聚类。综合2 种标记的太子参种质间的GS 为0.668~0.911。综合2 种标记的聚类分析结果表明,当GS为0.780时,10个太子参种质可聚为4组,聚类分析结果与太子参种质的地理分布有明显的相关性。综合2 种标记对太子参种质进行遗传分析,能更准确有效地鉴定太子参种质。可根据聚类结果推测种质的来源,为厘清太子参产地间的引种交流情况提供参考依据。
