茶多酚@沸石咪唑酯骨架材料/壳聚糖/海藻酸钠活性包装膜的制备及表征
2022-09-30王梦军年琳玉程抒劼曹崇江黄志刚
蔡 月,王梦军,年琳玉,程抒劼,曹崇江,*,黄志刚
(1.中国药科大学工学院,江苏 南京 211198;2.北京工商大学化学材料与工程学院,中国轻工业绿色塑料成型技术与质量评价重点实验室,北京 100048)
果蔬食品活性包装是果蔬食品产业的重要一环,合适的包装不仅可以提高客户的购买力,还可以使产品尽可能维持在高营养与品质状态下。初级包装是指直接包裹果蔬食品表面的涂层/薄膜。目前的初级包装主要由高分子聚合物如聚苯乙烯、聚氯乙烯、聚乙烯、聚对苯二甲酸乙二醇酯、聚丙烯等材料制成。一般来说,有效的初级包装有助于果蔬保藏,但只是防止化学、物理和微生物损伤的非功能性物理屏障。这类难降解的包装膜不仅对环境造成了严重污染,而且还会因为其中有害物质和化学物质与食品直接接触,造成食品的质量安全隐患和营养价值损失。通过在初级包装中加入可生物降解的材料、纳米颗粒、天然活性提取物以开发活性食品包装,能够同时保持食品的质量和营养,延长食品的保质期,并减少食品包装对环境造成的影响,是目前食品包装研究的大趋势。
天然聚合物如壳聚糖(chitosan,CS)、海藻酸钠(sodium alginate,SA)、淀粉、明胶等由于其天然来源和较高的降解特性而引起了相关研究者的广泛关注。已有许多研究将CS制备成涂膜、纳米微粒、复合膜等形式用于食品包装。而单独使用SA制备成的薄膜机械性能较差,通常使用其他生物聚合物如CS、纤维素等进行改性,来提高SA的机械性能和阻隔性能。
目前最重要的食品安全问题之一是由各种微生物(如病毒、细菌和真菌)引起的食源性疾病。除了微生物生长外,氧化是各种类型食物变质的重要原因,它会导致食物的营养和感官质量的损失,甚至可能导致有毒醛的形成。因此集抗氧化和抗菌功能于一体的活性包装是重要的研究方向。
茶多酚(tea polyphenols,TP)是一类从茶叶中提取的天然酚类物质的统称。因其独特的抗氧化和抗菌特性而受到医药和食品行业的广泛关注。然而,TP在加工和贮藏过程中非常不稳定,对温度、光照、pH值等环境因素非常敏感。因此,TP的利用需要有效的保护机制以维持其活性。
金属有机框架(metal-organic frameworks,MOFs)又称多孔配位聚合物(porous coordination polymers,PCPs),是由无机节点(金属离子/簇)与有机配体通过自组装的方式构成的一类多孔晶体材料,具有较高的热稳定性和机械稳定性。先前的研究表明,MOFs与生物分子之间的相互作用可以有效地影响生物分子的物理化学性质,从而改善生物分子的性能,例如MOFs可以作为载体封装酶、药物、纳米材料、天然活性产物等从而提高这些物质的稳定性,并达到缓释的效果。目前已经合成了数以万计的MOFs材料,沸石咪唑酯骨架材料(zeolitic imidazolate frameworks,ZIFs)是其中的一种。ZIFs是利用Zn或Co与咪唑配位自组装形成的一类金属有机骨架材料,其中,ZIF-8是一种典型的ZIFs材料,其通过Zn与2-甲基咪唑配位组装后具有方钠石拓扑结构,热稳定性可达420 ℃。已有文献报道,敏感型天然活性物质姜黄素被封装到纳米晶体ZIF-8后,其水溶性和稳定性都得到了改善。
由于目前鲜见将TP封装于MOFs材料中并制备成包装的应用,因此本实验以CS和SA为成膜基质,并以TP@ZIF-8纳米复合材料为功能性成分,通过层层组装的方式制备TP@ZIF-8/CS/SA复合膜。考察复合膜的形貌、阻隔性能、抗氧化性能以及抑菌性能,以期为果蔬保鲜提供新思路。
1 材料与方法
1.1 菌株、材料与试剂
革兰氏阳性菌(美国模式培养物集存库(American Type Culture Collection,ATCC)6538)和革兰氏阴性菌(ATCC 25922)ATCC。
CS(脱乙酰度≥95%,黏度100~200 MPa·s)上海麦克林生化科技有限公司;SA、TP 上海源叶生物科技有限公司;六水硝酸锌、2-甲基咪唑(均为分析纯) 阿拉丁试剂(上海)有限公司;冰醋酸、甘油(均为分析纯) 国药集团化学试剂有限公司。
1.2 仪器与设备
SU8020场发射扫描电子显微镜(field emission scanning electron microscope,SEM) 日本日立公司;UV-2600紫外-可见分光光度计、DTG-60热重分析仪(thermal gravimetric analyzer,TGA) 日本岛津公司;Nicolet iS50傅里叶变换红外光谱(Fourier transform infrared spectroscopy,FT-IR)仪、MULTISKAN GO酶标仪 美国赛默飞世尔科技有限公司;ME204电子天平 瑞士梅特勒托利多仪器有限公司;SW-CJ-1FD超净台、SPX-100B-Z生化培养箱上海博迅医疗生物仪器股份有限公司;THZ-C-1摇床苏州培英实验设备有限公司;TA-XT质构仪英国Stable Micro Systems公司;CS-280色差仪 杭州彩谱科技有限公司;DSC 204 F1差示扫描量热仪(differential scanning calorimeter,DSC) 德国耐驰仪器制造有限公司;数字千分尺 东莞市三量五金器械有限公司。
1.3 方法
1.3.1 ZIF-8的制备
ZIF-8的合成参考文献[21]的方法并稍作修改。首先将Zn(NO)溶液加入2-甲基咪唑溶液,混合溶液中Zn与2-甲基咪唑浓度比为1∶70,室温下剧烈搅拌10 min;然后10 000 r/min离心10 min收集白色粉末状沉淀,用纯水洗涤3 次后在60 ℃的烘箱中干燥24 h,得到ZIF-8备用,常温避光贮藏。
1.3.2 TP@ZIF-8的制备
分别将40 mL不同质量浓度(0.625、1.250、1.875、2.500、3.125、3.750 mg/mL)的TP溶液加入10 mL 0.197 mol/L Zn(NO)溶液中。超声搅拌30 min使其均匀分散后,在室温下快速加入40 mL 3.456 mol/L 2-甲基咪唑水溶液中,用顶置电动搅拌器剧烈搅拌20 min,转速为500 r/min,混合溶液中Zn与2-甲基咪唑的浓度比为1∶70。然后10 000 r/min离心10 min,收集上清液(后续用于测定TP质量浓度)和灰色粉末沉淀,用纯水洗涤沉淀3 次,然后在40 ℃的烘箱中干燥24 h,得到TP@ZIF-8后称量质量,常温避光贮藏备用。
1.3.3 TP@ZIF-8的表征
采用TGA对TP、ZIF-8、TP@ZIF-8(用3.125 mg/mL的TP溶液制备的样品)的热稳定性进行分析。加热速率为20 ℃/min,热分解温度为30~800 ℃。对2 mg样品在25~300 ℃范围内进行DSC分析,加热速率为20 ℃/min。利用Nicolet iS50 FT-IR仪分析TP、ZIF-8、TP@ZIF-8(用3.125 mg/mL的TP溶液制备的样品),扫描波数范围为300~4 000 cm。采用SU8020场发射SEM观察ZIF-8、TP@ZIF-8(用3.125 mg/mL的TP溶液制备的样品)微观形貌,加速电压15 kV。并进行复合材料的包封率、装载率、TP释放率、1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)自由基清除能力的测定。
1.3.3.1 装载率及包封率测定
根据文献[22]的方法进行装载率和包封率的测定并稍作修改。采用福林-酚法测定1.3.2节上清液中TP的质量浓度。取0.5 mL 0.25mol/L的福林-酚试剂与0.5 mL的各样品液充分混合并静置3 min,再加入1 mL质量分数15% NaCO溶液,静置30 min后,通过酶标仪在760 nm波长处测定吸光度。同时配制2 mg/mL的没食子酸标准溶液,并依次稀释至0.2、0.4、0.6、0.8、1.0 mg/mL,与福林-酚溶液和质量分数15% NaCO反应,在760 nm波长处测定吸光度,绘制标准曲线。TP的包封率及纳米粒子的装载率分别按式(1)、(2)计算。

式中:为加入TP质量/g;为将样品吸光度代入标准曲线中计算出的TP质量浓度/(mg/mL);为上清液的体积/mL;为1.3.2节最终干燥后的TP@ZIF-8质量/g。
1.3.3.2 缓释行为模拟及TP释放率测定
根据文献[22]的方法并稍作修改进行缓释行为的模拟及TP释放率的测定。将50 mg TP和TP@ZIF-8(用3.125 mg/mL的TP溶液制备的样品)分别溶于20 mL蒸馏水中,然后将混合溶液分别装入透析袋中,将2 个透析袋分别放入盛有400 mL pH 7.4、0.04 mol/L(后同)磷酸盐缓冲液(phosphate buffered saline,PBS)的烧杯中,并在37 ℃、120 r/min的水浴振荡器中持续振荡。分别在2、4、6、8、10、12、24、36 h从烧杯取出5 mL PBS(即缓释液),然后在两个烧杯中分别补充等体积新鲜PBS。将取出的PBS通过福林-酚法测定TP质量浓度。TP释放率按式(3)进行计算。
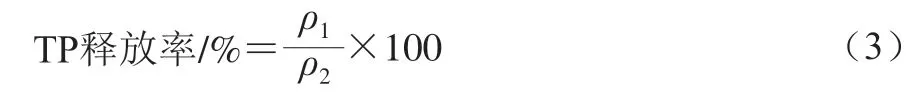
式中:、分别为TP缓释液、TP@ZIF-8缓释液的中TP质量浓度/(mg/mL)。
1.3.3.3 DPPH自由基清除能力的测定
DPPH自由基清除率实验根据文献[23]的方法并稍作修改。用50%(体积分数)乙醇配制5×10mol/L DPPH-乙醇溶液备用。分别将0.100 0 g TP、ZIF-8、TP@ZIF-8溶于1 mL蒸馏水中配制成样品溶液。分别向200 μL各样品溶液中加入200 μL上述DPPH-乙醇溶液,静置避光反应20 min后用酶标仪测定517 nm波长处的吸光度,以50%(体积分数)乙醇作为空白对照测定吸光度。DPPH自由基清除率按式(4)计算。
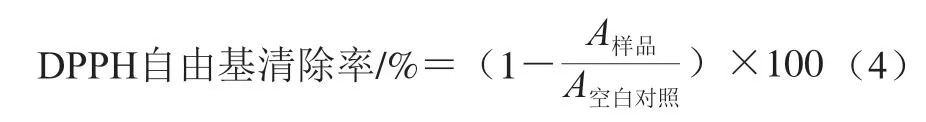
式中:为样品溶液与DPPH溶液的吸光度;为空白对照的吸光度。
1.3.4 TP@ZIF-8/CS/SA复合膜的制备
采用层层组装的方法制备CS/SA双层复合膜。首先在100 mL超纯水中加入1.0 g CS,然后加入0.50 mL冰醋酸(纯度≥99.5%)使其溶解,再加入0.4 g甘油作为增塑剂。CS溶解后,利用超声波消除泡沫,然后将CS溶液倒入25 cm×25 cm的模具中,在40 ℃烘箱中干燥4 h。之后将1.0 g SA加入100 mL超纯水,再加入0.4 g甘油作为增塑剂,搅拌溶解后50 Hz超声去除泡沫。再将SA溶液倒在CS膜表面,在40 ℃烘箱中干燥12 h,直到CS/SA复合膜完全干燥即得到CS/SA复合膜。
类似地,采用层层组装的方法制备TP@ZIF-8/CS/SA复合膜。首先,将100 mL CS溶液(质量浓度为0.01 g/mL)溶解后加入模具中干燥4 h,得到CS膜,然后分别在100 mL超纯水中加入0.010 0、0.025 0、0.050 0 g TP@ZIF-8纳米复合材料,50 Hz超声分散处理30 min,再向上述溶液中加入1.0 g SA和0.4 g甘油。待SA完全溶解后,将溶液倒在CS膜上,在40 ℃烘箱中干燥12 h,待TP@ZIF-8/CS/SA复合膜完全干燥,得到添加量分别为1%(质量分数,后同)、2.5%、5% TP@ZIF-8复合材料的TP@ZIF-8/CS/SA复合膜(以CS/SA复合膜作为添加量0%的TP@ZIF-8/CS/SA复合膜)。
1.3.5 TP@ZIF-8/CS/SA复合膜的表征
1.3.5.1 TP@ZIF-8/CS/SA复合膜的SEM表征
取TP@ZIF-8添加量分别为0%、5%的TP@ZIF-8/CS/SA复合膜样品参考1.3.3节方法采用SEM观察其微观形貌。
1.3.5.2 TP@ZIF-8/CS/SA复合膜的厚度、色泽测定
利用数字千分尺对复合膜的厚度进行测量。用CS-280色差仪测定复合膜的*(亮度)、*(红/绿度)值,以标准白板为背景,在每个膜表面随机选取10 个点进行测定。
1.3.5.3 TP@ZIF-8/CS/SA复合膜的热稳定性表征
参考1.3.3节方法,采用TGA和DSC对剪碎的薄膜样品的热稳定性进行分析。
1.3.5.4 TP@ZIF-8/CS/SA复合膜的FT-IR表征
取剪碎的TP@ZIF-8添加量为5%的TP@ZIF-8/CS/SA复合膜、SA固体粉末、CS固体粉末参考1.3.3节方法进行FT-IR分析。
1.3.5.5 TP@ZIF-8/CS/SA复合膜的穿刺强度
根据Kurek等的方法并稍作修改测定TP@ZIF-8/CS/SA复合膜的穿刺强度。首先,将复合膜切成长2.5 cm×2.5 cm的正方形,穿刺速率设置为50 mm/min,薄膜样品平展于夹具中并夹紧,测定穿刺强度,每组5 个平行。
1.3.5.6 TP@ZIF-8/CS/SA复合膜的氧气透过率
氧气透过率的测定参考文献[25]并稍作修改。用薄膜将装有脱氧剂的50 mL离心管密封,称量离心管初始质量后,放入盛有饱和氯化钡溶液(相对湿度85%)的干燥器中48 h。氧气透过率按式(5)进行计算。
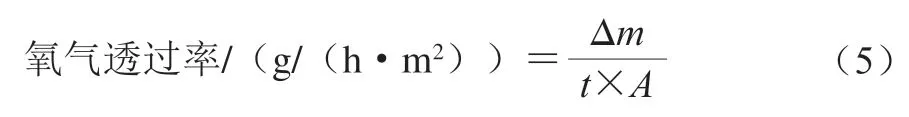
式中:Δ为离心管增加的质量/g;为测定时间/h;为离心管口的面积/m。
1.3.5.7 TP@ZIF-8/CS/SA复合膜的二氧化碳透过率
二氧化碳透过率参考文献[26]进行测定。在50 mL离心管中加入浓氢氧化钠溶液(10 mol/L),然后将薄膜固定在50 mL离心管的管口并称量质量/g,48 h后称量离心管的质量/g。二氧化碳透过率按式(6)进行计算。
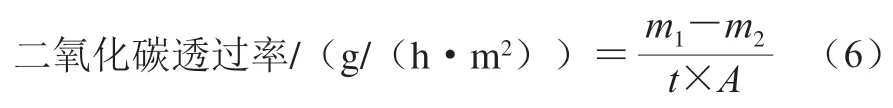
式中:为测定时间/h;为离心管口的面积/m。
1.3.5.8 透光率和不透明度
透光率是影响消费者对食品质量敏感度的重要因素,而不透明度是决定活性包装膜质量的重要因素。透光率和不透明度的测定参考文献[27]。将待测复合膜裁成50 mm×6 mm的长条,利用UV-2600紫外-可见分光光度计测定200~800 nm波长范围内的透光率以及600 nm波长处的吸光度,以空的比色皿作为空白对照。每个试样重复3 次,取平均值。透光率越大表明膜的透光性越强。膜不透明度按式(7)进行计算,数值越大表明试样的不透明度越高。
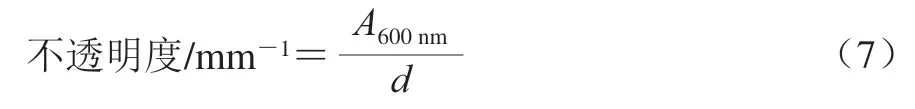
式中:为600 nm波长处的吸光度;为膜的厚度/mm。
1.3.6 TP@ZIF-8/CS/SA复合膜抑菌实验
以和为模型细菌验证TP@ZIF-8/CS/SA复合膜的抑菌效果。将贮藏于-80 ℃的菌种取出,置于37 ℃的恒温水浴锅中10 min,再分别取500 μL和菌种接种至200 mL新鲜LB液体培养基(含10 g/L胰蛋白胨、5 g/L酵母提取物、10 g/L NaCl,pH 7.0),在摇床中37 ℃培养24 h后10 000 r/min离心10 min,分别收集和菌体沉淀。加入生理盐水重悬细菌,调整菌体浓度为1×10CFU/mL。然后称取200 mg的不同复合膜,并将其剪碎,分别加入30 mL和菌液中,孵育12 h,以不添加复合膜的菌液作为对照。然后将上述处理的菌液稀释1 000 倍,取50 μL的菌液均匀涂布于平板上,在培养箱培养12 h后,用Image J软件进行计数,按式(8)计算抑菌率。
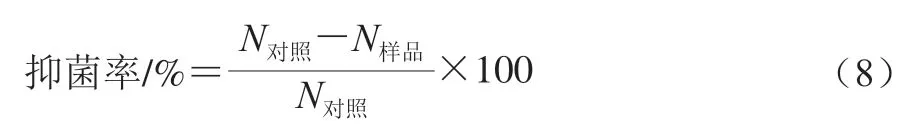
式中:为对照组平板上的菌落数/个;为添加复合膜样品组平板上的菌落数/个。
1.3.7 TP@ZIF-8/CS/SA复合膜抗氧化活性测定
TP@ZIF-8/CS/SA复合膜DPPH自由基清除率的测定参考1.3.3.3节方法并略作修改,将样品剪切成50 mm×50 mm的正方形,然后放入盛有100 mL 50%(体积分数)乙醇的烧杯中,溶解成透明的胶状体。然后通过抽滤系统获得洗脱液备用。将1.0 mL的洗脱液与2.0 mL的60 μmol/L DPPH-50%(体积分数)乙醇溶液混合制成DPPH测定液。将混合物置于室温(25 ℃)黑暗环境下孵育1 h。然后使用紫外-可见分光光度计测定混合溶液在517 nm波长处的吸光度。以50%(体积分数)乙醇作为空白对照。按式(4)计算DPPH自由基清除率。
2,2’-联氮-双-(3-乙基苯并噻唑啉-6-磺酸)(2,2’-azinobis(3-ethylbenzothiazoline-6-sulfonic acid),ABTS)阳离子自由基清除率测定参考文献[23]方法并稍作修改。将1.0 mL洗脱液和2.0 mL ABTS反应溶液混合,以50%乙醇作为空白对照,室温黑暗处反应1 h。用紫外-可见分光光度计测定混合溶液在734 nm波长处的吸光度。按式(9)计算ABTS阳离子自由基清除率。
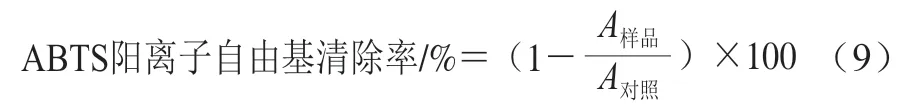
式中:为样品液体与ABTS反应液在静置避光条件下反应1 h后在734 nm波长处的吸光度;为空白对照的吸光度。
1.4 数据统计与分析
所有实验重复3 次,结果以平均值±标准差表示。采用SPSS 20.0软件进行单因素方差分析,采用邓肯检验进行显著性分析,<0.05表示差异显著。
2 结果与分析
2.1 TP@ZIF-8的形貌表征结果
首先通过一锅法合成了ZIF-8,通过类似的方法合成TP@ZIF-8纳米复合材料,即将TP分散到含有Zn和2-甲基咪唑的溶液中,Zn可与2-甲基咪唑中的N原子配位形成ZIF-8,ZIF-8直接包裹TP形成TP@ZIF-8纳米复合材料。ZIF-8和TP@ZIF-8在SEM下的微观形貌和粒径分布如图1所示。ZIF-8呈规则的十二面晶体,与管靖玮的研究结果一致;且ZIF-8大小较均一,平均粒径为(55.79±8.18)nm;添加TP后,TP@ZIF-8的尺寸增大,平均粒径为(82.79±11.95)nm,且TP@ZIF-8颗粒的表面较ZIF-8粗糙。


图1 ZIF-8和TP@ZIF-8的微观形貌(A)及粒径分布(B)Fig. 1 Microstructure (A) and particle size distribution (B) of ZIF-8 and TP@ZIF-8
2.2 TP@ZIF-8纳米复合材料的DPPH自由基清除能力
DPPH自由基清除能力是评价物质抗氧化能力的常用指标之一。由图2可知,随着TP@ZIF-8纳米复合材料中TP添加量的逐渐增加,TP@ZIF-8的DPPH自由基清除能力呈先升高后降低的趋势,当TP溶液的质量浓度为3.125 mg/mL时,TP@ZIF-8的DPPH自由基清除能力最高。TP@ZIF-8复合材料的DPPH自由基清除能力介于ZIF-8和TP之间。以上结果说明TP@ZIF-8具有优异的抗氧化能力,同时侧面证明TP@ZIF-8纳米复合材料合成成功。
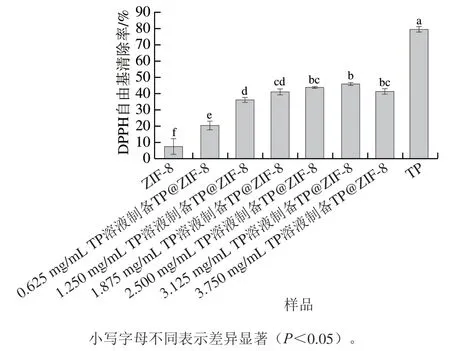
图2 TP@ZIF-8的DPPH自由基清除能力Fig. 2 DPPH radical scavenging capacity of TP@ZIF-8
2.3 TP@ZIF-8纳米复合材料的包封率及装载率
不同TP质量浓度下形成的TP@ZIF-8纳米材料的包封率和装载率如图3所示,当TP质量浓度逐渐增加时,包封率呈现出先增加后逐渐变缓的趋势,当TP质量浓度达到2.500 mg/mL时,包封率不再增加,原因可能是TP的—OH与Zn形成的配位键已达到饱和。而装载率与TP质量浓度呈正相关,原因可能是随着TP质量浓度的增加,TP@ZIF-8的产量增长缓慢,速率远不及TP质量浓度增加速率,因此装载率依次递增。
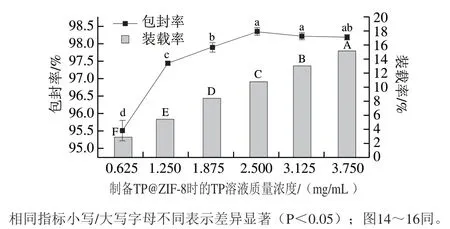
图3 不同质量浓度TP溶液制备TP@ZIF-8纳米材料的包封率和装载率Fig. 3 Encapsulation rates and loading rates of TP@ZIF-8 nanomaterials formed with different concentrations of tea polyphenol
2.4 TP@ZIF-8纳米复合材料的TP释放率
纯TP溶液和TP@ZIF-8溶液在37 ℃、pH 7.4的PBS中释放TP的效果如图4所示,纯TP溶液释放速率快,在透析6 h时释放率即达到22.40%,这可能是由于TP分子质量较低,因而在没有其他作用力的情况下便很快地扩散。而通过ZIF-8搭载的TP在透析开始的前2 h出现爆发释放,释放率达2.10%,然后释放速率逐渐变缓,在透析4 h及6 h时的释放率分别为2.67%和3.05%,之后释放率变化较小。说明ZIF-8载体可以实现TP的缓慢释放,达到延长TP释放时间的效果。TP@ZIF-8最初以近乎恒定的速率释放TP,该释放行为遵循零级动力学模型。随后是持续稳定的释放,这种行为可归因于初始爆发释放后CS纳米粒溶胀形成凝胶,其对TP的释放起控制作用。

图4 纯TP溶液和TP@ZIF-8纳米复合材料溶液的TP释放率Fig. 4 TP release rates of pure TP solution and TP@ZIF-8 nanocomposite solution
2.5 TP@ZIF-8纳米复合材料的FT-IR分析结果
ZIF-8、TP、TP@ZIF-8的FT-IR分析结果如图5所示。ZIF-8和TP@ZIF-8在600~1 500 cm之间都出现特征吸收峰,归因于咪唑环的振动。421 cm处的吸收峰归因于Zn-N振动。3 135 cm处的吸收峰归因于ZIF-8和TP@ZIF-8中不饱和烃C-H的轻度伸缩振动。ZIF-8中2 962 cm处的吸收峰归因于饱和烃的C-H(CH)反对称伸缩振动,2 966 cm处的吸收峰归因于TP@ZIF-8中饱和烃的反对称伸缩振动。与ZIF-8相比,在TP和TP@ZIF-8中可以观察到苯环的伸缩振动峰,TP的吸收峰位于1 629、1 610 cm处,TP@ZIF-8的吸收峰位于1 597、1 565 cm处,表明TP可通过自组装法封装到ZIF-8中。综上所述,在TP@ZIF-8中观察到ZIF-8和TP的特征峰,证明TP@ZIF-8合成成功。

图5 ZIF-8、TP、TP@ZIF-8的FT-IR图Fig. 5 FT-IR spectra of ZIF-8, TP and TP@ZIF-8
2.6 TP@ZIF-8纳米复合材料的热稳定性
通过TGA对制备材料的热稳定性进行分析,如图6所示,TP和TP@ZIF-8在200 ℃前质量都轻微降低。ZIF-8在300 ℃左右时出现第1个质量损失阶段,是由于孔外溶剂分子的失去。300~646 ℃是质量逐渐损失的阶段,几乎没有平台期,原因可能是ZIF-8的结构被破坏,ZIF-8的框架开始崩塌,说明其具有良好的热稳定性;而TP@ZIF-8在595 ℃开始分解,虽然与ZIF-8相比分解温度降低,但是总体上保留了ZIF-8较好的热稳定性。
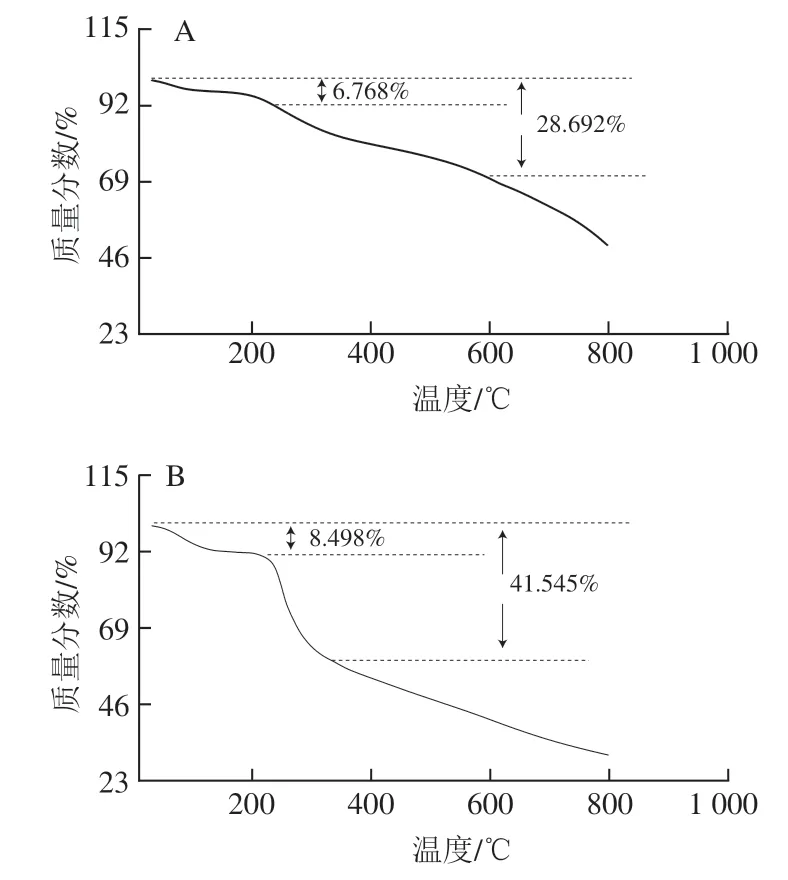
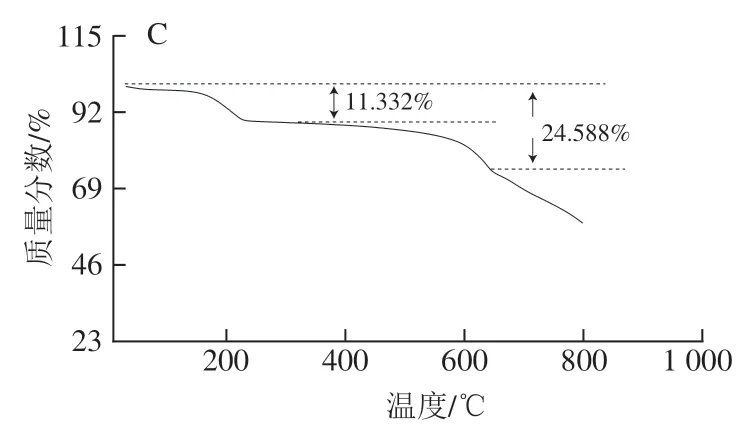
图6 ZIF-8(A)、TP(B)、TP@ZIF-8(C)的TGA曲线Fig. 6 TGA curves of ZIF-8 (A), TP (B) and TP@ZIF-8 (C) nanocomposite
2.7 TP@ZIF-8/CS/SA复合膜的形貌、色泽、不透明度、穿刺强度、透光率、FT-IR、TGA、DSC分析结果
薄膜的透光性影响消费者对食品的感官评价,由于TP@ZIF-8纳米复合材料呈现红灰色,因此,含有TP@ZIF-8纳米材料的复合膜亦呈现红灰色。由图7可知,不含有TP@ZIF-8纳米材料的CS/SA复合膜具有较高的透明度,而且随着TP@ZIF-8纳米材料添加量的增加,复合膜的透明度逐渐降低。图8A是TP@ZIF-8添加量分别为0%、5%时复合膜的表面形貌图,不含有TP@ZIF-8纳米材料的复合膜表面较为平滑,而TP@ZIF-8 纳米材料添加量为5%的复合膜表面变得粗糙。图8B为TP@ZIF-8添加量分别是0%、5%时复合膜的横截面图,可以看出复合膜明显的双层结构,两种复合膜之间的厚度相差较大,与表1的厚度数据相互印证。利用CS-280色差仪对复合膜的色泽进行定量分析,*值越大,代表膜的透光性越好。由表1可知,随着TP@ZIF-8纳米材料的含量增加,*值逐渐降低,表明复合膜的透光性在逐渐降低。*值为负代表色泽偏绿色,*值为正代表色泽偏红色,*值的绝对值越大表示膜的颜色越深,由表1可知,复合膜的颜色偏红色。复合材料的添加量越大,膜的颜色越深。随着TP@ZIF-8纳米材料添加量的增加,复合膜的厚度也逐渐增加。薄膜的机械强度是评价复合膜品质的关键因素之一,利用质构仪对复合膜进行了薄膜穿刺实验,随着TP@ZIF-8复合材料添加量的增加,薄膜的穿刺强度也逐渐增加。

图7 TP@ZIF-8/CS/SA复合膜的外观照片Fig. 7 Photographs of TP@ZIF-8/CS/SA composite films

图8 TP@ZIF-8/CS/SA复合膜的表面图(A)及截面图(B)Fig. 8 Surface (A) and cross-sectional (B) observation of TP@ZIF-8/CS/SA composite films
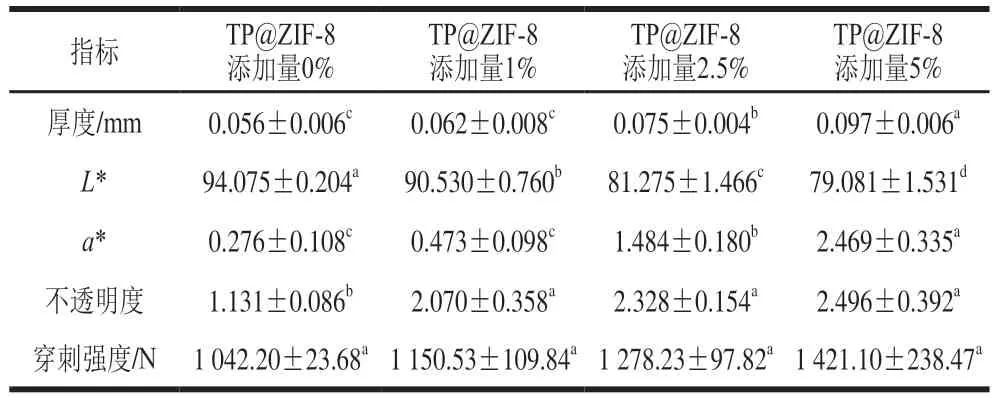
表1 TP@ZIF-8/CS/SA复合膜的相关性能表征Table 1 Properties of TP@ZIF-8/CS/SA composite films
紫外线会破坏食物中的抗氧化剂、脂类、营养素、色素和维生素等成分,并形成异味,对果蔬和其他食品的品质造成不利的影响,因此,制备具有抗紫外线辐射作用的食品包装是当前的重要研究方向之一。图9为复合膜对紫外-可见光的吸收光谱,图10为复合膜对紫外-可见光的透光率,可以看出各复合膜在紫外波长区(200~300 nm)内有吸收,对紫外光有一定的阻隔性能,且随着TP@ZIF-8纳米材料添加量的增加,对紫外光的吸收强度也越大,紫外光的透过率总体也越来越低。因此,该复合膜可以保护食品免受紫外线的伤害。

图9 TP@ZIF-8/CS/SA复合膜的紫外-可见吸收光谱Fig. 9 Ultraviolet absorption spectra of composite films

图10 TP@ZIF-8/CS/SA复合膜的透光率Fig. 10 Transmittance of composite films
进一步利用FT-IR对复合膜中的官能团变化进行分析。如图11所示,在所有的薄膜中3 200~3 600 cm范围内的宽峰归因于-O-H的拉伸或分子内和分子间的氢键作用。除此之外,观察到各组薄膜在1 650 cm处出现特征吸收峰,可能归因于-C=O的伸缩振动;还观察到SA和复合膜在1 143 cm和1 148 cm处存在特征吸收峰,可能归因于-C-O-C-的振动。在TP@ZIF-8复合膜中可以观察到CS、SA和TP@ZIF-8特殊官能团的存在,表明复合膜制备成功。热稳定性也是生物可降解复合膜的性能的重要指标,由图12可知,各组复合膜都出现3 个质量损失的过程,在30~200 ℃范围内的质量损失可能是由于水分的蒸发;在200~300 ℃处观察到第2次质量损失,这可能是由于甘油以及SA和CS的降解,300~500 ℃各组复合膜的质量损失趋于平缓,为生物聚合物的炭化过程。对复合膜进行DSC分析,从图13中可以看出,0%的复合膜在200 ℃左右出现熔化峰,而1%、2.5%、5%复合膜组在225℃左右出现熔化峰,总体上,加入TP@ZIF-8纳米材料的熔化峰对应的温度高于没加TP@ZIF-8纳米材料组,说明材料的加入可以改善膜的热稳定性。
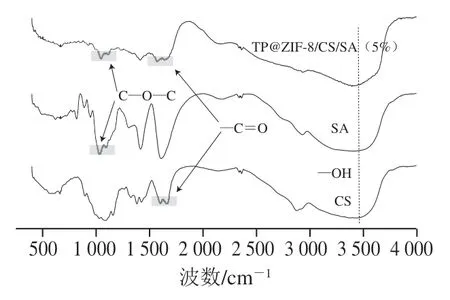
图11 TP@ZIF-8/CS/SA复合膜的FT-IRFig. 11 FT-IR spectra of the composite films

图12 复合膜的TGA曲线Fig. 12 TGA curves of composite films

图13 复合膜的DSC曲线Fig. 13 DSC curves of composite films
2.8 TP@ZIF-8/CS/SA复合膜的阻隔性能
氧气透过率是评价生物可降解薄膜的重要指标,氧气可以使包装中的食物发生氧化反应而变质,食品包装的氧气透过率低会对食品品质的维持发挥有益作用。由图14可知,随着TP@ZIF-8纳米材料添加量的增加,复合膜的氧气透过能力在逐渐地降低。通常,CS膜的氧气透过能力与氧气和CS中的NH的结合有关,而TP@ZIF-8纳米材料的加入降低了CS/SA复合膜的氧气透过率,可能是由于TP@ZIF-8纳米材料可以改变SA和CS的结构,从而降低了氧气透过率。同时,还可以看出TP@ZIF-8纳米材料的加入也显著降低了CO透过率,且其添加量越高,复合膜对二氧化碳的阻隔性能越好。综上,TP@ZIF-8纳米复合材料添加量为5%时对复合膜阻隔氧气和二氧化碳性能改善效果较好,这可能是由于TP@ZIF-8纳米材料与SA和CS发生了相互作用,提高了复合膜的O和CO阻隔性能。
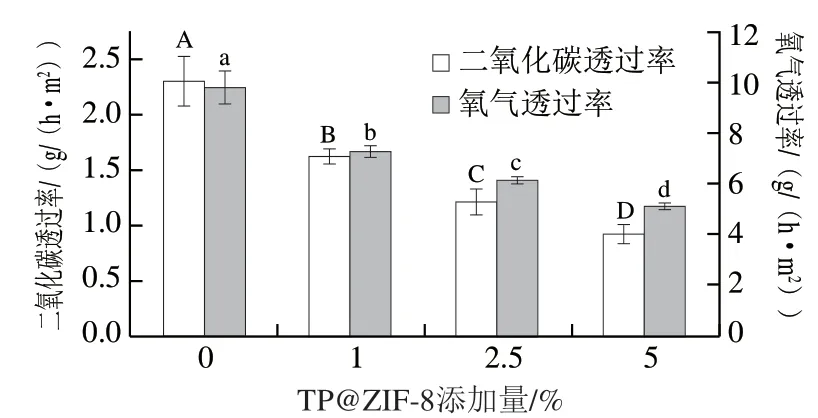
图14 复合膜的阻隔性能Fig. 14 Barrier properties of composite films
2.9 TP@ZIF-8/CS/SA复合膜对细菌的抑制效果
抑菌食品包装膜的研究近年来引起了极大的关注。抑菌食品包装膜可以作为防止细菌入侵的有效物理屏障,延长食品保质期。因此,包装材料的抑菌性能也是评价其性能的较为重要的指标。如图15所示,各组复合膜对与的抑菌效果基本一致,复合材料添加量为5%的复合膜抑菌率将近100%。抑菌性能的显著提高,一方面是因为TP从ZIF-8缓慢地释放,促进了细菌细胞内活性氧含量的增加从而发挥抑菌性能;另一方面是因为ZIF-8在与细菌共同孵育的液体中发生降解,释放Zn和2-甲基咪唑。许多研究表明,锌基颗粒中Zn的释放是ZIF-8发挥抑菌性能的重要原因。Zn使细菌的细胞质膜变形,细胞的形状发生变化,离子渗入细胞壁导致细胞质泄漏,这些因素导致细胞的最终死亡,因此,ZIF-8能够发挥显著的抑菌作用。综上,TP@ZIF-8纳米材料的加入改善了CS/SA复合膜的抑菌性能。
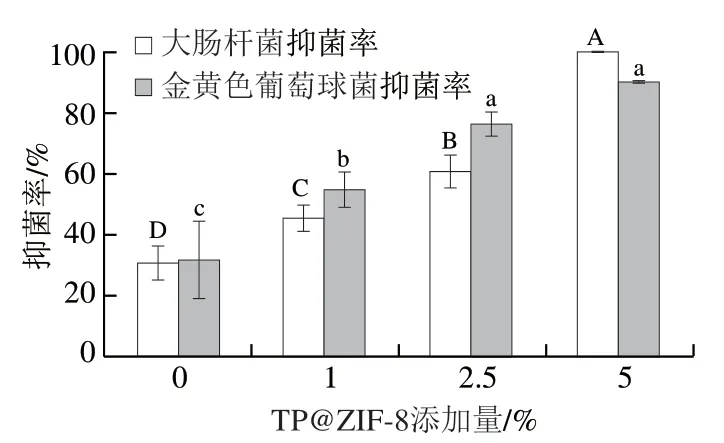
图15 复合膜对大肠杆菌和金黄色葡萄球菌的抑菌性能Fig. 15 Antibacterial performance of composite films against Escherichia coli and Staphylococcus aureus
2.10 TP@ZIF-8/CS/SA复合膜的抗氧化活性
由图16可知,当复合材料的添加量为5%时,复合膜的DPPH自由基清除能力和ABTS阳离子自由基清除能力最高。主要是因为其主要活性成分TP作为供氢体与自由基发生反应,终止了自由基的链式反应,使DPPH溶液和ABTS溶液明显褪色。复合膜在与水接触的同时,水分子会逐步侵入到复合膜中,该过程会导致复合膜溶胀溶解,使得TP从ZIF-8中逐步被释放出来,从而起到清除DPPH自由基和ABTS阳离子自由基的作用。而当溶液达到平衡状态时,TP含量最高,清除DPPH自由基和ABTS阳离子自由基的能力也随之提高。

图16 TP@ZIF-8/CS/SA复合膜的抗氧化活性Fig. 16 Antioxidant activities of composite films
3 结 论
TP@ZIF-8纳米材料的加入对CS/SA复合膜的外观有一些影响,使膜的颜色变深(变为红色),并使膜的表面变得粗糙;TP@ZIF-8纳米材料的加入对复合膜的机械性有明显的改善作用,TP@ZIF-8纳米材料的添加增加了复合膜的热稳定性能;此外,与CS/SA复合膜相比,TP@ZIF-8纳米材料的添加量为5%时复合膜的阻隔性能(紫外线、氧气、二氧化碳等)显著提升(<0.05)。TP@ZIF-8纳米材料的加入赋予了复合膜良好的抑菌性能和抗氧化性能,因此,本实验制备的TP@ZIF-8/CS/SA活性包装膜有望应用于食品保鲜。
