豌豆超微粉碎膳食纤维对糖尿病小鼠肠道菌群及其代谢产物的影响
2022-09-30厉佳怡王红磊杨倩倩杨进洁南希骏盛桂华
厉佳怡,王红磊,杨倩倩,杨进洁,嵇 威,南希骏,盛桂华,*
(1.山东理工大学农业工程与食品科学学院,山东 淄博 255049;2.山东省高校农产品功能化技术重点实验室,山东 淄博 255049;3.烟台双塔食品股份有限公司,山东 烟台 265404)
糖尿病的治疗已成为当今最重要的公共卫生挑战和经济负担之一。患有2型糖尿病(type 2 diabetes mellitus,T2DM)的人口数量约占糖尿病患者的90%。目前,糖尿病的治疗主要是通过饮食干预、药物治疗以及加强运动来控制血糖,其中饮食干预是治疗的重要途径。相比于药物治疗,改善糖尿病人的饮食结构、增加膳食纤维的摄入副作用更小。膳食纤维属于多糖类物质,是一种优质的功能性食品,可以保持人体健康和预防机体疾病,具有一定的生理功效。根据相关研究表明,膳食纤维在降血糖方面有显著作用,其降血糖的作用可能包括以下几个方面:1)在人体内能够影响-淀粉酶活力,降低淀粉的水解速度,减缓葡萄糖的释放及浓度上升;2)在肠道中能够吸附游离的葡萄糖并排出;3)可以增加神经末梢对胰岛素的敏感性,改善胰岛素抵抗的状态。
研究发现,与正常人相比,糖尿病患者肠道中拟杆菌门(Bacteroidetes)、变形菌门(Proteobacteria)的丰度升高,厚壁菌门(Firmicutes)丰度降低,此外双歧杆菌和乳酸杆菌等有益菌的丰度也显著减少。张影研究了膳食纤维和蛋白质两种物质对T2DM患者肠道菌群的影响,结果表明,膳食纤维饮食能够改善糖尿病患者的血糖浓度,使肠道有益菌丰度升高;而蛋白质饮食虽然能够改善患者的糖稳态,降低血糖浓度,但是会加重患者的胰岛素抵抗。Qin Junjie等利用宏基因组技术对345 名志愿者的肠道菌群样本进行测序;结果表明T2DM患者肠道菌群明显失调,各种致病菌的丰度增加,而某些产丁酸盐等短链脂肪酸(short chain fatty acids,SCFAs)的常见细菌丰度减少。SCFAs能够在小肠、胰腺和肝脏等器官中作为信号分子调节体内的能量代谢,进而调控血糖水平。
有学者认为膳食纤维降血糖与肠道菌群及其代谢产物SCFAs有关系。不能消化吸收的膳食纤维可以调节肠道菌群的紊乱行为,同时能够被肠道中的数百种菌群所分解利用,产生的代谢物质SCFAs能被人体吸收参与代谢。Zhao Liping等研究表明,碳水化合物发酵产生的SCFAs可以调节肠道微生物系统的生态环境,高膳食纤维饮食可以促进特定肠道益生菌的增殖,从而调节糖尿病患者的肠道菌群,这些益生菌在肠道生态系统中比其他产生SCFAs的细菌和致病菌更具竞争力。
豌豆膳食纤维(pea dietary fiber,PDF)具有潜在的降血糖功能开发价值。Hashemi等通过动物实验证实,PDF具有降低血糖的效果,并且可能有改善肠道菌群组成的作用。然而目前鲜有研究报道PDF的降血糖机制。由实验室前期研究结果可知,超微粉碎的PDF具有更小更均匀的粒径、更高的可溶性膳食纤维含量,这都有利于发挥降糖效果。因此,本研究探讨超微粉碎豌豆膳食纤维(ultrafine grinded pea dietary fiber,UGPDF)对小鼠肠道菌群丰度、物种组成及代谢产物、肝脏组织形态及磷脂酰肌醇-3-激酶(phosphatidylinositol-3-kinase,PI3K)/蛋白激酶B(protein kinase B,AKT)/类胰岛素生长因子(insulinlike growth factors,IGF)蛋白表达的影响,以期从肠道菌群角度探究UGPDF降血糖机制,拓宽PDF的应用领域,为PDF降血糖机制研究提供新的思路和理论参考。
1 材料与方法
1.1 动物、材料与试剂
BALB/C雄性小鼠,体质量(25±3)g,购自济南金丰实验动物有限公司,生产许可证号:SCXK(鲁)2014-0007。
豌豆膳食纤维由烟台双塔食品股份有限公司提供。
链脲佐菌素(streptozocin,STZ)、二甲双胍、十二烷基硫酸钠 上海爱纯生物科技有限公司;RIPA裂解液 北京索莱宝生物科技有限公司;聚偏二氟乙烯(polyvinylidene fluoride,PVDF)膜 美国Millipore公司;AxyPrepDNA凝胶回收试剂盒 美国Axygen公司。
1.2 仪器与设备
血糖仪、血糖试纸条 长沙三诺生物传感股份有限公司;FDV型超微粉碎机 江苏省金坛市金城国盛实验仪器厂;凝胶电泳仪 美国Bio-Rad公司;JY04S-3B型凝胶成像分析系统 上海圣科仪器有限公司;ABI GeneAmp9700型聚合酶链式反应(polymerase chain reaction,PCR)仪 美国ABI公司;Miseq型测序仪美国Illumina公司;8890B-5977B GC/MSD气相色谱-质谱联用仪 美国安捷伦科技有限公司;微型荧光计美国Promega公司;倒置显微镜 德国Leica公司。
1.3 方法
1.3.1 超微粉碎膳食纤维制备
参考Wang Meng等的方法,用FDV型超微粉碎机将PDF粉碎(粉碎30 s、停歇30 s,循环2 次)得UGPDF。
1.3.2 动物实验设计
以BALB/C雄性小鼠为实验对象,分笼饲养,自由进食和饮水饲喂1 周以适应环境,保持温度(22±2)℃、相对湿度(55±10)%以及无菌通风状态。动物饲养和处理遵循中国实验动物科学协会实验动物福利和伦理委员会规定。
用0.1 mol/L柠檬酸缓冲液配制STZ溶液,现用现配,避光冰浴保存,10 min内完成腹腔注射。小鼠适应性饲养1 周后,断食16 h,不断水,将小鼠分为正常对照组(10 只)和实验组(40 只),实验组一次性腹腔注射STZ溶液(100 mg/kg),正常对照组(NC)腹腔注射等体积柠檬酸缓冲液。3 d后血糖仪测定小鼠尾静脉血糖水平,以空腹血糖浓度大于11.1 mmol/L判定为糖尿病小鼠模型造模成功。正常对照组(NC)腹腔注射等体积柠檬酸缓冲液。
将建模成功小鼠随机分为模型组(DC)、膳食纤维高剂量组(UGPDF-GH,0.9 g/(mL·d))、膳食纤维低剂量组(UGPDF-GL,0.45 g/(mL·d))、阳性(二甲双胍)对照组(PC,10 mg/(mL·d)),每组10 只,NC组与DC组给予标准饲料,UGPDF-GH、UGPDF-GL、PC组小鼠灌胃剂量为0.25 mL/d,周期为4 周。
1.3.3 小鼠血糖浓度测定
每周最后1 d在小鼠尾部静脉取血,用血糖仪测定各组小鼠血糖浓度。
1.3.4 肝脏组织形态观察
解剖小鼠后,将各组肝脏组织分别浸泡在体积分数10%福尔马林溶液中;分别用体积分数为70%、80%、95%、100%的乙醇梯度脱水,石蜡包埋切片(5 μm)。用苏木精-伊红染色,在放大400 倍的倒置显微镜下观察肝脏组织形态变化。
1.3.5 Western blot检测
将小鼠肝脏组织切开,用RIPA裂解液对肝脏蛋白质抽提,用BCA法对抽提后样本蛋白质量浓度进行定量,使各样本的蛋白质量浓度达到相近水平,再将处理后的蛋白样本置于99 ℃水浴中加热5 min,使蛋白变性,随后取出冰浴5 min。通过十二烷基硫酸钠-聚丙烯酰胺凝胶电泳对处理好的样品进行蛋白分离,用PVDF膜进行膜转化后清洗1~2 次,4 ℃密封过夜。在原稀释液中孵育1 h,洗涤3 次,每次5 min,第二次抗体孵育步骤同上,最后置于凝胶成像仪中拍照分析。
1.3.6 肠道菌群分析
1.3.6.1 粪便DNA提取、扩增、测序
对各组小鼠粪便抽提DNA,1%琼脂糖凝胶电泳检测。检测合格后PCR扩增。扩增区域为V3~V4可变区,引物为338F:ACTCCTACGGGAGGCAGCAG,806R:GGACTACHVGGGTWTCTAAT,扩增后进行2%琼脂糖凝胶电泳,AxyPrepDNA凝胶回收试剂盒,切胶回收PCR产物,Tris-HCl缓冲液洗脱,利用微型荧光计的QuantiFluor™-ST系统定量后通过IIlumina GAIIx高通量测序平台进行测序。以上操作由上海美吉生物有限公司协助完成。
1.3.6.2 生物信息学分析
将Miseq测序仪测序得到的数据根据overlap进行拼接,质控过滤,优化去杂;聚类分析区分样本序列,形成操作分类单元(operational taxonomic units,OTU)划分,通常对97%相似水平下的OTU进行生物信息统计分析。在域、界、门、纲、目、科、属、种水平统计样本的群落物种组成,对比的数据库包括细菌和古菌16S rRNA数据库、真菌18S rRNA数据库、真菌ITS数据库、功能基因数据库。基于OTU聚类结果,得到对应的物种信息和丰度分布;分析群落的丰富度(Chao指数)、群落多样性(Shannon指数、Simpson指数);并通过群落柱状图与群落热图分析各组在门、属水平上的群落结构组成情况。
1.3.7 肠道SCFAs含量测定
小鼠粪便中SCFAs含量采用GC-MS测定。取100 mg样品于2 mL研磨管中,加入900 μL甲醇和100 μL内标溶液(1 000 μg/mL 2-乙基丁酸)后冷冻研磨两次,每次3 min。研磨后冰水浴超声30 min,-20 ℃静置30 min,13 000×离心15 min(4 ℃),取上清液,加50 mg无水硫酸钠再次离心,取上清液进行气相色谱-质谱分析。
色谱条件:HP FFAP毛细管柱(30 m×0.25 mm×0.25 μm),以流速1.0 mL/min高纯氦气为载气,进样口温度260 ℃,进样量1 μL,分流比为10∶1。管柱初始温度80 ℃,以40 ℃/min升至120 ℃,再以10 ℃/min升温至200 ℃,后230 ℃保持1 min。质谱条件:电子轰击离子源,离子源温度230 ℃,四极杆温度150 ℃,传输线温度230 ℃。全扫描模式,扫描范围:30~300/。通过Masshunter定量软件计算结果。
1.4 数据处理与分析
每个实验3 次重复,采用SPSS 19.0软件进行数据统计分析,结果表示为平均值±标准差,进行单因素方差分析,采用Origin 8.5软件作图。
2 结果与分析
2.1 UGPDF对小鼠血糖浓度的影响
研究表明,饮食中的膳食纤维含量可反映血糖指数,当摄食高含量膳食纤维时,人体血糖指数下降,因此,膳食纤维摄入量是T2DM最重要的预测因素之一。表1为4 周内各组小鼠的血糖浓度变化情况,DC组小鼠的血糖浓度呈持续上升趋势,并在第4周血糖浓度达到(19.10±1.65)mmol/L;经过UGPDF干预后,与DC组相比,不同剂量组小鼠血糖浓度均显著降低(<0.05),且存在剂量依赖关系,其中UGPDF-GH组和PC组的降血糖效果最显著,第4周血糖浓度分别降到(6.70±0.90)、(6.90±0.53)mmol/L,与NC组无差异(>0.05),与文献[21-22]报道结果一致。
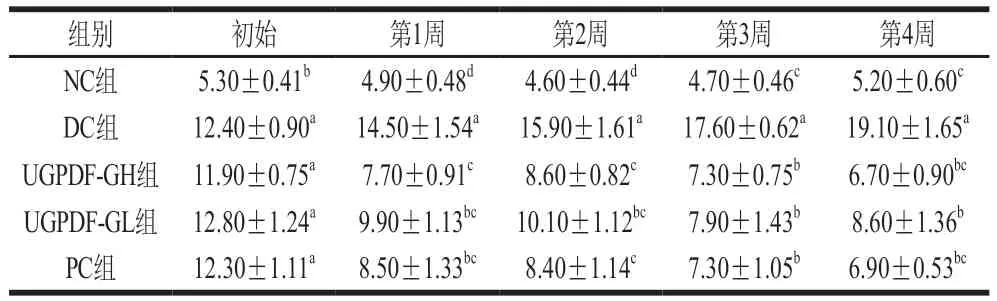
表1 不同组别小鼠4 周内血糖浓度变化Table 1 Changes in blood glucose of DM mice during the four-week administration period mmol/L
2.2 UGPDF对糖尿病小鼠肝脏组织形态的影响
肝细胞具有解毒、调节多种营养物质分泌、排泄代谢产物等功能,是肝脏主要的功能细胞,也是体内葡萄糖代谢异常、发生糖异生的主要场所。如图1所示,NC组的肝细胞排列整齐、紧密,细胞形态饱满,肝小叶形态完整,而DC组肝细胞的胞间隙变大,细胞核大小不均,形态有所改变,这与王赛等建立的T2DM模型肝细胞形态相似。经过4 周干预后,与模型组相比,PC组肝脏细胞间隙较明显变小,细胞形态也有所改善,UGPDF对细胞改善情况呈剂量依赖性,UGPDF-GH组肝细胞排列整齐,糖原沉积情况有所缓和,核质分布均匀。表明UGPDF对糖尿病小鼠肝组织损伤具有明显的改善作用。
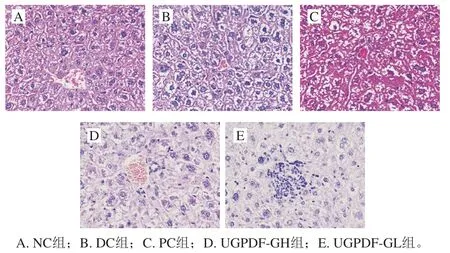
图1 UGPDF对糖尿病小鼠肝脏细胞形态的影响Fig. 1 Effect of UGPDF on hepatic cell morphology in diabetic mice
2.3 UGPDF对糖尿病小鼠肝脏PI3K/AKT/IGF蛋白表达的影响
IGF与胰岛素的结构类似,功能也相似,具有促进细胞增长、促进葡萄糖转运代谢、增强人体对胰岛素敏感度、促进损伤细胞修复的功能。有相关研究报道,IGF可以通过激活PI3K/AKT通路,从而刺激胰岛β细胞增殖,增加胰岛素敏感性。小鼠肝脏组织Western blot检测结果如图2、3所示。与NC组相比,DC组小鼠肝脏的PI3K、AKT和IGF表达量显著降低。使用阳性药物和UGPDF干预,显著改善了糖尿病小鼠肝脏内的蛋白表达,其中以阳性药物效果最为显著,与DC组相比,PC组PI3K、AKT、IGF蛋白表达量分别升高了495.42%、255.11%、385.09%。UGPDF-GH组蛋白表达量明显高于UGPDF-GL组,与DC组相比,UGPDF-GH组PI3K、AKT、IGF蛋白表达量分别升高了420.33%、105.71%、327.67%。结合肝组织苏木精-伊红染色图像来看,推测DC组上游信号转导因子PI3K/AKT表达受影响后,导致肝糖代谢异常,进一步影响肝细胞损伤。表明UGPDF能够通过提高糖尿病小鼠肝脏细胞PI3K/AKT信号通路的传导,促进IGF蛋白表达,修复肝脏组织损伤。

图2 小鼠肝脏蛋白Western blot图Fig. 2 Protein expression in liver tissues of mice measured by Western blot
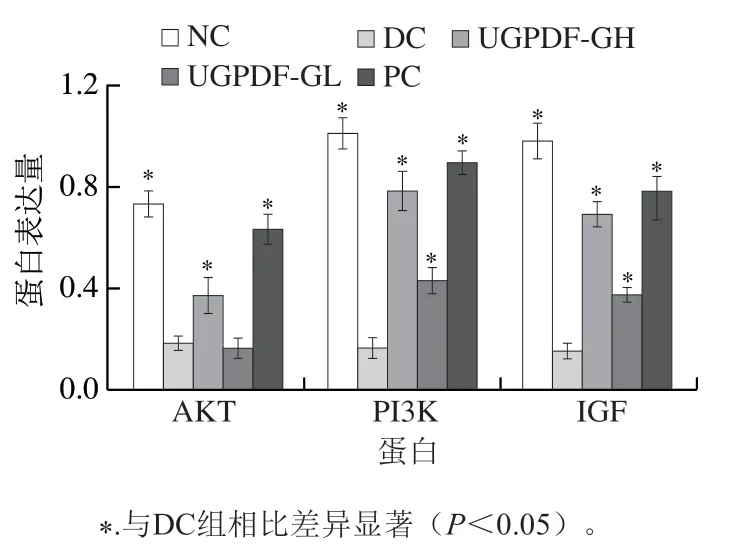
图3 小鼠肝脏中PI3K、AKT、IGF蛋白表达量Fig. 3 Expression levels of PI3K, AKT, IGF proteins in liver
2.4 UGPDF对糖尿病小鼠肠道菌群的影响
2.4.1 肠道菌群的多样性
Coverage指数代表各样本文库覆盖率,由表2可知,所有组中的Coverage指数都大于0.998,接近于1,说明该测序结果能够反映出样本中微生物的真实情况。Chao指数用于估计样本中所含OTU数,Shannon与Simpson指数用来估算样本中微生物多样性,Shannon指数越大,菌群群落多样性越高;Simpson指数与之相反。
在大于97%的序列相似性的筛选下,各组小鼠的OTU数及肠道菌群Alpha多样性如表2所示。由表2与图4可知,DC组OTU数为188±28,与NC相比显著下降了51.80%;且DC组与NC组共有的OTU数为120,特有的OTU数为68,说明糖尿病小鼠肠道菌群发生显著改变,丰度和多样性发生变化;而UGPDF-GH组和PC组的OTU数分别为300±36、331±29,与DC组共有的OTU数分别为152、149,与NC组共有的OTU数目分别为190、242;说明在经过UGPDF和二甲双胍干预4 周后,糖尿病小鼠的肠道菌群丰度和多样性得到不同程度的显著改善,并向NC组小鼠靠近。Shannon与Simpson指数也侧面反映了这个趋势,与NC组相比,DC组小鼠肠道菌群Shannon指数显著降低,Simpson指数显著升高;与DC组相比,经UGPDF干预后,UGPDF-GH组Shannon指数显著升高,Simpson指数显著降低,并且这两个指数与NC组相比,没有显著差异性。这一趋势与魏国华的研究结果相似。这可能是因为UGPDF可以被肠道内菌群发酵,改变肠道内pH值,从而调节肠道菌群丰度及多样性,改善糖尿病导致的肠道菌群紊乱。

表2 小鼠肠道菌群丰度及多样性变化Table 2 Changes in intestinal flora abundance and diversity in mice

图4 小鼠肠道菌群OTU数Venn图Fig. 4 Venn diagram showing the number of unique and shared OTUs in the intestinal flora of mice
2.4.2 肠道菌群在门水平的差异
在对肠道菌群高通量测序后,与数据库比对可以得到小鼠肠道菌群组成与丰度变化情况。为了明显观察UGPDF对糖尿病小鼠肠道菌群多样性及物种组成的影响,对肠道菌群在门和属水平上差异进行比较分析。由图5A可知,Firmicutes与Bacteroidetes为肠道内两大优势菌门,占85%以上。由图5B可知,与NC组相比,DC组小鼠肠道中Firmicutes和Bacteroidetes相对丰度显著下降(<0.05),Epsilonbacteraeota与Proteobacteria丰度显著增加(<0.05),经过UGPDF的干预后,与DC组相比,Firmicutes相对丰度显著提高,Epsilonbacteraeota与Proteobacteria相对丰度显著下降(<0.05),Bacteroidetes相对丰度也下降,但变化不显著(>0.05)。这与Wang Xueliang等的研究结果类似。有研究报道,Firmicutes与Bacteroidetes的相对丰度变化影响着机体代谢从而控制体质量增长率,Firmicutes相对丰度高于Bacteroidetes时,会使机体有效吸收营养物质,体质量增加。Epsilonbacteraeota与Proteobacteria包含条件致病菌,如肠杆菌、幽门螺旋杆菌等,过度富集容易引起肠道慢性炎症,从而引起胰岛素抵抗,以及增加代谢疾病的风险。

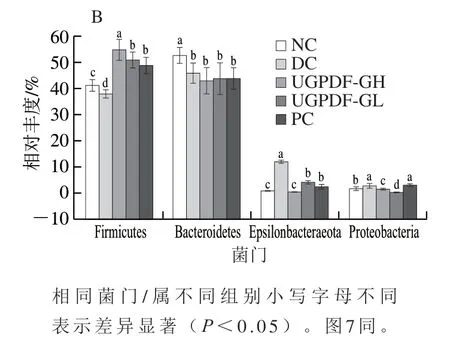
图5 小鼠肠道菌群物种门水平组成(A)与优势物种丰度(B)Fig. 5 Intestinal flora composition at the phylum level (A) and dominant species abundance (B)
2.4.3 肠道菌群在属水平的差异
如图6A、B所示,各组小鼠肠道菌群在属水平的相对丰度存在明显差异。为了更直观反映各组小鼠优势菌属水平的差异,选取3 类具有代表性的菌属(图7):1)有益菌:乳酸菌()、普雷沃氏菌科(Prevotellaceae)、颤杆菌克属();2)条件致病菌:螺杆菌属()、克雷伯氏菌属()、梭状杆菌()、肠球菌();3)产SCFAs的菌:毛螺菌科(Lachnospiraceae)、拟普雷沃菌属()、布劳特氏菌()。由图7A、B可知,与NC组小鼠相比,糖尿病小鼠的肠道菌群在属水平存在紊乱现象,其中有益菌属、Prevotellaceae、的相对丰度显著降低(<0.05);条件致病菌、、过度富集,而、、这些致病菌在正常小鼠肠道内的相对丰度低于0.1%,甚至检测不出;由图7C可知,糖尿病小鼠肠道内的部分产SCFAs的菌群相对丰度显著降低(<0.05),这与聂启兴的研究结果一致。经过UGPDF的饮食干预后,与DC组小鼠相比,有益菌属和产SCFAs的菌属丰度整体上显著升高,达到甚至超过正常小鼠的水平,其中UGPDF-GL干预组中大量富集,成为主要菌属。为乳酸菌的一种杆状菌群,分解糖类物质能力极强,最终代谢产物为乳酸;Prevotellaceae与可以发酵碳水化合物,产物为乙酸、琥珀酸等SCFAs;代谢产物为乙酸。在4 周的饮食干预下,UGPDF可以被肠道内的有益菌及产SCFAs菌群所发酵利用,调节肠道pH值,达到抑制致病菌的效果,因此UGPDF可以调节小鼠肠道菌群环境,促进肠道菌群健康。
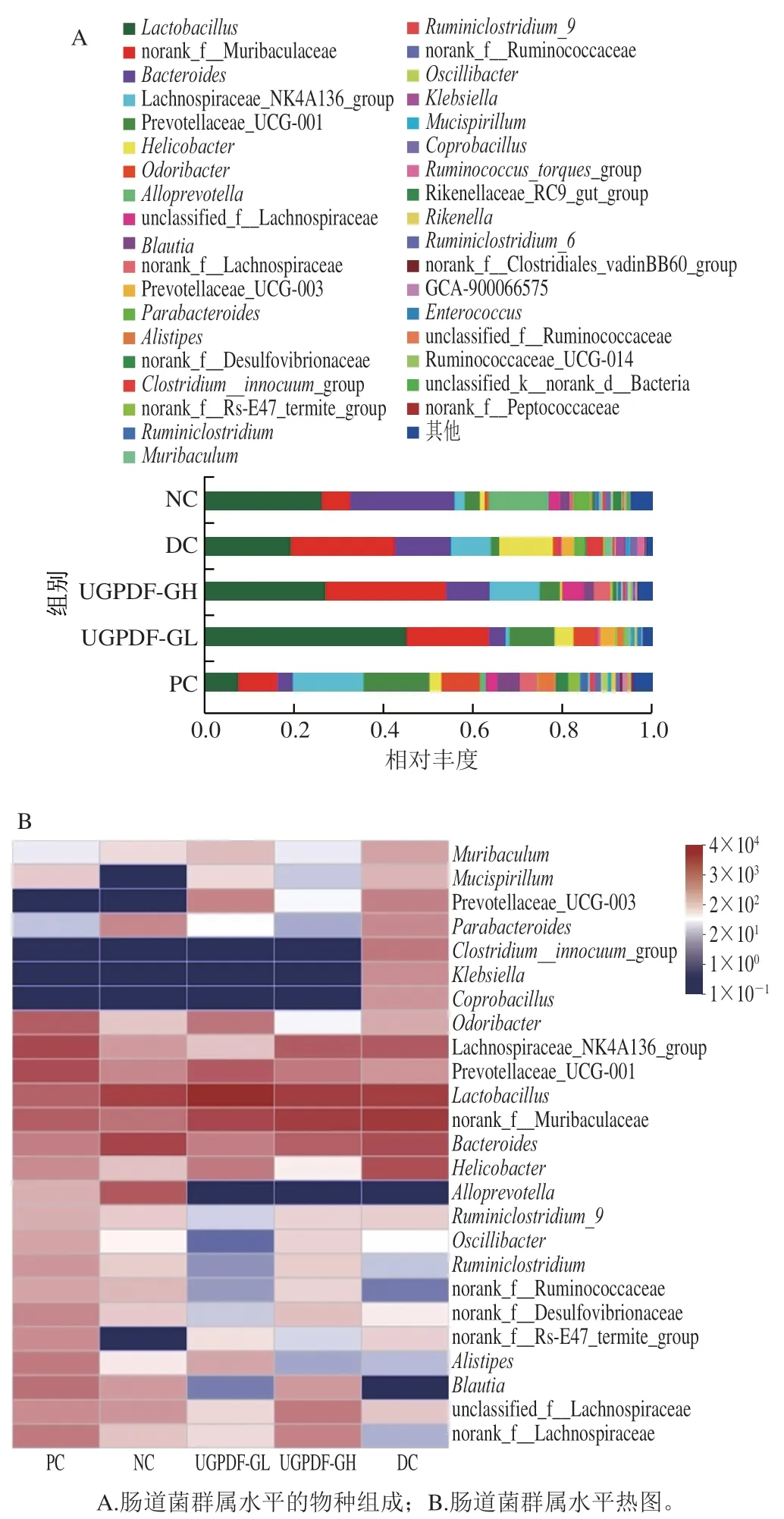
图6 小鼠肠道菌群属水平物种分析Fig. 6 Intestinal flora composition at the genus level of mice

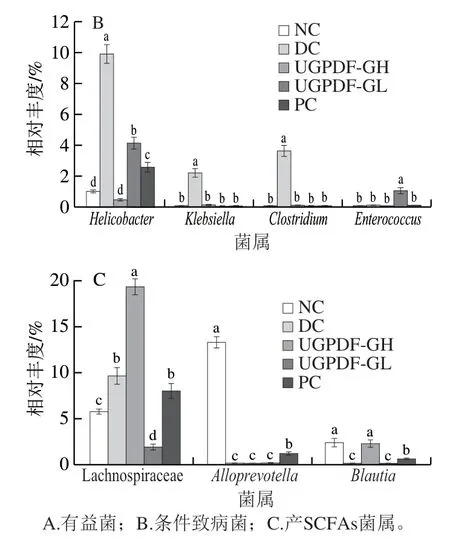
图7 小鼠肠道菌群属水平的相对丰度Fig. 7 Intestinal flora abundance at the genus level
2.5 UGPDF对糖尿病小鼠粪便SCFAs含量的影响
临床研究表明,SCFAs可以维持肠道形态和功能,并具有一定的调节作用,可用于评估肠道内细菌的种类和活性。因此,肠道或粪便中SCFAs的含量是评估各种肠道慢性疾病的主要指标之一。由图8可知,乙酸、丙酸和丁酸是小鼠粪便中主要的SCFAs,其含量明显高于异丁酸、戊酸、异戊酸。与NC组相比,糖尿病小鼠粪便中各SCFAs含量显著降低(<0.05),与Zhao Liping等的研究结果一致。经过UGPDF饮食干预后,与DC组相比,小鼠粪便内的SCFAs含量显著升高,且存在剂量依赖关系,其中以UGPDF-GH组效果最为显著,其乙酸、丙酸、丁酸含量分别为(1.49±0.11)、(0.51±0.06)、(0.49±0.05)μg/mg,较DC组分别提高了63.7%、75.9%和96.0%,且接近NC组小鼠。

图8 各组小鼠粪便SCFAs含量Fig. 8 Contents of SCFAs in feces of mice in each group
研究表明,乙酸能够减少肝脏中木酮糖-5-磷酸的积累和降低磷酸果糖激酶-1的活性,从而调节机体的糖酵解、糖异生代谢,降低糖尿病患者的血糖浓度;丙酸能够作用于胰岛细胞,促进胰岛素分泌,减缓胰岛β细胞凋亡,同时刺激胰高糖素样肽-1的分泌,改善胰岛素抵抗;丁酸可以增加胰岛素敏感性,以及通过促进肠道糖异生作用抑制肝脏糖异生,改善代谢,同时丁酸在肠道中可以调节微生物生态,增加丰度降低肠杆菌等致病菌的丰度。而UGPDF摄入后可以被这些菌群所发酵代谢,提高乙酸、丙酸等SCFAs的代谢产量,从而调节代谢,达到降血糖的作用。
3 结 论
UGPDF可以修复肝脏细胞损伤,改善小鼠肝脏PI3K/AKT/IGF蛋白表达;调节糖尿病小鼠体内肠道菌群的丰度及多样性,改善小鼠肠道环境,增加有益菌的丰度,抑制致病菌的增殖;此外,由于不易消化的特性,使其可以在肠道内被功能性菌群所发酵代谢,增加其代谢产物SCFAs的含量。UGPDF能够被小鼠肠道内有益菌群所发酵,如、Lachnospiraceae等,同时抑制致病菌、等的增殖,促进肠道菌群环境健康。从代谢产物SCFAs来看,经过UGPDF干预后,小鼠粪便内的6 种SCFAs含量较DC组均显著升高,其中以UGPDF-GH组提升效果最为显著,其SCFAs含量接近NC组小鼠水平。本研究为UGPDF的应用提供了思路,并补充完善了其降血糖的机制,为UGPDF功能性应用提供了参考。
