玉簪多糖对细胞氧化应激损伤的保护作用机制
2022-09-30吴金姗刘树英刘回民刘洪章刘景圣
吴金姗,黄 榕,刘树英,刘回民,*,刘洪章,*,刘景圣
(1.吉林农业大学食品科学与工程学院,吉林 长春 130118;2.吉林农业大学生命科学学院,吉林 长春 130118)
氧化应激是指机体内氧化失衡的状态,亦是肝损伤发生的主要诱因。氧化应激现象发生时,产生过量的氧自由基会对细胞造成破坏,导致氧化应激损伤。研究表明,活性氧(reactive oxygen species,ROS)是氧正常代谢过程中的产物,也是诱发氧化应激的重要物质,过多的ROS能够影响基因组的稳定性,导致多种慢性疾病发生。肝脏疾病发生时,患者体内抗氧化状态失衡,抗氧化酶的表达量减少,ROS水平增高。Kelch样环氧氯丙烷相关蛋白1(Kelch-like epichlorohydrin-associated protein 1,Keap1)/核因子E2相关因子2(nuclear factor erythroid 2-related factor 2,Nrf2)/抗氧化反应元件(antioxidant response element,ARE)是机体内的抗氧化信号通路,能够诱导抗氧化蛋白的表达,降低机体ROS水平,因此,调节Keap1/Nrf2/ARE信号通路能够减轻氧化应激损伤。
研究证明植物多糖具有良好的抗氧化能力。体外抗氧化实验表明,山药多糖、山茱萸籽多糖、百合籽多糖和黄精多糖具有较强的自由基清除活性;体内抗氧化机制研究表明,竹荪多糖能够改善高脂乳糜诱导的肥胖小鼠肝脏氧化应激水平并缓解肥胖相关性肝肾代谢损伤,黑木耳渣多糖能通过提高体内抗氧化酶活性、降低脂质含量起到抗氧化和降脂保肝的作用。相比于合成类抗氧化剂的毒副作用和不稳定性,植物多糖不仅毒副作用小,还具有较强的抗氧化能力,因此,近年来植物多糖的生理活性受到广泛关注。
紫萼玉簪又名紫花玉簪,为百合科(Liliacea)玉簪属()多年生宿根草本植物,其全草或根均可入药,具有可食用性。目前已有研究证实玉簪中黄酮、皂苷和多糖等成分具有一定的抗炎抑菌活性,但鲜有关于紫萼玉簪根系多糖(root polysaccharide,HVRP)的抗氧化机制研究。本实验旨在探寻HVRP对叔丁基过氧化氢(-butyl hydroperoxide,-BHP)诱导的HepG2细胞氧化应激损伤的影响,在细胞水平解析HVRP的抗氧化作用机制,为HVRP在功能性食品领域的应用提供理论参考。
1 材料与方法
1.1 材料与试剂
紫萼玉簪根系于2017年8月采于吉林农业大学校内;HepG2细胞(肝癌细胞) 美国模式培养物集存库。
-BHP 美国Sigma公司;噻唑蓝(3-(4,5-dimethyl-2-thiazolyl)-2,5-diphenyl tetrazolium bromide,MTT)北京博奥拓达科技有限公司;胎牛血清(fetal bovine serum,FBS) 以色列BI公司;DMEM培养基、TRIzol试剂 美国Thermo公司;1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)自由基清除能力检测试剂盒、羟自由基清除能力检测试剂盒、超氧阴离子自由基清除能力检测试剂盒 北京索莱宝科技有限公司;-乙酰半胱甘酸(-acetyl--cysteine,NAC)、ROS试剂盒、还原型谷胱甘肽(glutathione,GSH)试剂盒、谷胱甘肽过氧化物酶(glutathione peroxidase,GPx)试剂盒、丙二醛(malondialdehyde,MDA)试剂盒、超氧化物歧化酶(superoxide dismutase,SOD)试剂盒、过氧化氢酶(catalase,CAT)试剂盒、BCA蛋白浓度测定试剂盒 上海碧云天生物技术有限公司;PrimeScriptRT-PCR试剂盒 日本TaKaRa公司;Nrf2、NAD(P)H∶醌氧化还原酶1(NAD(P)H∶quinone oxidoreductase 1,NQO1)、血红素加氧酶1(heme oxygenase 1,HO-1)、c-Jun氨基末端激酶(c-Jun N-terminal kinase,JNK)、磷酸化JNK(phosphorylation JNK,p-JNK)、-actin、辣根过氧化物酶标记羊抗兔IgG(H+L)抗体 北京博奥森生物技术有限公司;溴化钾(KBr)(色谱纯)国药集团化学试剂有限公司;其他试剂均为国产分析纯。
1.2 仪器与设备
FTIR-8400S傅里叶变换红外光谱仪 上海实验仪器厂有限公司;二氧化碳培养箱 日本Sanyo公司;紫外-可见分光光度计 美国Thermo公司;全自动酶标仪德国BGM LABTECH公司;Mx3000p实时荧光定量聚合酶链式反应(polymerase chain reaction,PCR)仪美国Agilent公司;ImageQuant LAS 500生物分子成像仪美国GE Healthcare公司。
1.3 方法
1.3.1 HVRP的提取
取洗净的紫萼玉簪根系,用粉粹机粉碎,过60 目筛,采用索氏抽提法脱脂,自然晾干,按一定料液比置于热水中浸提一段时间,抽滤后合并滤液浓缩,用体积分数75%乙醇溶液醇沉,随后冷冻干燥醇沉样品。采用三氯乙酸法稍加修改脱除蛋白,即取醇沉后冻干多糖加适量水溶解,加入等体积的质量分数16%三氯乙酸溶液混合,80 ℃水浴36 min,经透析、旋转蒸发并冷冻干燥得到浅棕色多糖,即为HVRP。
1.3.2 HVRP提取率测定
以葡萄糖作为标准品,采用苯酚-硫酸法测定多糖的质量浓度,根据公式(1)计算提取率。
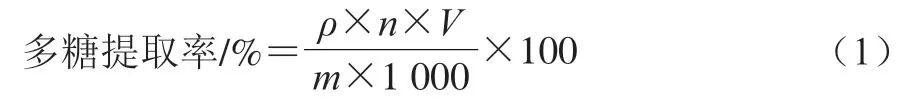
式中:为多糖质量浓度/(mg/mL);为样品液稀释倍数;为样品液体积/mL;为样品质量/g。
1.3.3 单因素试验
采用传统水提法提取HVRP,提取率主要影响因素有料液比、提取时间和提取温度,将上述因素进行单因素试验。设定料液比1∶30、提取时间2 h、提取温度80 ℃为单因素试验中的常规量。以料液比(1∶20、1∶30、1∶40、1∶50、1∶60)、提取时间(1、2、3、4、5 h)和提取温度(60、70、80、90、100 ℃)3 个因素变量替换试验中的常规量。按照1.3.1节方法提取HVRP,分别分析料液比、提取时间和提取温度对多糖提取率的影响。
1.3.4 响应面优化试验
根据单因素试验结果,选取提取温度()、提取时间()、料液比()3 个因素,以HVRP提取率作为响应值,进行响应面优化试验设计,试验变量的因素与水平如表1所示。

表1 响应面试验设计因素水平Table 1 Codes and levels of independent variables used for response surface desgin
1.3.5 理化指标测定
采用二硝基水杨酸法测定HVRP还原糖质量分数,回归方程为=0.001-0.044 8,=0.994 6。采用硫酸-间羟联苯法测定HVRP糖醛酸质量分数,回归方程为=0.018+0.007,=0.995 4。采用考马斯亮蓝法对HVRP蛋白质量分数进行测定,回归方程为=0.007 1+0.027,=0.995 1。
1.3.6 傅里叶变换红外光谱分析
将干燥的HVRP样品与KBr混合研磨后压片,用傅里叶变换红外光谱仪进行红外光谱测定,扫描范围400~4 000 cm,分辨率为2 cm,分析HVRP的有机官能团。
1.3.7 刚果红染色实验
取100 μL(1 mg/mL)HVRP溶液与100 μL利用不同浓度NaOH溶液溶解的刚果红溶液(80 μmol/L)混合加入96 孔板中,在200~700 nm范围内,利用紫外-可见分光光度计扫描测定溶液的最大吸收波长。
1.3.8 抗氧化活性的测定
参照相应试剂盒说明书测定并计算HVRP对DPPH自由基、羟自由基和超氧阴离子自由基的清除率。
1.3.9 HVRP对-BHP诱导HepG2细胞氧化应激损伤的保护作用分析
1.3.9.1 细胞培养和分组
HepG2细胞接种于完全培养基(含10% FBS+1%青霉素-链霉素双抗的DMEM培养基)中,在37 ℃、5% CO培养箱内进行培养,定期更换培养基,至对数生长期用于后续实验。
取对数生长期的HepG2细胞,调整浓度至1×10个/mL,以每孔2 mL接种于6 孔板,实验分为正常组、模型组、阳性对照组和5、25、100 μg/mL HVRP组(即HV5、HV25、HV100组)。正常组常规培养;模型组加入终浓度为220 μmol/L的-BHP溶液培养细胞2 h,建立氧化损伤模型;阳性对照组和HVRP组先分别使用含100 μg/mL NAC和5、25、100 μg/mL HVRP的培养液培养24 h,再用含终浓度220 μmol/L-BHP的培养液刺激细胞2 h。
1.3.9.2 MTT法测定HepG2细胞存活率
HVRP对细胞存活率的影响分析:将HVRP分别稀释至0(空白组)、6.25、12.5、25、50、100、200 μg/mL。调整HepG2细胞悬液浓度至1×10个/mL,以每孔100 μL接种于96 孔板,在37 ℃、5% CO培养箱中培养48 h。每孔再加入100 μL不同质量浓度的HVRP溶液,培养48 h后,进行MTT染色,测定570 nm波长处吸光度。按式(2)计算细胞相对存活率。以细胞相对存活率表征细胞活力。

式中:为空白组吸光度平均值;为给药组吸光度平均值。
-BHP对细胞存活率的影响分析:按上述方法处理HepG2细胞,每孔加入100 μL不同浓度(0、100、200、300、400、500、600 μmol/L)的-BHP溶液刺激细胞,培养2 h后测定570 nm波长处的吸光度。按式(2)计算细胞相对存活率。
1.3.9.3 HepG2细胞中ROS水平及抗氧化酶活力的测定
参照试剂盒说明书测定细胞上清液中ROS相对水平,MDA、GSH含量及CAT、SOD、GPx活力,除ROS水平外,以上指标结果均以蛋白质量计。
1.3.9.4 RNA提取与实时荧光定量PCR
用TRIzon试剂从HepG2细胞中提取总RNA,用PrimeScriptRT-PCR试剂盒合成cDNA,利用实时荧光定量PCR检测系统定量,分析HVRP对Keap1/Nrf2/ARE通路和HepG2细胞相关基因mRNA表达的影响。具体引物序列如表2所示。基因相对表达量利用2法计算。
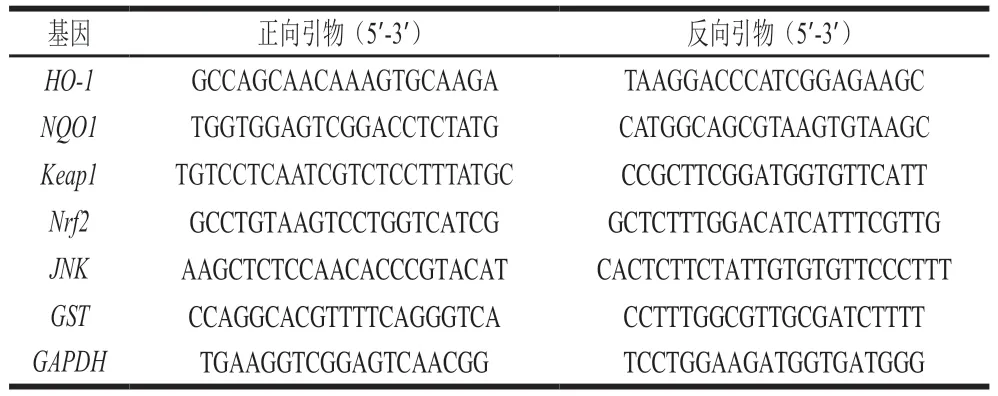
表2 引物序列Table 2 Primer sequences used in this study
1.3.9.5 蛋白质免疫印迹分析
提取胞浆蛋白及核蛋白,用BCA蛋白浓度试剂盒定量,十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDSPAGE)分离后转移到聚偏二氟乙烯(polyvinylidene fluoride,PVDF)膜上。用含5% BSA的TBST缓冲液(三乙醇胺缓冲盐水溶液(Tris buffered saline,TBS)+Tween 20)封闭过夜,室温孵育一抗2 h,用TBST缓冲液清洗5 次,然后在室温下孵育二抗2 h,用TBST缓冲液清洗5 次后滴加增强型化学发光(enhanced chemiluminesce,ECL)试剂,使用生物分子成像仪和ImageJ软件对结果进行灰度分析。
1.4 数据统计与分析
所有实验重复3 次,结果以平均值±标准差表示。采用Design-Expert V 10.0.7.0软件进行响应面试验设计与数据处理。用GraphPad Prism 7.0软件作图,SPSS 23软件进行数据分析,多组间比较采用单因素方差分析,<0.05表示差异显著,<0.01表示差异极显著。
2 结果与分析
2.1 单因素试验结果
料液比、提取温度和提取时间对多糖提取率的影响如图1所示,当料液比为1∶30时,提取率达到最大;随提取温度的升高,提取率先增加后下降,80 ℃时提取率达到最大;随提取时间延长,提取率先增加后下降,在2 h时提取率最大。当提取温度超过80 ℃、时间超过2 h时,多糖受到持续高温的影响会分解,从而导致提取率降低。

图1 料液比(A)、提取温度(B)、提取时间(C)对HVRP提取率的影响Fig. 1 Effects of material-to-solvent ratio (A), extraction temperature (B), and extraction time (C) on the extraction efficiency of HVRP
2.2 响应面优化试验分析结果
2.2.1 响应面试验设计与结果分析
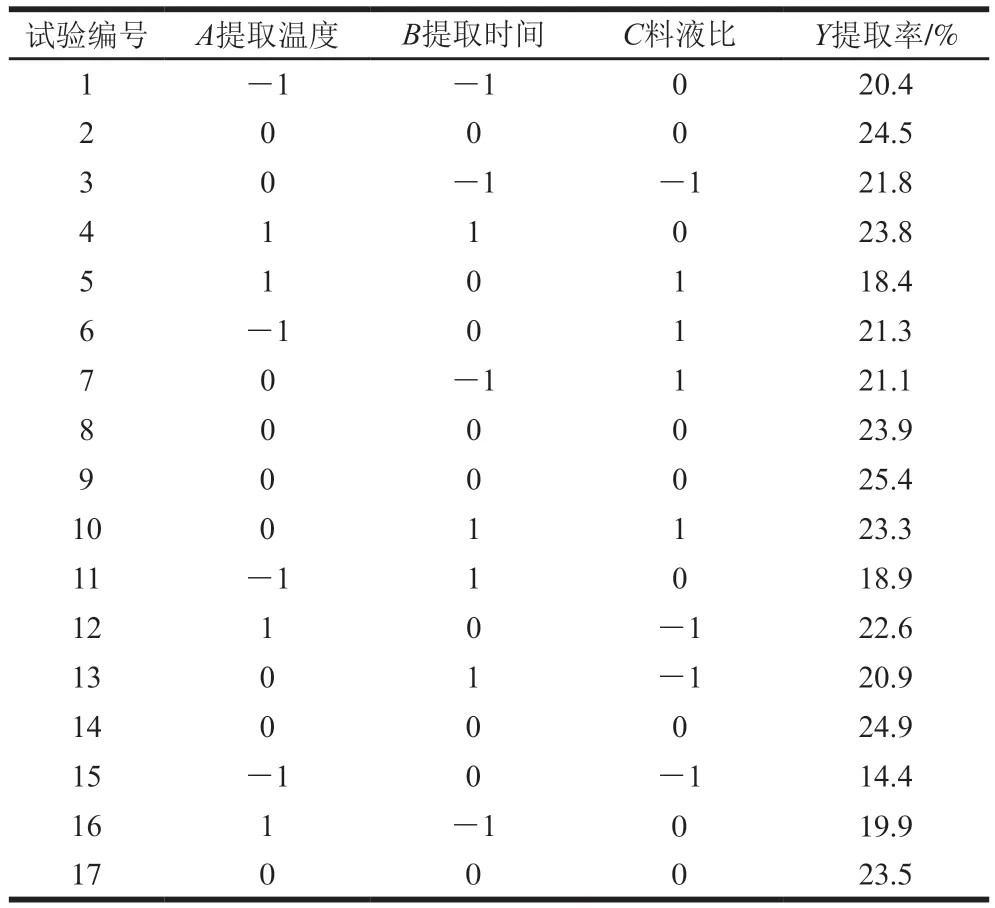
表3 响应面试验设计与结果Table 3 Experimental design and results for response surface analysis
根据表3的结果,利用Design-Expert软件对试验数据进行多元回归拟合,得到二次多项回归模型方程:=24.44+1.21+0.46+0.55+1.35-2.77+0.78-3.15-0.55-2.12。
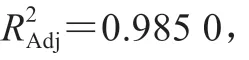

表4 回归模型方差分析结果Table 4 Analysis of variance of quadratic polynomial model
2.2.2 最佳提取工艺的确定及验证
模型分析HVRP最佳提取工艺条件为提取温度83.63 ℃、提取时间2.92 h、料液比1∶30.60,预测提取率24.9%。根据实际情况调整工艺为提取温度84 ℃、提取时间3 h、料液比1∶31,HVRP提取率为23.9%,误差1%,表明该模型可行性较高。
2.3 HVRP理化性质
经脱脂、脱蛋白处理后HVRP提取率为9.29%。测得HVRP中还原性糖的质量分数为11.17%(111.66 mg/g),蛋白质量分数为0.6%(5.96 mg/g),糖醛酸含量较高,质量分数为12.31%(123.12 mg/g)。研究表明,利用咔唑法测定东北玉簪多糖中的糖醛酸质量分数为20.36%~52.76%;百合多糖中糖醛酸质量分数达12.89%。
2.4 HVRP结构特征分析结果
由图2A可知,HVRP的红外光谱在3 422 cm处有1 个强吸收峰,是由O—H伸缩振动引起的;2 916 cm处吸收峰为C—H伸缩振动;1 745、1 634、1 446 cm处吸收峰为C=O对称和不对称拉伸振动引起,表明HVRP中存在糖醛酸,与理化分析结果一致;1 088 cm处的吸收峰为吡喃环的醚键所引起,表明HVRP可能为吡喃糖;813、614 cm处的吸收峰表明其可能含有型糖。
如图2B所示,随着NaOH浓度增加,HVRP与刚果红试剂作用后的最大吸收波长不断减小,较刚果红未发生红移,最大吸收波长的连续下降可能是因为HVRP在水溶液中为无规卷曲构象,且氢键不断被碱性溶液破坏。由此判断,HVRP不存在三螺旋构象。
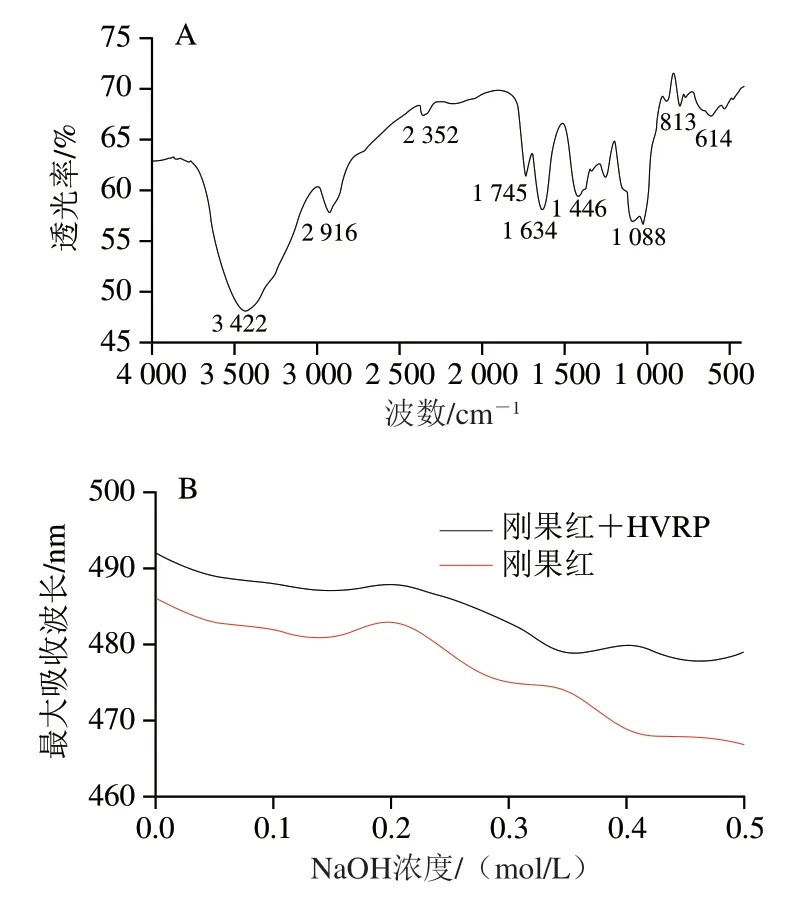
图2 HVRP的傅里叶变换红外光谱(A)和刚果红实验结果(B)Fig. 2 Fourier transform infrared spectrum (A) and Conge test results (B) of HVRP
2.5 HVRP的体外抗氧化活性
由图3可知,随HVRP质量浓度增大,其抗氧化活性先升高后趋于稳定,呈一定的剂量效应关系,在HVRP质量浓度为100 μg/mL时,DPPH自由基清除率为63.93%,羟自由基清除率为70.31%,超氧阴离子自由基清除率为83.45%。HVRP表现出较强的体外抗氧化能力,其抗氧化活性可能与HVRP中含有一定的糖醛酸有关。
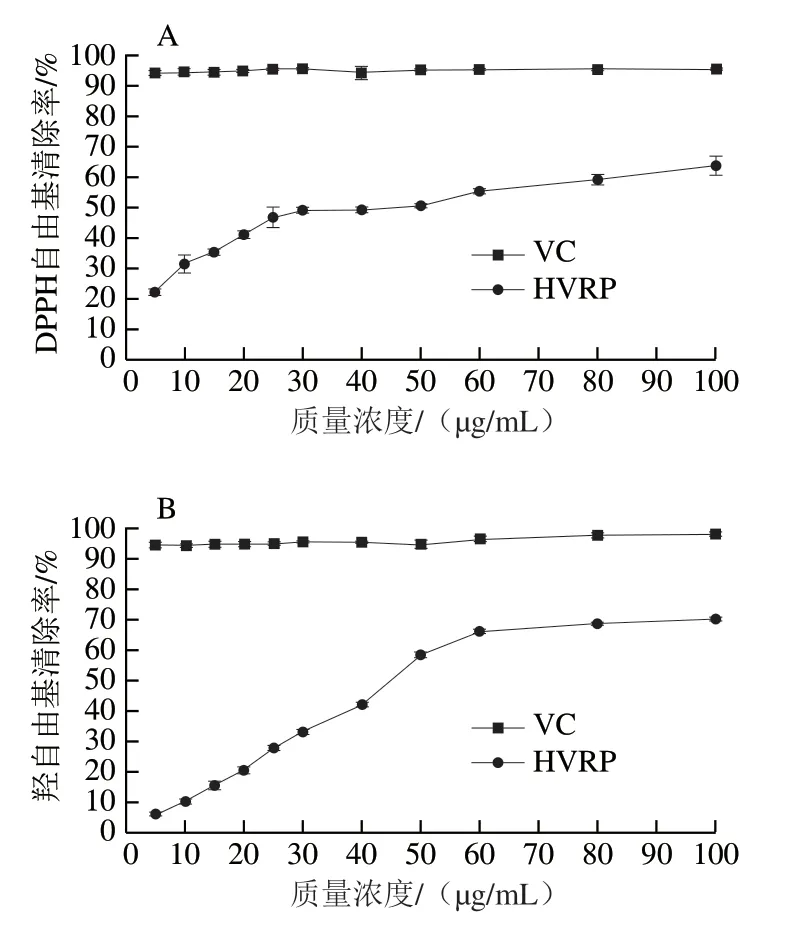
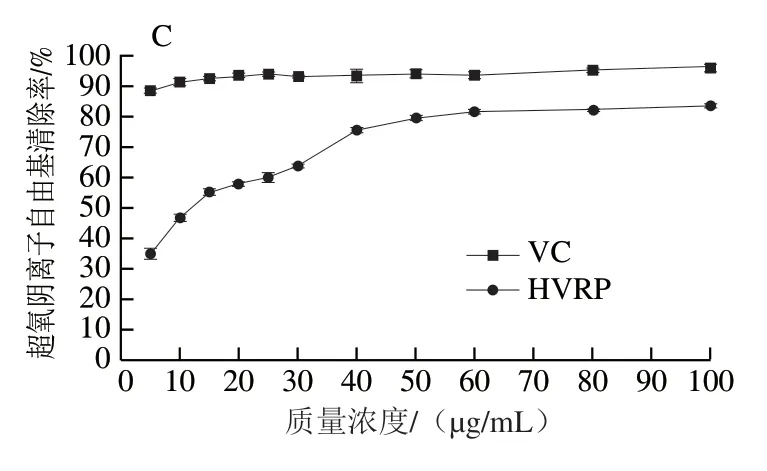
图3 HVRP对DPPH自由基(A)、羟自由基(B)、超氧阴离子自由基(C)的清除率Fig. 3 DPPH (A), hydroxyl (B), and superoxide anion radical (C)scavenging capacity of HVRP
2.6 HepG2细胞存活率
采用MTT法检测HVRP的细胞内毒性,如图4A所示,0~100 μg/mL HVRP对HepG2细胞的生长无毒性,当质量浓度为200 μg/mL时,HepG2细胞活力受到抑制。因此,选取5、25、100 μg/mL进行细胞实验。
为了考察HVRP对肝细胞氧化损伤的作用机制,采用-BHP建立氧化损伤模型。如图4B所示,HepG2细胞活力随-BHP浓度的增加明显下降。通过GraphPad Prism 7.0软件进行拟合,得到-BHP作用的半抑制浓度(half maximal inhibitory concentration,IC)为(217.52±20.94)μmol/L。因此,选取浓度220 μmol/L的BHP建立细胞氧化损伤模型。

图4 HVRP(A)和t-BHP(B)对HepG2细胞活力的影响Fig. 4 Effect of HVRP and t-BHP on cell viability in HepG2 cells
2.7 HVRP对氧化损伤细胞抗氧化能力的影响
大量产生的ROS和GSH的消耗会引起机体的氧化应激,机体受到氧化刺激后,抗氧化酶系统能够进行自我修复和调整,从而减少对细胞的氧化损伤。由图5A可知,-BHP作用于HepG2细胞后,ROS生成量是正常组的4.65 倍。HVRP处理能够极显著降低ROS水平,HV100组ROS水平降低至正常组的1.27 倍。如图5B~F所示,与模型组相比,HVRP能显著或极显著降低MDA含量,显著或极显著提高SOD、CAT和GPx活力并增加GSH含量。以上结果说明HVRP能够通过提高氧化损伤细胞的抗氧化酶活力、降低ROS水平来帮助细胞抵御氧化损伤。
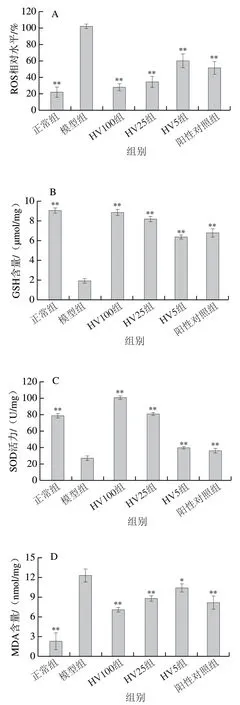
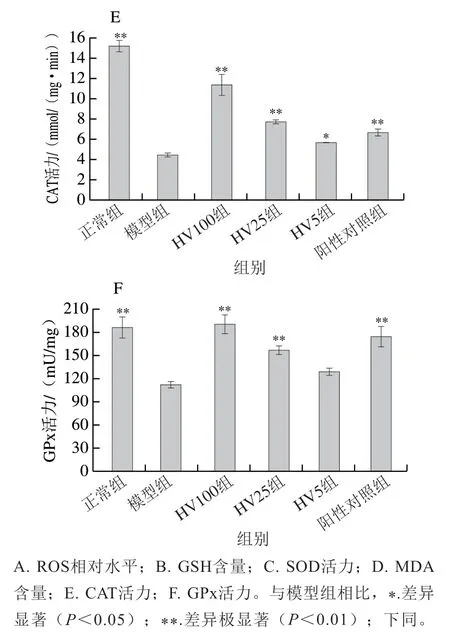
图5 不同浓度HVRP对t-BHP诱导的HepG2细胞抗氧化酶活力和ROS生成量的影响Fig. 5 Effects of different concentrations of HVRP on antioxidant enzyme activities and ROS production in t-BHP-induced HepG2 cells
2.8 HVRP对氧化损伤细胞中Keap1/Nrf2/ARE信号通路基因表达量的影响
Keap1/Nrf2/ARE信号通路是细胞应对氧化损伤的重要抗氧化途径。由图6可知,与模型组相比,HVRP处理总体上可明显上调氧化应激通路中、、、、、基因的表达,当HVRP处理质量浓度为25 μg/mL时,以上基因的表达量极显著上调,其中抗氧化信号通路下游基因、、表达量分别为模型组的4.36、4.67、5.28 倍。
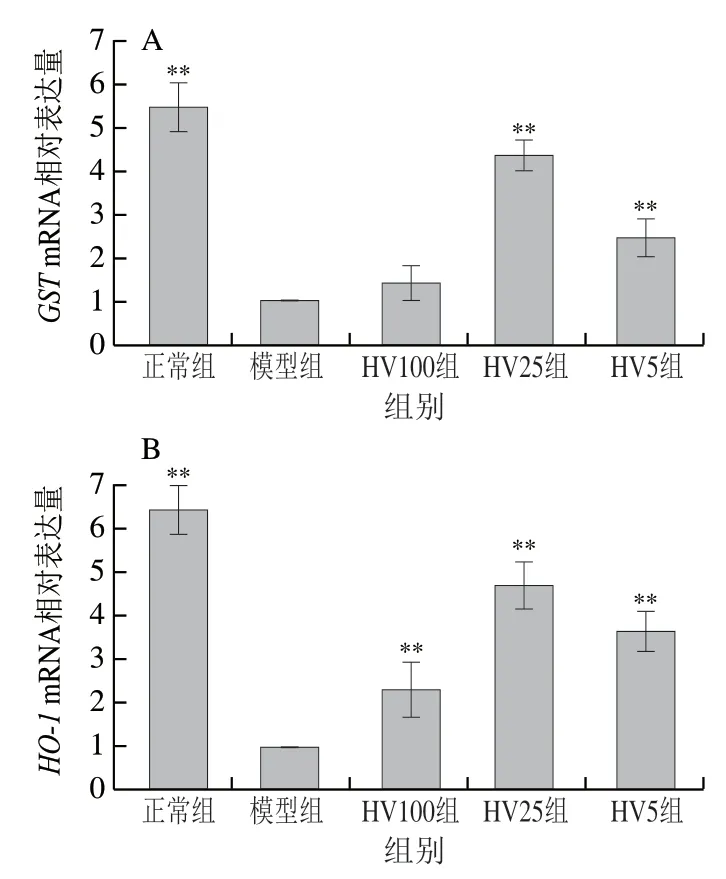
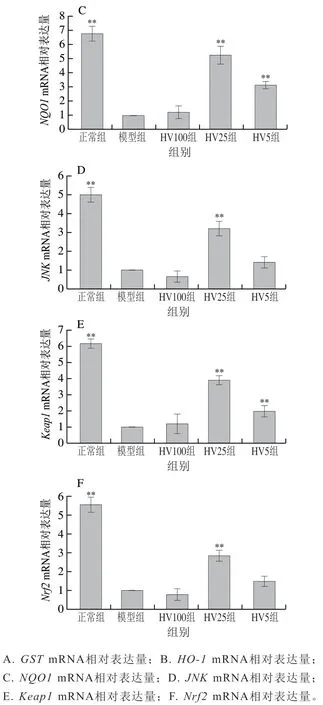
图6 HVRP对HepG2细胞氧化应激基因表达的影响Fig. 6 Effect of HVRP on the expression of genes associated with oxidative stress in HepG2 cells
2.9 HVRP对氧化损伤细胞中Keap1/Nrf2/ARE信号通路蛋白表达量的影响
为进一步验证HVRP的抗氧化作用机制,采用Western Blot检测相关蛋白表达情况,与基因表达结果相似,HVRP组较模型组明显提高了Nrf2/ARE通路下游NQO1、HO-1蛋白表达水平(图7A)。
Nrf2的核转移是诱导NQO1和HO-1表达的关键步骤,HVRP处理使细胞质内Nrf2水平呈剂量依赖型降低趋势,而细胞核内Nrf2水平呈剂量依赖型升高,表明HVRP能促进Nrf2的核转移(图7B);与模型组相比,HVRP处理提高了Nrf2/ARE通路上游激酶p-JNK/JNK水平(图7C)。上述结果与文献[32]结果相似,提示JNK磷酸化可能会促进Nrf2核转移,从而调控Nrf2/ARE通路下游II期解毒酶NQO1和HO-1的表达。
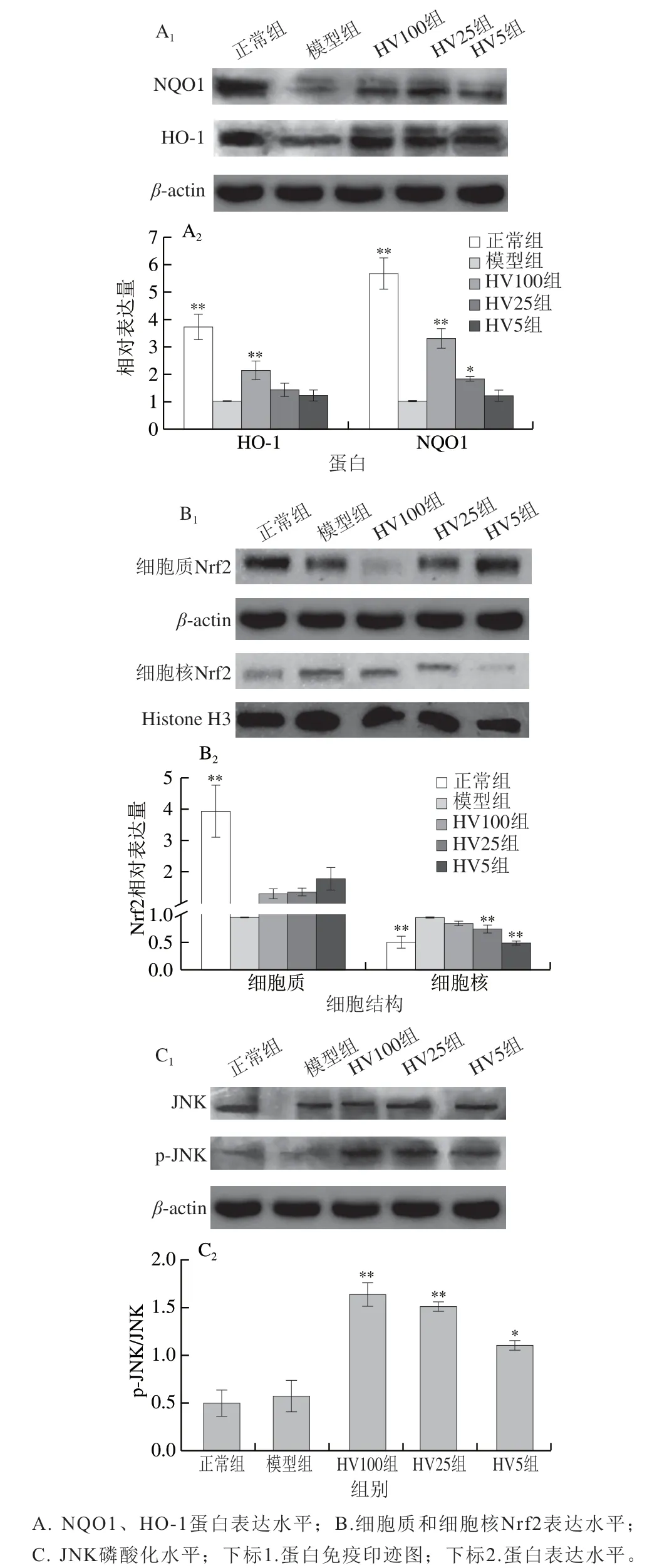
图7 HVRP对HepG2细胞Nrf2/ARE通路氧化应激相关蛋白表达的影响Fig. 7 Effect of HVRP on the expression of oxidative stress-related proteins in Nrf2/ARE signaling pathway in HepG2 cells
3 讨 论
ROS自由基引发的氧化应激是多种肝脏疾病发生的基础。Keap1/Nrf2/ARE信号通路作为机体内重要的抗氧化信号通路,能够诱导抗氧化蛋白的表达,从而增强机体的抗氧化损伤能力。Nrf2是细胞氧化应激通路中最重要的转录因子,受Keap1调控,在正常生理状态下,Nrf2与Keap1在细胞质内处于结合的非活性状态,通过泛素蛋白酶降解保持动态平衡,当细胞受到刺激时,机体出现氧化应激状态,Nrf2与Keap1发生解偶联,Nrf2激活并跨膜入核,与小Maf蛋白结合形成异二聚体,识别抗氧化反应元件ARE,进而启动下游II相解毒酶和抗氧化酶的表达。相关研究表明,调节Keap1/Nrf2/ARE信号通路可能与肝癌的治疗有重要关联。
研究证实,多糖能通过参与调节Keap1/Nrf2/ARE信号通路起到改善氧化应激损伤等作用。阿里红多糖能通过调节Nrf2/ARE信号通路提高机体抗氧化损伤作用;海带多糖能够通过激活Nrf2信号通路改善放射诱导的氧化应激损伤和炎症反应;海藻多糖能提高抗氧化蛋白的表达、促进Nrf2的核转移,并通过激活Nrf2/ARE信号通路改善MRC-5细胞的氧化应激状态;从羊栖菜中提取的多糖能通过JNK与Nrf2相互作用激活Nrf2/ARE信号通路,并启动Nrf2下游相关抗氧化和解毒酶基因的表达,进而提高机体抗氧化能力,延缓小鼠的衰老进程。为了明确HVRP的抗氧化机制,本实验研究了HVRP对Keap1/Nrf2/ARE信号通路的调节作用。结果显示,HVRP能显著或极显著降低细胞内ROS水平和MDA含量、提高抗氧化酶(CAT、SOD、GSH、GPx)活性,并且对Keap1/Nrf2/ARE信号通路中关键因子的基因和蛋白表达有显著的调节作用;JNK作为Nrf2/ARE通路的上游激酶,可能对Nrf2/ARE信号通路的激活具有一定的促进作用,而HVRP处理有提高JNK磷酸化的趋势,这些结果均表明HVRP对-BHP诱导HepG2细胞氧化应激损伤的保护作用与Keap1/Nrf2/ARE信号通路的调节有关,具体机制可能是HVRP通过诱导JNK蛋白磷酸化,促使细胞质内的Nrf2与Keap1解离,促进Nrf2转入核内,进而与抗氧化反应元件ARE序列结合,启动II相解毒酶(HO-1、NQO1、GST)和抗氧化酶的转录表达,最终提高HepG2细胞抗氧化能力。
4 结 论
本实验优化了HVRP提取工艺,得到最优提取条件为:提取温度84 ℃、提取时间3 h、料液比1∶31,该条件下HVRP提取率为23.9%。体外抗氧化实验表明HVRP具有较强的自由基清除活性。抗氧化机制研究证明了HVRP通过激活氧化应激Keap1/Nrf2/ARE信号通路起到保护HepG2细胞免受-BHP诱导的氧化损伤作用。综上,本研究可为HVRP作为天然抗氧化剂在功能性食品中的开发应用提供科学依据。
