超声波辅助酸/碱溶解等电点沉淀法提取鸡架分离蛋白的组成及其凝胶特性
2022-09-30田金河王艳婕周亚旗王书丽王利平
田金河,王艳婕,周亚旗,蔺 芳,王书丽,王利平
(1.新乡学院生命科学与基础医学学院,河南 新乡 453003;2.河南科技学院生命科技学院,河南 新乡 453003)
我国是鸡肉生产与消费大国,在日常生产与消费过程中会产生大量副产物鸡架。传统的机械采肉及水解方式无法充分利用鸡架蛋白,鸡架常被用于生产饲料或直接丢弃,造成资源浪费和环境污染。
酸/碱溶解等电点沉淀(isoelectric solubilization/precipitation,ISP)法可用于从水产原料、低值禽肉中提取肉类蛋白,具有工艺简单、蛋白回收率高以及保持蛋白凝胶特性等优点。Zhao Xue等采用ISP法提取PSE(pale, soft and exudative)鸡肉蛋白,发现蛋白二级结构发生明显变化,相比PSE鸡肉糜具有更好的凝胶形成能力(储能模量增大)。Li Xin等采用碱溶ISP法制备的鹅肝分离蛋白表现出良好的凝胶形成能力以及持水性。ISP法能有效降低PSE肉体系中的促氧化成分如脂类、色素及肌红蛋白等含量,使蛋白在氧化条件下产生更少的羰基衍生物和席夫碱,从而改善PSE肉蛋白的氧化稳定性。高强度超声(high intensity ultrasound,HIU)是一种利用空化与微射流效应有效提高生物质提取效率的绿色环保方法。Álvarez等采用HIU辅助ISP法提取马鲛鱼分离蛋白,所得蛋白提取率较高。
肉鸡胴体分割后,仍有少量鸡肉附着于鸡架,由于鸡骨纤细复杂,造成这些蛋白不易分离。采用盐溶法提取肉类蛋白耗时较长(24 h),且蛋白不易富集分离(蛋白质量浓度约20~30 mg/mL)。ISP法适于从结构复杂的原料中提取蛋白,如磷虾和鱼排加工副产物等,具有耗时短(约30 min)、提取蛋白含量高(100 mg/g以上)的优势。但目前鲜见ISP法用于提取鸡架蛋白的报道。作为肉鸡加工行业的大宗副产物,鸡架的高值开发利用可大幅提升行业利润,减少蛋白资源浪费。本实验利用HIU辅助ISP法,以鸡架为原料提取分离蛋白(protein isolate,PI),研究不同酸/碱溶解及HIU辅助条件下鸡架PI组成及其凝胶特性,以期为鸡架的高值化利用提供理论数据参考。
1 材料与方法
1.1 材料与试剂
鸡胸肉、鸡架(白条鸡去除内脏、胸肉、鸡翅、鸡腿、鸡爪、头尾后所剩骨架,于-5 ℃保存) 洛阳六合惠泉食品有限公司。
实验所用化学试剂均为分析纯及以上等级。
1.2 仪器与设备
HLQ-8斩拌机、HFM型绞肉机 安徽华菱西厨装备股份有限公司;TKLD-650L速冻机 广东南海太康制冷设备有限公司;Neofuge18R台式高速冷冻离心机上海力申科学仪器有限公司;FJ-200高速分散均质机上海标本模型厂;JN-IID超声波细胞破碎仪宁波新芝生物科技股份有限公司;T6紫外-可见分光光度计北京普析通用仪器有限责任公司;FiveEasy Plus pH计/LE438电极 瑞士Mettler Toledo公司;Invitrogen电泳分离系统(Mini Gel Tank)、NuPAGE 4%~12% Bis-Tris蛋白预制梯度胶板(厚1.0 mm、12 孔) 美国赛默飞科技公司;TA.XTC质构仪 上海保圣实业发展有限公司;PQ001台式核磁共振分析仪 上海纽迈电子有限公司;NH310色差计 深圳市三恩时科技有限公司;QUANTA FEG 250电子扫描显微镜 美国FEI公司。
1.3 方法
1.3.1 原料处理
将鸡架斩拌为粒径小于1 cm的颗粒,绞碎(直径3 mm孔板)2 次制成鸡架糜,分装入聚乙烯样品袋,速冻机30 min内冻结至-30 ℃以下,后转移至-80 ℃冰箱内保存。
1.3.2 鸡架蛋白溶解特性测定
鸡架糜在4 ℃条件下过夜解冻,以质量比1∶7加入4 ℃蒸馏水,高速均质(均质头直径15 mm、20 000 r/min、2 min)得到匀浆液。加入碱液(2 mol/L NaOH溶液)或酸液(2 mol/L HCl溶液)分别调节匀浆液pH值至2.0~12.0(以0.5为梯度),待pH值稳定后继续搅拌5 min,将匀浆液离心(4 ℃、12 000×、10 min,记为第1次离心),取中间层,采用双缩脲法,以牛血清白蛋白为标准品,测定蛋白质量浓度,以蛋白质量浓度最小的pH值作为鸡架蛋白表观等电点。
1.3.3 HIU处理
为研究HIU对PI提取效率以及PI凝胶特性的影响,在第1次离心前对鸡架匀浆液进行HIU处理。将超声波发生器变幅杆(直径18 mm)浸入鸡架匀浆液(约320 mL)10~20 mm,在20 kHz、900 W、60%振幅条件下以工作3 s、间歇2 s的模式处理3 min。HIU处理期间通过冰水浴控制匀浆液温度在4 ℃以下。根据Hagenson等的方法计算得到上述HIU处理条件下的能量密度为12.6 W/cm。
1.3.4 ISP法提取PI
采用1.3.2节方法,调节鸡架匀浆液pH值至3.0或11.5,并对匀浆液离心(4 ℃、12 000×、10 min),取中间层蛋白溶液调节pH值至鸡架蛋白表观等电点后进行第2次离心(4 ℃、12 000×、10 min),所得沉淀即为PI,于4 ℃以下保存。酸溶或碱溶以及是否通过HIU处理所得的PI样品分别以酸溶PI(PI3.0H、PI3.0)以及碱溶PI(PI11.5H、PI11.5)表示。采用GB 5009.5—2016《食品安全国家标准 食品中蛋白质的测定》(凯氏定氮法)分别测定对照(鸡胸肉)、鸡架、第1次离心沉淀和各PI样品中的蛋白含量。
1.3.5 PI组成分析
参考田金河等的方法稍作改动,采用十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfatepolyacrylamide gel electrophoresis,SDS-PAGE)分析所提取的PI组成。将凝胶置于缓冲溶液(8 mol/L脲素、20 mmol/L Tris、2%(质量分数)SDS、2%(体积分数)巯基乙醇,pH 8.0)中,以200 V恒压模式电泳分离,上样量15 μg,采用Mark12蛋白标准样品(10~200 kDa)作为参照。
1.3.6 PI凝胶的制备
根据Zhao Xue等的方法稍作修改。将PI调节至pH 7.0±0.1,测得蛋白含量为100 mg/g。按质量分数1%向PI中加入NaCl,充分搅拌均匀,注入50 mL离心管,离心(500×、4 ℃、3 min)排气,然后80 ℃水浴20 min制成凝胶。凝胶自然冷却后转移至4 ℃冰箱隔夜保存。以1.3.1节相同方法获取鸡胸肉糜直接制备的凝胶作为对照。
1.3.7 凝胶特性测定
采用CIE L*a*b*色差系统,取PI凝胶光滑切面分别测定*、*、*值,平行测定3 次,结果取平均值。凝胶白度按式(1)计算。
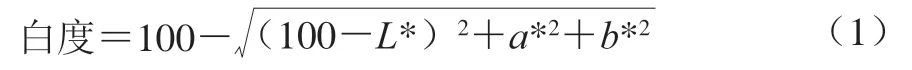
PI凝胶质构测定参考Zhao Xue等的方法。样品于室温平衡30 min后,切为圆柱形(直径25 mm、高20 mm),采用P/50探头TPA模式,两次压缩间隔1 s,测前、测中、测后速率分别为2、1、2 mm/s,记录硬度和弹性测定结果。
PI凝胶持水力测定参考Zhao Xue等的方法稍作修改。按式(2)计算蒸煮损失率。取常温凝胶样品,称质量后装入100 mL离心管(底部垫有5 层滤纸),离心(20 ℃、10 000×、10 min),再次称质量,按式(3)计算离心损失率。
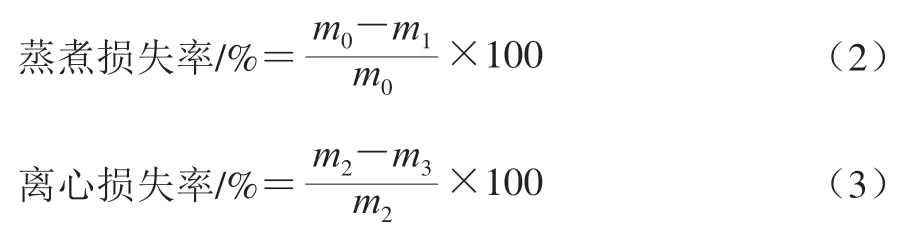
式中:为加热前凝胶质量/g;为凝胶冷却后用滤纸吸干表面水分后质量/g;为凝胶样品质量/g;为离心后凝胶质量/g。
1.3.8 低场核磁共振分析凝胶水分分布
根据计红芳等的方法稍作修改。称取约2.0 g凝胶样品放入核磁测试管(直径15 mm)内,测定水分弛豫时间。测定温度30 ℃,质子共振频率20 MHz,采样频率100 kHz,半回波时间250 μs,重复扫描16 次,扫描间隔110 ms,扫描回波数12 000,利用CPMG序列测定得到指数衰减图形,经Multi Exp Inv Analysis软件反演,得到弛豫时间峰值、峰面积比例、峰起始时间和结束时间等。
1.3.9 扫描电子显微镜观察凝胶微观结构
根据Zhao Xue等的方法稍作改动。将凝胶样品切成长方体(2 mm×4 mm×4 mm),置于4 ℃、体积分数2.5%戊二醛溶液(用0.1 mol/L磷酸钠溶液配制,pH 7.0)浸泡48 h后,0.1 mol/L磷酸钠缓冲溶液(pH 7.0)清洗3 次,再进行梯度乙醇脱水(体积分数30%~100%,8 个梯度,每个梯度15 min),乙酸异戊酯浸泡15 min,然后冷冻干燥和喷金处理(厚度约10 nm),以10 kV加速电压进行扫描电子显微镜观察。
1.4 数据处理与分析
以上指标至少重复3 次测定,计算平均值及标准差,利用SAS 8.1分析软件,采用Duncan Multiple Range进行不同样品平均值间的方差分析,确定差异显著性,置信度95%。采用Origin 8.0软件绘图。
2 结果与分析
2.1 鸡架蛋白溶解特性
由图1可知,未经HIU处理时,随着鸡架匀浆液酸/碱性逐渐增强,蛋白质量浓度逐渐增加,在pH 3.0和pH 11.5处,蛋白质量浓度分别增加至11.87 mg/mL和13.37 mg/mL,继续增强酸性或碱性,蛋白质量浓度不再有明显变化。pH 5.5时匀浆液中蛋白质量浓度最低,即pH 5.5为鸡架蛋白的表观等电点。上述溶解特性与鸡胸肉蛋白基本一致,表明肌原纤维蛋白(骨骼肌)是鸡架中的主要蛋白。HIU处理可提高匀浆液中蛋白质量浓度,HIU处理后,在pH 11.5处,蛋白质量浓度提高至14.38 mg/mL,有研究报道,马鲛鱼肉匀浆蛋白质量浓度在HIU处理后也得到显著提高。HIU促进蛋白溶解主要由于其空穴效应。这一效应的微米级物理振荡可能促进了骨骼肌与鸡骨架的分离以及肌原纤维蛋白超微结构的崩溃。根据上述结果,综合考虑PI得率、酸碱液消耗量等因素,选择pH 3.0和pH 11.5作为本实验ISP法提取鸡架PI的溶解pH值,并分别研究在pH 3.0和pH 11.5下HIU处理对PI组成以及凝胶特性的影响。

图1 不同pH值下不同处理鸡架匀浆液中蛋白质量浓度Fig. 1 Protein concentration in the homogenate of chicken ribs treated by different methods as a function of pH
2.2 蛋白样品的SDS-PAGE分析结果
如图2所示,鸡架与鸡胸肉的主要蛋白组分一致,均为肌原纤维蛋白,且鸡架SDS-PAGE图谱中较鸡胸肉新出现的4 个条带可能来源于骨骼内的胶原蛋白。与鸡胸肉相比,PI含有更多小分子质量蛋白(分子质量约14.4 kDa以及<10 kDa),可能来自于骨髓。
第1次离心沉淀的主要蛋白组分为4 种胶原蛋白、少量肌球蛋白重链(myosin heavy chain,MHC)、肌动蛋白以及小分子质量蛋白,碱溶后第1次离心沉淀与酸溶后第1次离心沉淀相比,MHC、肌动蛋白以及小分子质量蛋白条带数量减少,且HIU处理加强了减少的趋势,说明第1次沉淀中肌原纤维蛋白已经溶解并与胶原蛋白分离,碱溶和HIU处理均能促进肌原纤维蛋白溶出。
酸溶PI相对于鸡架新增3 个条带,而MHC条带明显减弱,表明MHC发生了降解,这与Marmon等的研究结果一致,可能是由鸡架附着的骨骼肌所含内源蛋白酶引起。HIU处理减弱了MHC的降解,可能是HIU抑制了蛋白酶活性。有报道称HIU会对蛋白三级甚至二级构象产生一定影响,如HIU对胰蛋白酶活性具有一定抑制作用。碱溶PI主要蛋白组成与鸡胸肉基本一致,HIU处理增加了碱溶PI中MHC和肌动蛋白含量,表明碱溶解和HIU处理均有助于鸡架中肌原纤维蛋白的溶解。
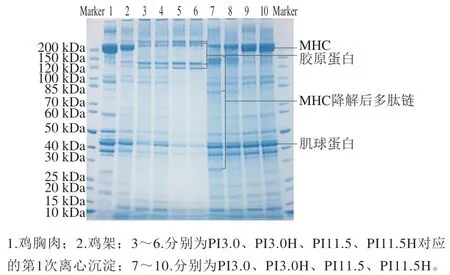
图2 鸡胸肉、鸡架、第1次离心沉淀以及PI组成SDS-PAGE分析结果Fig. 2 Sodium dodecyl sulfate-polyacrylamide gel electrophoresis of protein profiles of chicken breast, chicken ribs, first centrifugal precipitate and PI
2.3 PI凝胶质构特性
硬度和弹性是反映凝胶质构特性的主要指标。如表1所示,碱溶PI凝胶硬度和弹性显著高于酸溶PI凝胶(<0.05),原因可能在于:一方面,酸溶PI中MHC发生降解,含量减少、分子链长度缩短,影响了蛋白的交联聚集,如Chen Yichen等的研究表明蛋白酶的降解导致鳟鱼加工副产物蛋白无法形成凝胶;另一方面,碱溶处理使肌球蛋白更多的疏水基团和巯基暴露,有助于蛋白凝胶的形成。Zhao Xue等研究也发现碱溶ISP蛋白的凝胶硬度和弹性显著高于酸溶ISP蛋白。HIU处理对酸溶PI凝胶质构特性有显著改善(<0.05),可能由于HIU处理减弱了MHC的降解,但HIU处理对碱溶PI凝胶质构特性没有显著影响。此外,碱溶PI凝胶质构特性与鸡胸肉凝胶没有较大差异,表明碱溶PI保持了良好的凝胶特性。

表1 不同蛋白样品所制备凝胶的特性Table 1 Gel properties of PI and control samples
2.4 PI凝胶持水性
凝胶的蒸煮损失率反映了凝胶形成过程中的蛋白亲水与疏水特性,而离心损失率则能够反映凝胶蛋白束缚水的能力和凝胶微观结构,两者从不同角度反映凝胶的持水性。如表1所示,碱溶PI凝胶的蒸煮损失率和离心损失率均显著低于酸溶PI凝胶,与对照凝胶没有显著差异。HIU处理显著降低了酸溶PI凝胶的蒸煮损失率和离心损失率(<0.05),增强了持水性,但对碱溶PI凝胶影响不显著。凝胶的持水性主要取决于蛋白网络的致密性和完整程度及其保持水分的能力,组织均匀的三维网络具有更强的持水力。凝胶中分子化学键种类、肌浆蛋白含量等也会影响凝胶持水性。酸溶PI凝胶的持水性较差,可能是由于MHC的过度降解导致大分子间作用力减弱,无法形成致密的三维网络结构,HIU处理减弱了MHC降解程度,因而增强了酸溶PI凝胶的持水性。而碱溶PI保持了良好的持水能力,一方面由于其含有大量完整的肌球蛋白;另一方面肌球蛋白构象的展开会引起较多疏水基团和游离巯基暴露,有利于蛋白交联形成三维网络结构。
2.5 PI凝胶白度
PI凝胶白度均显著低于对照凝胶(<0.05),这是由于鸡架中骨髓含有的肌红蛋白和血红蛋白等呈色蛋白在制备PI的离心过程中沉淀(对应图2中泳道7~10底部小分子质量蛋白条带)。酸溶PI会回收少量呈色蛋白,且酸处理更易引起这类蛋白构象改变,因此酸溶PI凝胶白度较高。Panpipat和Rawdkuen等制备的酸溶PI凝胶均较碱溶PI凝胶具有更高的白度。HIU处理使酸/碱溶PI凝胶白度均显著提高,这可能是由于HIU能够引起呈色蛋白构象发生变化,使其颜色变浅、白度增加。
2.6 PI凝胶水分分布
如图3所示,凝胶样品中水分弛豫时间()存在4 类:(0~1 ms)、(1~10 ms)、(80~120 ms)以及(900~1 700 ms),分别对应蛋白大分子表面吸附水(和)、毛细管作用力束缚水(不易流动水,)以及自由水(),以各峰面积所占百分比表示不同状态水分相对含量,分别记为、、及。由表2可知,5 组样品均大于95%,表明凝胶中主要为不易流动水。未经HIU处理时,酸溶PI凝胶的、及均显著大于碱溶PI凝胶(<0.05),表明后者对水分子具有更强的结合力和束缚力,二者虽无显著差异,但考虑到酸溶PI凝胶较碱溶PI凝胶具有更大的蒸煮损失率(18.41%和12.34%),可以推测后者不易流动水实际含量要高于前者,表明碱溶PI凝胶具有更强的持水力,Zhao Xue等也得出类似结果。HIU处理使酸溶PI凝胶及均显著减小(<0.05),但对碱溶PI凝胶和均无显著影响,表明HIU处理能够显著提高酸溶PI凝胶的持水力,但对碱溶PI凝胶影响不大。对照凝胶和均显著小于PI凝胶,表明其水分吸附能力优于PI凝胶,但与碱溶PI凝胶差异不显著,结合凝胶蒸煮损失率和离心损失率,推测PI凝胶的持水机理与对照凝胶可能不同,这可能与蛋白聚集方式不同以及PI含有较多小分子质量蛋白有关。
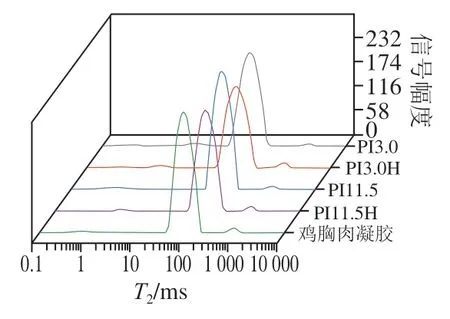
图3 凝胶水分分布规律Fig. 3 Distribution of water in gel samples
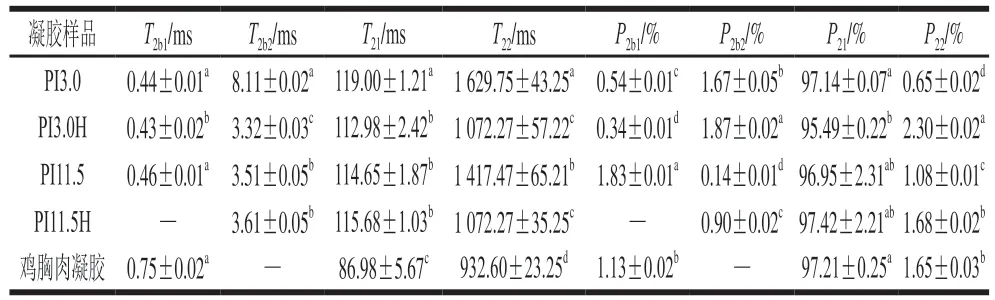
表2 凝胶样品中的水分分布及相对含量Table 2 T2 and peak area fractions of four states of water in gel samples
2.7 PI凝胶微观结构
如图4所示,未经HIU处理时,酸溶PI凝胶微观结构与碱溶PI凝胶相比,组织结构明显粗糙、孔洞大,后者则较为均匀致密,具有明显的蛋白分子交联结构,与对照凝胶接近,表明碱溶PI具有良好的凝胶形成能力,其均匀致密的凝胶结构也很好地解释了其良好的质构(硬度和弹性)和持水性。HIU处理能够显著改善酸溶PI凝胶的微观结构,表明酸溶PI凝胶微观结构较差主要是由于MHC降解。而HIU处理前后碱溶PI凝胶的微观结构均较均匀、致密,表明HIU处理对碱溶PI凝胶微观结构形成没有显著影响。对照凝胶微观结构与Shao Junjie等的研究结果非常接近,而Zhao Xue等发现酸溶PSE鸡胸肉蛋白凝胶的微观结构也较碱溶法提取蛋白凝胶更为粗糙,但具有明显的蛋白交联结构,优于本实验中酸溶PI凝胶微观结构,可能是由于MHC未发生降解。
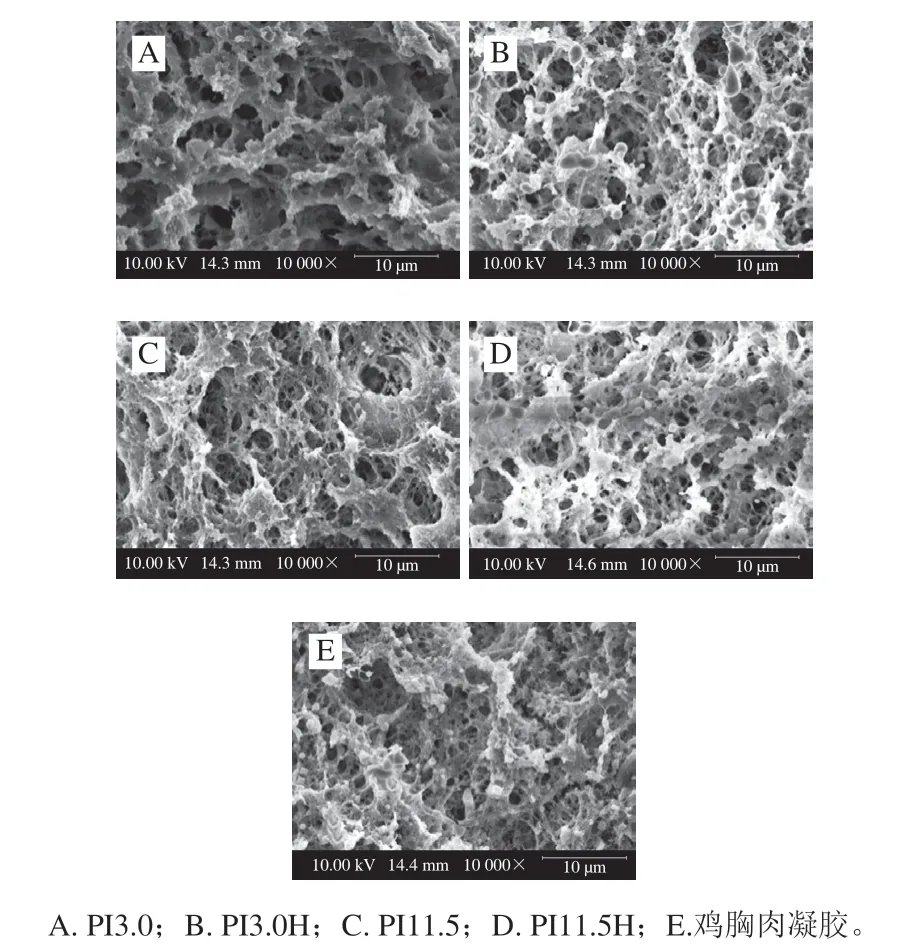
图4 PI凝胶微观结构的扫描电子显微镜图Fig. 4 Microscopic structure of gels prepared from PIs and chicken breast meat
3 结 论
ISP法能够高效提取鸡架蛋白,所得PI主要组分为肌原纤维蛋白和多种小分子质量蛋白。酸溶条件引起MHC降解并使PI凝胶特性变差,但HIU辅助能够改善这一现象。碱性PI具有良好的凝胶形成能力,凝胶质构和持水性均与对照凝胶无显著差异。HIU处理可促进碱溶条件下蛋白溶解,且不影响PI形成凝胶的能力。PI中含有较多呈色蛋白,导致其制备的凝胶白度较对照凝胶低。鸡架碱溶PI具有与鸡胸肉蛋白相当的凝胶形成能力,对鸡架这一大宗低值蛋白资源的增值利用具有重要意义。
