氧化铟改性聚丙烯酰胺复合材料吸附水中铅的研究
2022-09-29李婉君薛彦峰
李婉君 薛彦峰
(太原工业学院 化学与化工系,太原 030008)
近年来,由重金属引起的环境污染问题越来越严重,高毒性和低降解性是重金属的显著特征。铅元素是对生命体毒害最大的重金属之一,铅元素污染不仅会给生态环境带来极大的破坏,而且会对人体健康构成相当大的威胁[1-2]。因此,采取有效措施去除废水中的Pb(Ⅱ)已成为环保领域的一个重要课题。常见去除废水中Pb(Ⅱ)方法有化学沉淀法[3]、溶剂萃取法[4]、电化学法[5]、离子交换法[6]和吸附法[7-15]。在众多分离方法中,吸附法因具有低成本、高效率、易操作及环保等优点[11,16],被认为是去除废水中重金属的最有效方法之一。
在吸附法中,选择合适的吸附剂材料变得尤为重要。目前,用来作为吸附剂的材料有很多种,如活性炭[7-8]、树脂类吸附材料[9-10]、无机纳米材料[11-13]、有机聚合物材料[14-15]等。聚丙烯酰胺材料是一类具有三维交联网络结构的有机聚合物,其优点为传质速度快、负载量大和再生能力强[17]。由于聚丙烯酰胺含有酰胺基,其对重金属离子的吸附来自于酰胺基水解产生的羧基与重金属离子的相互作用[18-19]。然而,聚丙烯酰胺材料在一些有机溶剂中存在收缩或溶胀现象,导致其再生能力和机械稳定性均较差[20],阻碍了其在吸附分离方面的应用。
近来,以无机纳米材料改性复合材料的制备技术发展迅速,这些改性的复合材料具有特殊的化学基团、大的比表面积、良好的再生能力和强的机械稳定性等优点[21]。纳米氧化铟作为无机纳米材料,具有立方结构,被称为具有c型稀土氧化物结构[22]。在质子溶剂中,纳米氧化铟表面上的羟基可以与Pb(Ⅱ)、Zn(Ⅱ)和Cu(Ⅱ)相互作用[23]。由于其具有活性吸附位点多、粒径均匀、比表面积大和孔隙率高等优点,纳米氧化铟可以在吸附去除重金属方面得到显著的应用。
本工作以纳米氧化铟改性聚丙烯酰胺复合材料(简称为In2O3MPAC)作为吸附剂,与火焰原子吸收分光光度计联用,研究了对Pb(Ⅱ)的吸附性能。探讨了实验操作条件对Pb(Ⅱ)吸附率的影响,详细研究了In2O3MPAC吸附Pb(Ⅱ)的吸附动力学、热力学和等温线。
1 材料与方法
1.1 材料与仪器
主要材料:硝酸铅的纯度为99.99%;纳米氧化铟的纯度为99.99%,其粒径<50 nm;丙烯酰胺、亚甲基双丙烯酰胺、甲醇、十二醇、二甲亚砜、偶氮二异丁腈、硝酸和氢氧化钠均为分析纯。铅标准溶液储备液(1 000 μg/mL)是通过溶解硝酸铅配制得到,标准工作液是通过标准储备液逐级稀释配制得到,每天需新配。实验用水均为超纯水。
主要仪器:电子天平(CP214奥豪斯,上海)、数字酸度计(pHS-3C雷磁,上海)、恒温振荡器(SHA-C国华,常州)、循环水真空泵(SHZ-D Ⅲ予华,巩义)、电热恒温鼓风干燥箱(PHG-90304精宏,上海)、数控超声波清洗器(KQ-50DB超声,昆山)、纯水系统(Milli-Q SP密理博,美国)、原子吸收分光光度计(FAAS,TAS-990普析通用,北京)、扫描电子显微镜(SEM,JSM-6700F JEOL,日本)、N2吸附-脱附仪(JW-BK132F精微高博,北京)、热重分析仪(TGA 4000 PerkinElmer,美国)。
1.2 实验方法
1.2.1 In2O3MPAC的合成
将聚合反应液(包含纳米氧化铟90.0 mg、丙烯酰胺60.0 mg、亚甲基双丙烯酰胺140.0 mg、偶氮二异丁腈1.0 mg、二甲亚砜620 mg和十二醇435 mg)超声8 min混匀,通入N25 min去除系统内的气体,再加热70 ℃ 反应9 h。得到的产物用溶剂甲醇超声充分洗涤,过滤干燥后,得到In2O3MPAC,作为吸附剂备用。若聚合反应液不包含纳米氧化铟90.0 mg,而其他的处理过程和反应条件不变,则得到单纯的聚丙烯酰胺。
1.2.2 SEM表征
利用扫描电镜观察聚丙烯酰胺和In2O3MPAC的内部微观结构。
1.2.3 N2吸附—脱附表征
利用N2吸附—脱附仪分别测定聚丙烯酰胺材料和In2O3MPAC的平均孔径及Brunauer-Emmett-Teller(BET) 比表面积。待测定的材料在表征前需要在120 ℃条件下真空干燥12 h。
1.2.4 热重分析表征
采用热重分析仪在N2的保护下升温速度为10 ℃/min分别测定聚丙烯酰胺材料和In2O3MPAC的热学性能。
1.2.5 吸附实验
称取10 mg 的In2O3MPAC,加入到初始浓度为10 mg/L、pH值为6、10 mL Pb(Ⅱ)溶液中,在293.15 K下振荡100 min。吸附完成后,取吸附后的上层液用0.45 μm滤膜过滤后,用火焰原子吸收光谱(FAAS)法测定Pb(Ⅱ)浓度。吸附率(%)和吸附量(qe,mg/g)分别用公式(1)和(2)计算得到。
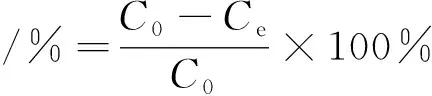
(1)
(2)
其中V为Pb(Ⅱ)溶液的体积,mL;m为In2O3MPAC的质量,mg;Co和Ce分别为起始和平衡时Pb(Ⅱ)浓度,mg/L。
1.2.6 再生能力实验
将吸附着Pb(Ⅱ) 的In2O3MPAC用超纯水洗涤后,转移到放有10 mL HCl溶液(0.1 mol/L)的具塞刻度试管中,恒温振荡后,取上层液,通过FAAS测定Pb(Ⅱ)浓度。
1.2.7 FAAS测定Pb(Ⅱ)的工作条件
在吸附实验和再生能力实验中用FAAS测定溶液中Pb(Ⅱ)的浓度。波长283.3 nm,灯电流10.0 mA,光谱带宽0.7 nm,燃烧器高度5 mm,乙炔流量2.0 L/min,空气流量15.0 L/min。
2 结果与分析
2.1 复合材料吸附剂的表征
图1为聚丙烯酰胺和In2O3MPAC的SEM图。从图1B可以看出In2O3MPAC具有高度交联的均匀大孔网络结构。对比图1A和1B,可以明显看出In2O3MPAC的微球尺寸和孔径要比聚丙烯酰胺的小。说明纳米氧化铟增加了In2O3MPAC的机械性能,纳米氧化铟被引入到聚丙烯酰胺微球表面。

图1 聚丙烯酰胺(A)和In2O3MPAC(B)的SEM图Figure 1 SEM micrographs of polyacrylamide(A) and In2O3MPAC(B).
利用N2吸附—脱附仪通过吸附数据计算出In2O3MPAC的BET比表面积为97.5 m2/g,平均孔径为29.2 nm。而聚丙烯酰胺的的BET比表面积为29.8 m2/g及其平均孔径为317.9 nm,说明纳米氧化铟的引入使In2O3MPAC的比表面积增大且孔径减小。
聚丙烯酰胺和In2O3MPAC的热重分析图如图2所示。对比聚丙烯酰胺和In2O3MPAC的热重曲线可知,聚丙烯酰胺有两个失重阶段,分别为40~200 ℃和350~450 ℃;而In2O3MPAC的两个失重阶段分别为140~200 ℃和370~420 ℃;In2O3MPAC的失重温度范围均比聚丙烯酰胺的窄。此外,In2O3MPAC失重后的剩余质量为2.26 mg,而在相同温度范围内聚丙烯酰胺失重后的剩余质量趋近于0 mg。因此,氧化铟的加入提高了复合材料的热学稳定性。
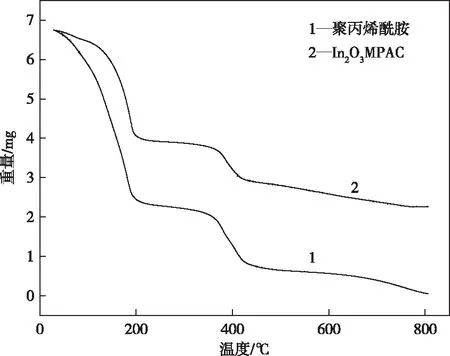
图2 聚丙烯酰胺和In2O3MPAC的热重分析图Figure 2 TGA curves of polyacrylamide and In2O3MPAC.
2.2 pH值对吸附的影响
pH值对Pb(Ⅱ)吸附的影响如图3所示。从图3中可以看出,随着pH值的增大,吸附率明显增大;当pH值大于6.0时,吸附率接近平衡。这是由于在低pH值时吸附剂含有的羧基和羟基被溶液中氢离子质子化,导致吸附剂对Pb(Ⅱ)的吸附能力较弱。随着pH值的增大,羧基和羟基对Pb(Ⅱ)的配位作用逐渐增强。然而当pH值过大时,Pb(Ⅱ)倾向于沉淀而不利于吸附。因此选择溶液pH值为6.0。
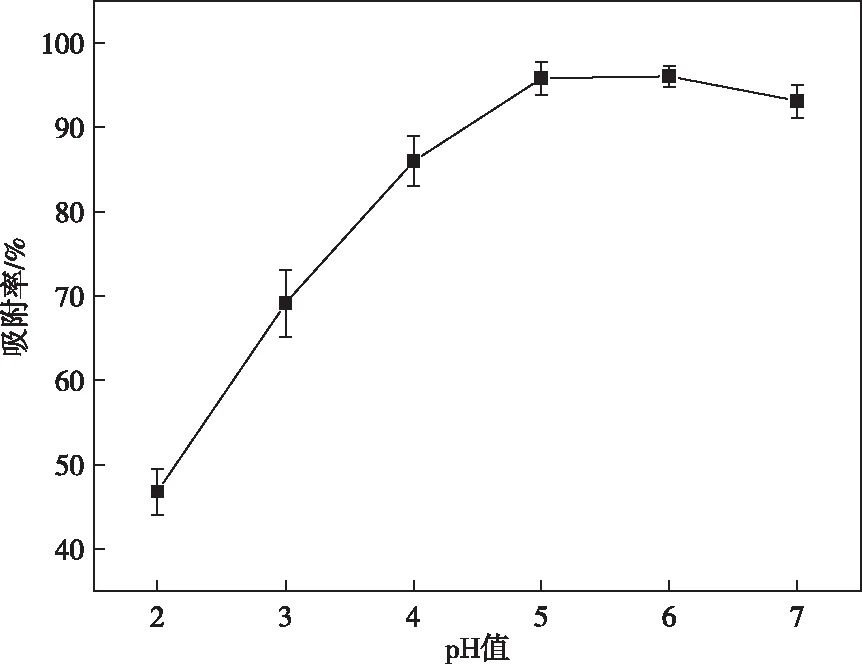
图3 pH值对Pb(Ⅱ) 吸附的影响Figure 3 Effect of pH on the adsorption of Pb(Ⅱ).
2.3 吸附动力学
考察了振荡时间对Pb(Ⅱ)吸附的影响。从图4可以看出,随着振荡时间的延长,吸附率是先增大;当振荡时间为100 min时,Pb(Ⅱ)的吸附基本达到平衡;继续增加振荡时间,吸附率没有明显变化。这是因为在振荡初期,吸附剂具有相当大的孔隙和相当多的羧基和羟基,随着振荡时间的增加,吸附剂孔隙逐渐被Pb(Ⅱ)占据,而吸附剂上羧基和羟基与Pb(Ⅱ)的相互作用逐渐达到饱和,因而吸附率不再发生明显变化。为此选择的吸附时间为100 min。
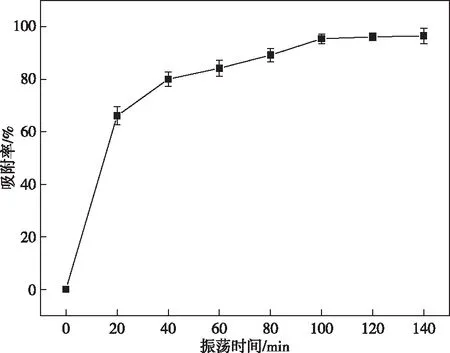
图4 振荡时间对Pb(Ⅱ) 吸附的影响Figure 4 Effect of contact time on the adsorption of Pb(Ⅱ).
为了探讨该吸附行为的动力学规律和速控步骤,分别用拟一级动力学和拟二级动力学方程来拟合吸附数据。拟一级动力学方程如公式(3)所示:
(3)
其中t代表时间,min;qe和qt分别代表平衡时和t时In2O3MPAC对Pb(Ⅱ)的吸附量,mg/g;k1代表拟一级动力学方程常数,min-1。
拟二级动力学方程如公式(4)所示:
(4)
其中k2代表拟二级动力学方程常数,g/(mg·min)。
拟一级动力学和拟二级动力学方程的拟合结果示于表1和图5、6。分析拟合结果可知,拟二级动力学方程的相关性系数(R2)更高,In2O3MPAC吸附Pb(Ⅱ)的过程更加符合拟二级动力学方程。说明吸附速率主要受初始浓度的影响,为化学吸附[13]。

表1 吸附动力学方程拟合结果Table 1 Kinetic parameters for the adsorption of Pb(Ⅱ) onto In2O3MPAC
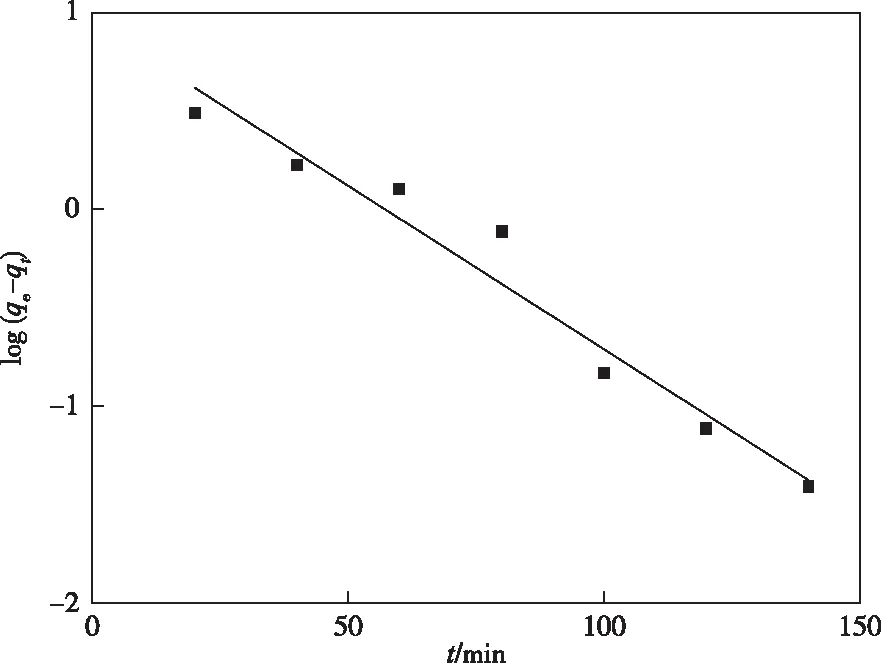
图5 拟一级动力学方程Figure 5 Pseudo-first-order kinetics plot for the adsorption of Pb(Ⅱ) onto In2O3MPAC.
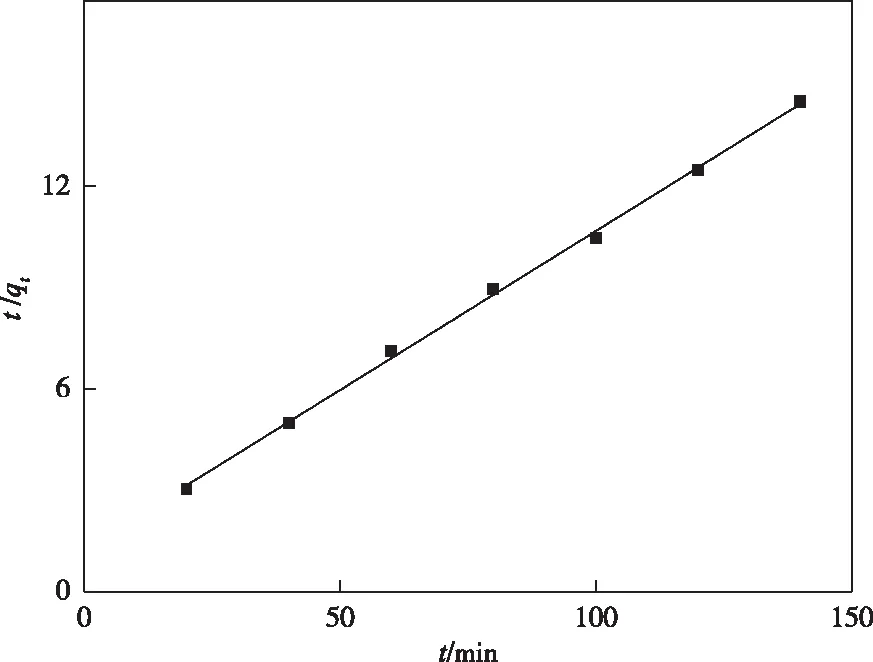
图6 拟二级动力学方程Figure 6 Pseudo-second-order kinetics plot for the adsorption of Pb(Ⅱ) onto In2O3MPAC.
2.4 吸附等温线
吸附等温方程是用来描述初始浓度与吸附量之间的关系,Langmuir和Freundlich方程是最常用的吸附方程。(Pb(Ⅱ)初始浓度为5~50 mg/L),Langmuir方程如公式(5)所示:
(5)
式中Ce代表平衡浓度,mg/L;qe代表吸附量,mg/g;qmax代表单分子层最大吸附量,mg/g;b代表Langmuir等温吸附常数,L/mg。
Freundlich方程如公式(6)所示:
(6)
式中K和n表示经验常数。
图7和8分别为In2O3MPAC吸附Pb(Ⅱ)的Langmuir和Freundlich方程。两种方程的拟合结果示于表2,从中可以看出,Freundlich方程的相关性系数更接近1,因此,该吸附过程更加符合Freundlich方程。
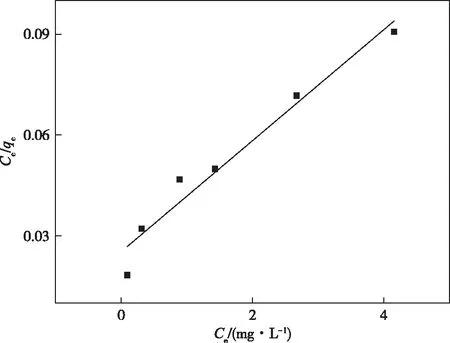
图7 Langmuir方程Figure 7 The Langmuir isotherm for the adsorption of Pb(Ⅱ) onto In2O3MPAC.
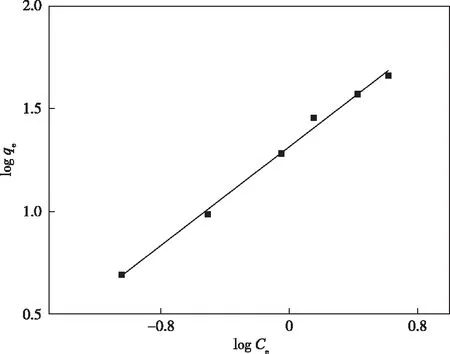
图8 Freundlich方程Figure 8 The Freundlich isotherm for the adsorption of Pb(Ⅱ) onto In2O3MPAC.

表2 吸附等温线拟合结果Table 2 Parameters of the Langmuir and Freundlich isotherms for Pb(Ⅱ) adsorption
2.5 吸附热力学
热力学参数ΔG、ΔH和ΔS分别由公式(7)~(9)求得:
(7)
ΔG=-RTlnKd
(8)
(9)
其中R表示理想气体常数,为8.314 5 J/(mol·K);T表示热力学温度,K;Kd表示热力学平衡常数。
In2O3MPAC吸附Pb(Ⅱ)的热力学方程如图9所示。当热力学温度为293.15 K时,ΔG=-8.38 kJ/mol,ΔH=23.90 J/mol,ΔS=109.90 J/(mol·K)。ΔG小于0,说明该吸附是自发进行的过程;ΔH大于0,说明该吸附是吸热过程;ΔS大于0,说明该吸附是熵增加的过程。
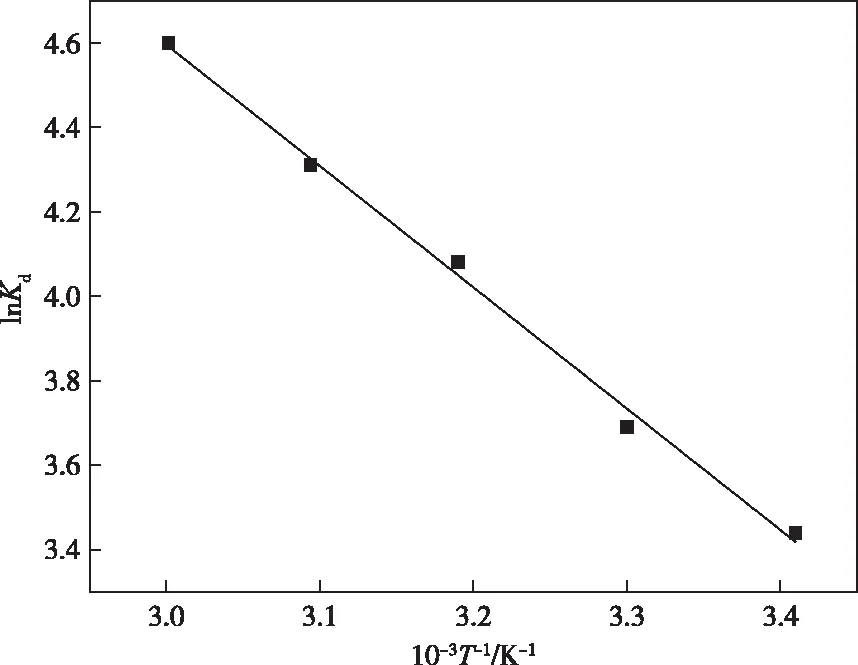
图9 吸附热力学方程Figure 9 The thermodynamic equation for the adsorption of Pb(Ⅱ) onto In2O3MPAC.
2.6 In2O3MPAC的再生能力
In2O3MPAC的再生能力结果示于表3。从表3中可以看出,连续吸附及解吸实验三次后,In2O3MPAC对Pb(Ⅱ)的吸附量基本无变化,且解吸率保持在87%以上,说明In2O3MPAC作为吸附剂具有良好的再生能力。
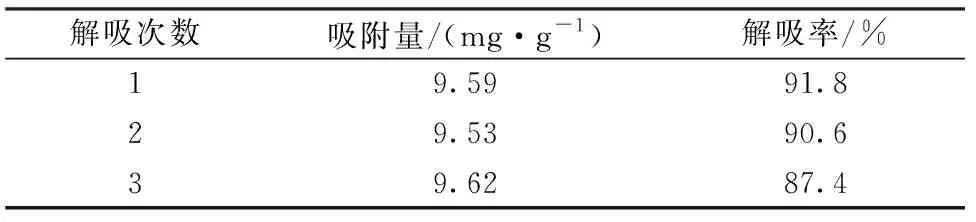
表3 解吸次数对吸附量和解吸率的影响Table 3 Adsorption and desorption cycles for Pb(Ⅱ)
3 结论
采用In2O3MPAC作为吸附剂,结合火焰原子吸收分光光度光谱法,研究了In2O3MPAC对Pb(Ⅱ)的吸附性能。实验结果表明,当溶液pH值=6.0时,吸附率最大,振荡吸附 100 min以后吸附率无明显变化;In2O3MPAC对Pb(Ⅱ)的吸附行为符合拟二级动力学方程和Freundlich方程;热力学研究证明了In2O3MPAC对Pb(Ⅱ)的吸附是自发吸热过程;对In2O3MPAC进行了再生能力的考察,表明In2O3MPAC可实现重复利用。综上所述,In2O3MPAC吸附剂在去除重金属方面有广阔的应用前景。
