基于UHPLC-MS/MS的药用植物内源性激素含量检测方法及黄花蒿不同器官激素的测定*
2022-09-29李姝诺高守红陈军峰崔莉莉刘艳平陈万生
李姝诺,高守红,陈军峰,陈 枭,崔莉莉,刘艳平,陈万生,**
(1. 上海中医药大学中药研究所中药资源与生物技术中心 上海 201203;2. 海军军医大学附属长征医院 上海 200003)
植物激素是指植物通过自身代谢产生、在低浓度下就能产生明显生理效应的有机信号分子。目前植物激素主要包括茉莉素、生长素、水杨酸、细胞分裂素、油菜素甾醇、赤霉素(Gibberellins, GAs)、脱落酸、乙烯、独脚金内酯及多肽类激素[1]。植物激素不仅在调节植物生长发育以及抵抗外界胁迫中起着关键作用[2-4],在植物合成次生代谢产物方面也发挥着重要作用[5],因此,研究植物组织中内源性植物激素含量的测定技术具有重要意义。部分植物激素具有不稳定性、对介质温度和周围环境敏感的特点[6],从植物中检测出痕量激素的含量、种类存在挑战[7],在方法学上主要体现在提取、纯化和检测3 个方面。目前应用最广泛的提取方法是溶剂提取法,甲醇因其较强的渗透性可以渗透到植物细胞中,是植物激素提取的首选溶剂[8]。在纯化方面主要有液液萃取、固相萃取及免疫纯化三种方式,其中固相萃取极大的简化了植物激素的前处理过程,应用较广泛的主要包括反相C18柱、Oasis HLB柱、混合模式柱等[9-10]。在检测分析方面有免疫分析、电化学分析以及色谱质谱联用等方法[9],在本文中构建的植物激素检测方法采用的是常用的色谱质谱联用的检测方式。
青蒿为菊科蒿属一年生草本植物黄花蒿(Artemisia annuaL.)的干燥地上部分,青蒿味苦、辛,性寒,具有清热解毒的功效[11]。黄花蒿特异生成的青蒿素在疟疾治疗中发挥着核心作用[12]。青蒿素的合成累积发生在青蒿叶片的分泌性腺毛中,多种植物激素被发现对青蒿素的生物合成途径具有调控作用[13-14],还可直接或间接调控腺毛的发育[15],又或是建立不同激素信号通路间的调控网络,如生长素可抑制黄花蒿中赤霉素甲基-D-赤藓醇磷酸盐(2-c-methyl-derythritol 4-phosphate,MEP)合成途径的关键酶1-脱氧-D-木酮糖-5-磷酸还原异构酶(1-deoxy-Dxylulose-5-phosphate reductoisomerase,DXR),使得青蒿素在开花期、营养期的产量降低,进而影响青蒿素的产量[16]。可见,激素的调控作用是青蒿素合成途径及黄花蒿生长发育机制的重要方向,然而,如何对黄花蒿中种类众多的激素实现高效精准的检测成为了相关研究的技术瓶颈。
本研究以黄花蒿为例,旨在尽量减少前处理过程时间的同时检测在青蒿素合成中起重要作用的相关内源性植物激素。目前,国内发表的植物激素检测方法所检测到的种类大多较少,如基于高分辨率质谱技术对于微藻胞间植物激素的检测共测定到6种植物激素[10];朱莉莉等人基于HPLC-MS/MS 技术同时测定植物6种内源激素[17];贾鹏禹构建了在大豆中4种植物激素的检测方法[18]。近来于国外发表的植物激素检测的方法所检测到的激素种类繁多,但前处理过程存在时间较长或是操作较为繁琐的待改进之处[19-20]。据此,本研究通过比较优化不同的提取纯化方式,构建了可同时测定16 种植物内源性激素的UHPLC-MS/MS 检测方法,并以此方法对青蒿的根、茎和叶的内源性激素水平进行精确定量。
1 材料
1.1 仪器
Agilent 1290-6460A 超高效液相色谱-串联质谱仪,包括G4220A 二元高压泵、G4226A 自动进样器、G1330B 控温箱、G1316C 柱温、Mass Hunter 数据处理工作站B.06.00(美国Agilent公司);BSA124S-CW 型天平、CPA225D 型天平(德国Sartorius 公司);Eppendorf Centrifuge 5430 R 离心机(德国Eppendorf 公司),多样品自动浓缩仪(上海力德生物科技有限公司),超声仪(上海科导超声仪器有限公司),多样品冷冻研磨仪(上海万柏生物有限公司),Waters 固相萃取仪(美国Waters公司)。
1.2 试剂与材料
质谱级甲醇和乙腈(MERCK 德国),甲酸(国药集团化学试剂有限公司),标准品及内标见表1,Waters HLB 6cc(200 mg)固相萃取小柱,Waters WAX 3cc(60 mg)固相萃取小柱,Waters WCX 3cc(60 mg)固相萃取小柱。黄花蒿(上海交通大学沪蒿1号)。

表1 标准品信息
2 方法
2.1 标准品配制
分 别 精 密 称 取GA1、GA3、GA4+7、GA4、GA8、GA9、GA20、GA34、ABA、IAA、IPR、IP、tZR、tZ、JA-L-ILE、JA标准品及内标华法林约5.00 mg,置于5 mL 容量瓶中,用质谱级甲醇溶解定容,即得1.00 mg·mL-1标准品及华法林的甲醇溶液,分装放置-20℃保存备用,使用时用甲醇稀释上述标准品贮备液配置成混合标准品溶液,GA1、GA3、GA4+7、GA4、GA9、GA34、ABA、IPR、JA 浓度为50 ng·mL-1,GA8浓度为100 ng·mL-1,tZ、IAA、GA20浓度 为200 ng·mL-1,IP 浓度 为2 ng·mL-1,tZR 浓 度为210 ng·mL-1,JA-L-ILE 浓度为20 ng·mL-1。华法林使用时以50%乙腈稀释储备液至200 ng·mL-1。
2.2 前处理方法优化
在植物激素提取方面,Šimura J 等人经过详尽的考察提出50%乙腈提取效果好,并采取4℃过夜提取,而构建植物激素检测方法不仅要保证在提取纯化过程中保持低温状态,还要使得整个样品制备的时间尽量缩短[21],因此本文考察了50%乙腈分别4℃过夜提取及4℃超声提取1 h 的植物激素提取方式,根据检测的峰面积结果,最终确定50%乙腈4℃超声提取1 h 的提取方式。
通过比较不同纯化方式[19-20]对纯化方式继续优化,通过比较回收率选定更高回收率的纯化方式。取新鲜植物待测组织,用清水冲洗干净,于液氮中速冻,称取200 mg 速冻样品于离心管中,加入2 颗小钢珠与1 mL 冰浴的50%乙腈水(含有200 ng·mL-1的华法林)溶液,用多样品冷冻研磨仪充分研磨。研磨后的样品浑浊液冰浴超声1 h。样品经过超声提取后,用高速离心机在4℃下12 000 r·min-1离心30 min。离心后,将上清液吸入新的离心管中备用。
2.2.1 HLB固相萃取小柱纯化方式
依次用2 mL 纯甲醇,2 mL 超纯水,2 mL 50%乙腈水溶液通过HLB 固相萃取小柱(200 mg,6 cc),活化并平衡萃取小柱。将样品上清液加入固相萃取小柱,分三次加入3 mL 30%乙腈水溶液进行洗脱。将样品上清流出液与洗脱液合并后4℃氮气吹干后,于200 μL 30%乙腈水溶液复溶。
2.2.2 WCX与WAX固相萃取小柱纯化方式
用2 mL 纯甲醇、2 mL 超纯水、2 mL 50%乙腈水溶液依次通过WCX和WAX固相萃取小柱对其进行活化平衡。将样品上清液加入固相萃取小柱后用1.2 mL 90%甲醇进行洗涤。至此,将WCX 和WAX 萃取小柱分离。WAX 萃取小柱用2 mL 5%甲酸水溶液洗涤,1.5 mL 甲醇洗脱IAA、ABA、JA、GAs;WCX 萃取小柱依次用1.5 mL 含有2%甲酸的5%甲醇、1.5 mL 5%甲醇、1.5 mL 甲醇洗涤,最后用1.5 mL 含有5%氢氧化铵的80%甲醇洗脱细胞分裂素(cytokinin,CKs)。将两种含有不同成分的洗脱液分别在4℃下用氮气吹干。用200 μL 40%甲醇水溶液对WAX 萃取小柱的洗脱部分进行复溶,用200 μL 20%甲醇水溶液对WCX 萃取小柱的洗脱部分进行复溶。

图1 混合标准品MRM色谱图
2.3 色谱-质谱条件
2.3.1 色谱条件
分 别 考 察Agilent Eclipse XDB-C18(3.5 μm,2.1 mm×150 mm)、Agilent ZORBAX SB-C18(3.5 μm,2.1 mm×100 mm)、Agilent ZORBAX SB-CN(3.5 μm,2.1 mm×100 mm)、Agilent ZORBAX Eclipse plus C18(3.5 μm,2.1 mm×100 mm)、Agilent Poroshell 120 EC-C18(2.7 μm, 3.0×150 mm)、Agilent Poroshell 120 EC-C18(2.7 μm, 4.6×100 mm)、Agilent Poroshell 120 SB-C18(2.7 μm, 2.1×75 mm)、Waters XbridgeTMHILIC(3.5 μm,2.1 mm×100 mm)、Waters Amide®(3.5 μm,2.1 mm×100 mm)色谱柱对16 个待测成分含量测定的影响,当色谱柱为Agilent Poroshell 120 EC-C18(2.7 μm, 3.0×150 mm)时,16 个待测成分和内标的峰形以及分离度最佳;分别考察水-乙腈、0.05%甲酸-乙腈、0.1%甲酸-乙腈、2mM 醋酸铵-乙腈、5mM 醋酸铵-乙腈、0.05%甲酸-甲醇流动相对16 种成分含量测定的影响,最终确定采用0.05%甲酸(A)-乙腈(B)梯度洗脱的响应及峰形较好;16种植物激素分正负两套方法分开进行梯度洗脱,负离子模式:0-11 min,73%-23%A;体积流量为0.3 mL·min-1;正离子模式:0-8 min,95%-59% A;8-8.05 min,59%-5% A;8.05-12 min,5%A;流速为0.4 mL·min-1;柱温35℃(正/负离子模式);样品盘温度4℃;进样量10 μL。
2.3.2 质谱条件
电喷雾离子源(electrospray ionization,ESI);多反应检测模式(multiple reaction monitoring,MRM);离子化电压为4500 V(正/负离子模式),脱溶剂气温度350℃,脱溶剂气体积流量为12 L·min-1,喷雾气压为45 psi;数据处理用仪器所配定量软件进行分析,各种激素的质谱参数见表2。

表2 16种植物激素的多反应监测优化参数
2.4 方法学考察
2.4.1 专属性
分别精密取植物样品溶液和标准品的混合溶液、对照品溶液以及空白溶剂10 μL 进行专属性检测分析。
2.4.2 线性范围及定量下限
按照“2.1”的方法配制混合标准品溶液,加甲醇稀释制成14 种浓度梯度的标准曲线工作溶液。混合标准品标准曲线工作溶液由低到高记为Q1-Q14,GA8使 用Q6-Q12,GA1、GA3、GA4+7、GA20、GA34、JA、ABA、IAA、tZ 使用Q3-Q14,GA4、GA9、JA-L-ILE 使用Q6-Q14,tZR 使用Q1-Q12,IP、IPR 使用Q1-Q14,按上述色谱质谱条件进行分析,并用仪器所配定量软件计算各化合物浓度的线性回归方程。
2.4.3 加样回收率
取植物样本经“2.2”项下方法提取,提取上清液混合后分成12 份500 μL,取“2.1”项下配制的混合标准品,分别稀释成高、中、低三组不同浓度标品工作液各3 份,每份500 μL。将植物激素提取上清液和混合标准品的混合液以及植物激素提取上清液分别经过“2.2.1”项下条件处理并将测定的含量分别记为S 和S1,未经处理的混合标准品测定的含量记为S0,计算回收率R=(S-S1)/S0*100%。
2.4.4 稳定性
同一植物样本不能涵盖所有内源性植物激素[22-23],故在此采用混合标准品进行考察稳定性。取高、中、低三种浓度的标准品溶液各3 份,分别放置0 h,6 h,12 h 后测定其稳定性。计算各组稳定系数(以RSD表示),以考察分析方法的稳定性。
2.4.5 精密度
取高、中、低三种浓度的混合标准品溶液各一份,按照“2.3”项下条件分别连续进针6 次。计算16 种植物激素峰面积的RSD值,以考察日内精密度。
2.4.6 重复性
取同一份植物样品溶液(6 个植物样本分别经提取后混合成1份植物样品溶液),与混合标准品溶液混合后按“2.2.1”项下方法平行制备6 份,按“2.3”项下质谱与色谱条件进行测定,通过峰面积计算RSD。
2.5 黄花蒿不同器官植物激素含量的测定
分别取上海黄花蒿新鲜根、茎、叶,其中重点关注的茎和叶各取三批植物样本,每批植物样本分别取三个生物学重复样品,根取三个生物学重复,参照“2.2.1”项下方法进行激素提取并参照“2.3”项下方法进行检测。
3 结果
3.1 纯化方式的优选
参照“2.2”项下方法考察两种固相萃取方法的回收率,利用HLB 固相萃取小柱纯化方式的回收率为52.54%-105.39%,利用WCX-WAX 固相萃取小柱纯化方式的回收率为22.64%-82.99%,HLB 固相萃取小柱纯化方式的回收率在50%以上,回收率良好。根据考察结果最终选用回收率更高,用时更短的HLB 固相萃取纯化的方法(表3)。

表3 两种纯化方式回收率比较(n=3)
3.2 方法学考察
3.2.1 专属性
参照“2.4.1”方法对16 种植物内源性植物激素进行方法专属性考察,混合标准品的色谱图见1。负离子模式下共检测12 个植物内源性激素,共需11 min,各内源性激素及内标化合物在检测过程中不存在明显干扰,分离度良好;正离子模式下共检测4个植物内源性细胞分裂素,在8 min 时完成细胞分裂素的检测,因内标化合物的检测,共需12 min,各内源性激素及内标化合物在检测过程中分离度良好,表明该方法专属性良好[24]。
3.2.2 线性范围及定量下限
参照“2.4.2”的方法进行线性范围及定量限的考察,16种测定的植物激素的浓度与峰面积呈良好的线性关系[24],r值均大于0.99(表4)。

表4 各植物激素检测线性及定量下限
3.2.3 加样回收率
参照“2.4.3”的方法进行加样回收率的考察,通过计算12 个内源性激素的回收率在70.97%-113.77%,其中IAA 和tZ 的回收率分别在中浓度时为61.53%和高浓度时为52.76%,GA9和IP 的回收率在52.04%-66.55%之间,回收率均在50%以上(表5),该方法回收率良好[19]。

表5 16种植物激素加样回收率(n=3)
3.2.4 稳定性
参照“2.4.4”的方法,分别在0 h,6 h,12 h 进行稳定性考察,6h时各内源性激素的稳定性范围在3.06%-13.60%,12 h时各内源性激素的稳定性范围在5.16%-14.89%。RSD 值均小于15%(表6),表明该方法稳定性良好[25]。

表6 16种植物激素的稳定性与精密度

续表
3.2.5 精密度
参照“2.4.5”进行日内精密度的考察,日内精密度RSD 值见表6,RSD 值范围在0.81%-11.35%,均小于12%,表明仪器精密度良好[25]。
3.2.6 重复性
结果显示,GA1、GA3、GA4+7、GA4、GA8、GA9、GA20、GA34、ABA、IAA、IPR、IP、tZR、tZ、JA-L-ILE、JA 16种化学成分的峰面积RSD 分别为4.08%、2.09%、2.79%、1.57%、5.27%、6.31%、1.27%、2.62%、1.58%、3.87%、1.42%、8.10%、2.67%、8.31%、1.58%、3.99%,表明该方法重复性良好[24]。
3.3 黄花蒿不同器官植物激素含量的测定
取黄花蒿的新鲜根、茎、叶器官利用上述方法进行激素检测,在不同器官中共检测到8 种激素(图2),并且呈现显著的含量差异(图3)。所有检测到的激素浓度范围在0-38 ng·mg-1,与已知的植物中激素含量水平相近[17,26],进一步证明本检测方法的准确性。结合所测叶与茎的三批样本平均值与根的三个生物学重复样品平均值,所有激素在样本中的含量水平检测结果表明IAA 在根中含量最高;ABA、IPR、tZ、JA、JAL-ILE 在叶中含量最高;tZR、IP 在茎中含量最高。各批次青蒿茎与叶中的激素含量与根中的激素含量相比,其差异结果见图3。结果显示不同批次中各激素含量水平差异较大,这可能与样本采集时的发育阶段相关,第一批样本采集时期为青蒿苗期阶段,第二批和第三批样本为青蒿成熟时期采集。

图2 青蒿不同器官激素检测色谱图
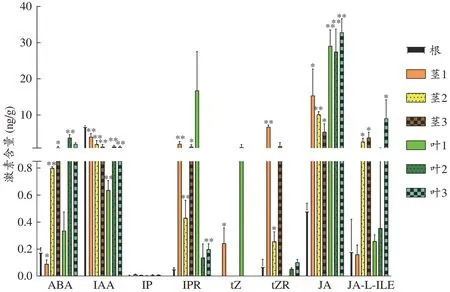
图3 青蒿不同器官激素含量(±s,n=3)
4 讨论
样品提取是开展植物内源激素检测的最关键步骤。由于植物激素本身在细胞内累积水平极低,需要对样品进行富集才能达到检测浓度。目前,植物激素的纯化主要有液液萃取、固相萃取及免疫纯化三种方式,本研究主要考虑了固相萃取及液液萃取。利用液液萃取时,植物激素纯化效率不高且难以克服乳化现象[27-28],故采取固相萃取的方式进行纯化。植物样品的纯化多使用C8、HLB、MCX、WAX、MAX 等固相萃取柱的单用和联合使用[19-20,29-31]。我们通过对HLB 单用及WCX、WAX 联用两种方法进行比较优化,根据考察结果选用HLB 固相萃取纯化的方法。对于分析条件方面,本实验分别采用了负、正离子扫描模式对单个植物激素标准品的质谱响应进行初步考察,结果表明GA1、GA3、GA4+7、GA4、GA8、GA9、GA20、GA34、ABA、IAA、JA、JA-L-ILE 在负离子模式下灵敏度高;IP、IPR、tZR、tZ 在正离子模式下灵敏度高;分别进行了流动相和色谱柱的考察,结果表明流动相0.05%甲酸-乙腈梯度洗脱,色谱柱为Agilent Poroshell 120 EC-C18 (2.7 μm,3.0×150 mm)时待测成分的响应及峰形较好、分离度最佳。
与已报道的以作物为研究对象的植物内源检测方法相比[28],本研究针对药用植物的激素提取方法和激素种类,增加了茉莉酸的活性形式JA-L-ILE 以及更多的赤霉素种类(表2),与已发表的植物内源激素检测方法相比,本方法对前处理过程进行了精简[19-20],经过色谱条件优化,可以在相对较短的进样时间检测更多地激素种类[10,17-18,26]。本研究在所有青蒿器官中共检测到了8 种内源激素,而非方法中所包含的16 种,该结果不能说明黄花蒿中不含有这些激素,可能由于低于本方法的检测限而未检测到;此外,这些激素也可能具有更特异的器官、组织特异性,或是需在特点的生长周期及特定诱导环境下才会累积[28],这需要我们对更多的发育阶段的不同组织、器官的样本进行检测,才能构建完整的黄花蒿内源激素分布的代谢图谱。
综上,以黄花蒿为例,我们建立了一种对植物中内源激素进行精确定量的方法。利用该方法,我们还对丹参、拟南芥等药用和模式植物进行了激素含量测定,均有较好结果,表明该方法检测性良好、适用性广泛。通过对植物内源性激素的检测可辅助研究植物生长发育的过程[32-33]及受到外界胁迫的调控机制[34-35],为进一步探究植物的生长发育及次生代谢产物的合成提供了手段。
