基于网络药理学和体内实验探究黄蜀葵花总黄酮治疗急性肾损伤的分子机制
2022-09-27詹倩王富江葛海涛
詹倩,王富江,葛海涛,✉
(1.南京中医药大学,江苏 南京 210023;2.江苏苏中药业研究院有限公司,江苏 南京 211198)
急性肾损伤(acute kidney injury,AKI)是一种表现为肾功能快速下降和代谢废物蓄积的常见临床综合征,具体表现为血尿素氮(blood urea nitrogen,BUN)和血清肌酐(serum creatinine,Scr)水平升高,水、电解质和酸碱失衡,以及全身各系统症状,可伴随少尿或无尿[1]。据2015年国际肾脏病学会报道,每年约有1 330万人发生急性肾损伤,并且每年因急性肾损伤而死亡的人数约有170万[2]。目前临床治疗急性肾损伤主要采用液体复苏、药物防治和肾脏替代疗法等方法,药物治疗包括抑制细胞死亡类、抗炎类和修复类药物等,由于各种原因,这些疗法并未取得很好的临床疗效[3]。因此寻找减缓肾损伤、改善肾功能的药物具有重要意义。
黄蜀葵花总黄酮(total flavonoids ofAbelmoschus manihot,TFA)是从中药黄蜀葵花中提取的黄酮类组分,含有槲皮素、芦丁、异槲皮苷、金丝桃苷、杨梅素等多种黄酮成分,研究表明,这些黄酮成分具有抑制免疫反应、改善肾纤维化、抗炎、改善肾功能和减轻肾损伤等药理作用[4-5]。已有研究发现TFA 可能是通过抑制ROS,继而下调NLRP3、Caspase-1蛋白的表达,从而抑制ROS/NLRP3 信号通路减轻阿霉素诱导的肾损伤[6],但目前TFA治疗急性肾损伤的作用机制研究较少,尚不全面。
网络药理学是基于数据库挖掘相关信息,揭示药物成分核心靶点,在理解疾病的分子基础上,预测药物的药理学作用机制,评估药物的药效、作用途径和分子机制。本研究拟利用网络药理学相关数据库和动物实验靶点验证,初步探究TFA 治疗阿霉素诱导的急性肾损伤的分子机制,为进一步深入研究奠定理论基础。
1 资料与方法
1.1 黄蜀葵花黄酮类成分的收集
在中国知网数据库(https://www.cnki.net/)中,以“黄蜀葵花总黄酮”为检索词,获取TFA 成分相关信息,检索黄蜀葵花总黄酮含有成分种类及信息。利用化源网(https://www.chemsrc.com/)查询成分CAS 号,通过PubChem 数据库(https://pubchem.ncbi.nlm.nih.gov/)获取成分结构信息,保存为“SMILES”格式。
1.2 黄蜀葵花黄酮类化合物靶点预测
将获得的黄酮类化合物“SMILES”格式导入Swiss TargetPrediction 数据库(https://www.expasy.org/resources/swisstargetprediction),设置物种为“Homo sapiens”,得到药物的预测靶点,将从化源网中得到的化合物英文名称导入中药系统药理学数据库与分析平台(TCMSP,https://old.tcmsp-e.com/tcmsp.php),得到黄酮类成分的已验证靶点。将以上步骤所得到的靶点信息导入Uniprot 数据库(https://www.uniprot.org/),统一靶点的Uniprot ID,删除重复值,整理得到TFA的相关靶点。
1.3 疾病靶点的预测
在GeneCards 数据库(https://www.genecards.org/)中以“acute kidney injury”为关键词搜索,以相关系数大于2 倍中位数筛选,在Disgenet 数据库(https://www.disgenet.org/)中以“acute kidney injury”为关键词搜索,两者取并集得到疾病相关靶点。
1.4 筛选共同靶点
运用易汉博生物信息在线作图工具(http://www.ehbio.com/ImageGP/)将化合物靶点和疾病靶点映射,获得化合物和疾病的共同靶点并绘制韦恩图,即得到TFA治疗急性肾损伤可能的作用靶点。
1.5 核心靶点蛋白质-蛋白质相互作用(PPI)网络的构建
将化合物和疾病的共同靶点信息导入STRING 平台(https://string-db.org/)中构建PPI 网络,设置物种为“Homo sapiens”,相关性≥0.7,即可获得共同靶点的PPI 网络,导入Cytoscape 3.8.0 软件中,构建成分-潜在靶点网络图。相关信息导入Cytoscape 3.8.0软件中,以大于Degree 值中位数2 倍筛选核心靶点,得到核心靶点PPI网络图。
1.6 核心靶点通路分析和可视化
将上述获得的核心靶点信息导入生物学信息注释数据库(DAVID,https://david.ncifcrf.gov/)中,对其进行基因本体(gene ontology,GO)富集分析和京都基因与基因组百科全书(kyoto encyclopedia of genes and genomes,KEGG)通路注释分析,运用微生信平台(http://www.bioinformatics.com.cn/login/)制作GO 富集分析结果的柱状图、气泡图和KEGG 通路注释分析结果的气泡图,并将相关信息输入Cytoscape 3.8.0 软件中,构建成分-靶点-通路网络图。
1.7 动物实验验证
1.7.1 动物
SPF 级KM 小鼠,雄性,体质量25~30 g,购自辽宁长生生物技术股份有限公司,实验动物许可证号:SCXK(辽)2020-0001。动物饲养于清洁级动物房中,12 h光照,恒温21~23 ℃、恒湿45%~65%,自由饮食、饮水。
1.7.2 药物、试剂与仪器
黄蜀葵花总黄酮干粉(江苏苏中药业研究院有限公司,批号:20200929)用蒸馏水溶解制成剂量为228 mg/kg的混悬液。
阿霉素(上海阿拉丁生化科技股份有限公司,货号:A183027);MAPK 抗体(英国Abcam 公司,批号:ab170099);Akt抗体(英国Abcam 公司,批号:ab8805);苏木精-伊红(hematoxylin-eosin staining,HE)染色试剂盒(上海碧云天生物技术有限公司,货号:C0105M);过碘酸-雪夫(PAS)染色试剂盒(上海碧云天生物术有限公司,货号:C0142S)。
全自动组织包埋机(德国徕卡仪器有限公司,型号:HistoCore Arcadia H);全自动轮转式切片机(德国徕卡仪器有限公司,型号:HistoCore AUTOCUT-149AUTO00C1);全自动生化分析仪(德国SIEMENS公司,型号:Dimension EXL200);倒置显微镜(德国LEICA公司,型号:DM75M)。
1.7.3 阿霉素肾损伤模型建立及动物分组
30 只KM 小鼠适应性喂养1 周后,随机分为正常组、模型组和给药组,每组10 只。除正常组外,模型组和给药组以11 mg/kg 剂量尾静脉注射阿霉素(溶于生理盐水)构建急性肾损伤动物模型。2 周后检测24 h尿蛋白,24 h尿蛋白显著高于正常组则视为造模成功。给药组小鼠按228 mg/kg 的剂量灌胃给予黄蜀葵花总黄酮混悬液,正常组与模型组小鼠按相同体积灌胃蒸馏水。每日给药1 次,给药1 个月后取肾脏,用10%福尔马林溶液固定。
1.7.4 标本采集、处理及指标检测
取组织固定液固定后的肾脏,用石蜡包埋,切成4µm 的肾切片,进行HE 染色和PAS 染色,观察病理结构变化,采用二次免疫组化法检测Akt和MAPK表达水平,每组选取3 只小鼠病理切片,使用CaseViewer 软件放大200倍,每只小鼠病理切片中随机选取5个相等面积的视野区域,用Image J软件计算平均光密度(MOD)。
1.7.5 统计学方法
采用GraphPad prism 8软件进行统计分析,计量资料以均数±标准差(±s)表示,多组独立数据比较采用单因素方差分析,不符合正态分布,则采用非参数检验(Kruskal-Wallis test),以P<0.05表示差异有统计学意义。
2 结果
2.1 药物与疾病相关靶点筛选结果
经检索及汇总删重后,共获得TFA 相关靶点基因255个;在GeneCards数据库和Disgenet数据库中,经筛选后共检索到AKI 相关靶点基因1 830 个。将上述靶点信息输入易汉博生物信息在线作图工具,绘制韦恩图,得到成分-疾病共同靶点基因169个。见图1。
2.2 成分-靶点网络图的构建
采用Cytoscape 3.8.0软件构建成分-交集靶点网络图。M1、M2、M3、M4、M5、M6、M7、M8、M9 和M10 依次为异鼠李素-3-β-D-葡萄糖苷(Isorhamnetin-3-mono-beta-D-glucoside)、槲皮素(quercetin)、芦丁(rutin)、槲皮素-3-O-β-D-葡萄糖苷(Quercetin-3-O-beta-D-glucopyranoside)、杨梅素(myricetin)、棉皮素-8-O-β-D-葡萄糖醛酸苷(Hibifolin)、棉皮素-7-O-α-吡喃鼠李糖苷(Rhodiolgin)、4',5,7,8-四甲氧基黄酮(4',5,7,8-Tetramethoxyflavone)、槲皮素-3-O-洋槐糖苷(Quercetin 3-O-robinobioside)和槲皮素-7-Oβ-D-葡萄糖苷(Quercetin-7-O-beta-Dglucopyranoside)。圆形节点颜色越深,显示圆形节点之间相互作用越强。见图2。
2.3 核心靶点PPI网络的构建
采用Cytoscape 3.8.0软件计算Degree值筛选核心靶点28 个,其靶点基因信息见表1。将靶点信息导入STRING 数据库中,得到核心靶点PPI网络图,该PPI网络涉及到28 个蛋白,236 条相互作用关系,结果提示STAT3、AKT1、MAPK1、TP53、PIK3CA、JUN、RELA、SRC、TNF、VEGFA、EGFR 等可能是TFA 防治急性肾损伤的作用靶点。见图3。

表1 核心靶点基本信息表
2.4 GO富集分析结果
DAVID 数据库共富集到GO 功能条目327 个,生物学过程(biological process,BP)、细胞定位(cellular component,CC)和分子功能(molecular function,MF)分别有289、26 和52 个。其中,BP 主要涉及RNA 聚合酶Ⅱ启动子的转录正调控、MAPK 级联激活、凋亡过程的负调控、一氧化氮生物合成过程的正调控、细胞增殖的正调控和药物反应等;CC主要涉及细胞核、细胞溶质、细胞外组分和受体复合物等;MF主要涉及相同蛋白质结合、酶结合、转录因子结合、蛋白质结合和受体结合等。GO 功能富集分析柱状图(BP、CC、MF 各取P值排名前10位)见图4。
2.5 KEGG通路富集分析结果及成分-靶点-通路网络图的构建
DAVID 数据库共富集到KEGG信号通路99条,根据P值选取前20位进行展示,见图5。有显著性的通路包括Toll样受体信号通路、乙型肝炎、催乳素信号通路、HIF-1信号通路、TNF信号通路、PI3K/Akt信号通路、碎骨细胞分化、T细胞受体信号通路和甲状腺激素信号通路等。采用Cytoscape 3.8.0软件构建成分-靶点-通路网络图,见图6。其中M1、M2、M3、M4、M5、M6、M7、M8、M9、M10与图2中代表含义相同,网络结果显示,各成分可能通过调控MAPK1、AKT1、TP53、CCND1、TNF、STAT1、PIK3CA、IL2和NFKBIA等靶点基因的表达,干预相关通路治疗AKI。
2.6 动物实验验证
2.6.1 HE、PAS染色结果观察
各组小鼠的肾脏组织HE 染色、PAS 染色结果显示,与正常组相比,模型组小鼠肾组织皮质深部肾小管上皮细胞轻度水肿,形态学表现为肾小管上皮细胞胞浆疏松淡然,肾小管固缩,肾小球基底膜增厚;与模型组相比,给药组小鼠肾组织肾小球基底膜轻微增厚,较模型组有所改善。见图7。
2.6.2 Akt、MAPK在小鼠肾组织中的表达
与正常组相比,模型组的Akt 表达显著下降(P<0.01),MAPK的表达显著增加(P<0.05);与模型组相比,给药组的Akt 表达显著上升(P<0.01),MAPK 的表达显著下降(P<0.05)。见表2和图8、图9。
表2 各组小鼠肾脏组织中Akt和MAPK蛋白表达情况比较(±s)
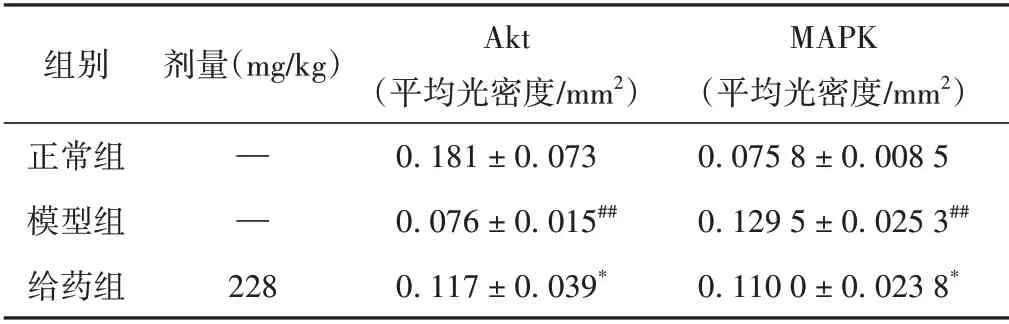
表2 各组小鼠肾脏组织中Akt和MAPK蛋白表达情况比较(±s)
注:与正常组相比,##P <0.01;与模型组相比,*P <0.05。
组别剂量(mg/kg)正常组模型组给药组MAPK(平均光密度/mm2)0.075 8±0.008 5 0.129 5±0.025 3##0.110 0±0.023 8*— —228 Akt(平均光密度/mm2)0.181±0.073 0.076±0.015##0.117±0.039*
3 讨论
AKI 是一种短时间内肾功能迅速下降的疾病,其发病机制多样,与缺血/再灌注损伤(ischemia reperfusion injury,IRI)、肝移植手术、冠状动脉搭桥手术、横纹肌溶解症、脓毒症以及药物等相关,其中缺血/再灌注损伤与细胞内Ca2+超载、大量活性氧产生、炎症反应和细胞凋亡介导的肾损伤密切相关[7]。AKI 有发展成慢性肾病和终末期肾病的风险,因此进行AKI 相关研究具有重要意义。目前根据临床症状多将其归为“癃闭”“关格”等范畴[8],通常认为其病因病机主要与外邪侵袭、药毒伤肾等有关。黄蜀葵花归肾、膀胱经,目前已研发成新药——黄葵胶囊,用于治疗慢性肾炎、糖尿病肾病以及肾病综合征等。
本研究通过网络药理学筛选得到169 个TFA 治疗急性肾损伤的潜在靶点,通过进一步筛选得到28 个核心靶点,核心靶点包括STAT3、AKT1、MAPK1、TP53、PIK3CA、JUN、RELA、SRC、TNF、VEGFA 和EGFR 等。AKT1 是参与机体产生AKI 分子机制中一个重要靶点基因,已有研究证明AKT1 的缺失可以加剧肾缺血再灌注损伤时的肾小管凋亡和炎症反应,进而加剧肾功能障碍和病理损害[9],且肾小管线粒体AKT1的表达可以减轻肾损伤,保护肾功能[10]。AKT1 包含于Akt,说明Akt 可能是治疗AKI 的关键靶点。除了AKT1,MAPK 也有可能是治疗AKI 的一个关键靶点,有研究发现机体产生急性肾损伤的分子机制中涉及p38MAPK、JUK 的表达[11],而MAPK 家族成员包括MAPK1、JNK、p38MAPK 和ERK 等[12],在调节炎症和免疫反应中也起重要作用。
TFA 中含有黄酮成分槲皮素,研究发现槲皮素可通过显著抑制由脂多糖(LPS)引起小鼠单核巨噬细胞白血病细胞(RAW 264.7 cells)炎症反应过程中JNK、p38MAPK 的激活来降低炎症介质水平[13],说明TFA 可能会通过抑制体内JNK、p38MAPK 的激活来达到抗炎作用,降低肾脏炎症反应。孙军等[14]在研究槲皮素对血管内皮祖细胞(endothelial progenitor cells,EPCs)保护作用机制时发现,槲皮素在增强EPCs细胞繁殖能力的同时,可升高EPCs 中Akt 以及磷酸化Akt 的蛋白表达量,以及PI3K 和Akt3 mRNA 表达,可见槲皮素可能通过PI3K/Akt 信号通路来发挥EPCs 保护作用。在内皮损伤后,EPCs可由骨髓动员并归巢于损伤部位参与血管修复及新生血管形成,从而对体内多个器官损伤血管进行修复[15],由此可见,TFA 可能通过上调体内Akt表达,干预PI3K/Akt信号通路来保护肾脏EPCs,修复肾脏内损伤部位。赵青等[16]发现黄葵胶囊(黄蜀葵花提取物)可通过下调肾组织p38MAPK 的蛋白表达,减少肾组织内炎症细胞的浸润、活化,改善肾组织的炎症性损伤。以上研究结果提示,Akt 与MAPK 可能是TFA治疗AKI的作用靶点。
GO 富集分析结果显示,可能的生物过程为MAPK级联激活、凋亡过程负调控和细胞增殖正调控等。KEGG 富集分析结果显示,可能的信号通路为Toll 样受体信号通路、HIF-1 信号通路、TNF 信号通路及PI3K/Akt信号通路等。多篇文献报道PI3K/Akt信号通路、Toll 样受体信号通路和HIF-1 信号通路与保护相关物质诱导的急性肾损伤作用有关[17-19]。这些通路均为常见炎症反应相关信号通路,Akt和MAPK在这些通路中起重要作用,炎症反应会加剧肾损伤,通过对Akt与MAPK的表达进行调控,可减轻炎症反应,进而减轻肾损伤。动物实验靶点验证结果显示,与模型组相比,给药组Akt 表达量显著上调、MAPK 表达量显著下调,说明TFA 可能通过调控Akt 和MAPK 蛋白的表达,减轻阿霉素诱导小鼠产生的肾损伤。
综上所述,本研究借助网络药理学的方法,收集TFA治疗AKI的潜在靶点,并通过PPI网络构建和GO、KEGG 富集分析,结合动物实验验证发现TFA 可能通过上调Akt 表达、下调MAPK 表达,从而减轻阿霉素诱导小鼠产生的肾损伤。AKI 产生的原因有多种,阿霉素诱导的AKI 是属于药物毒性引起的,临床上药物引起的AKI 时有发生,其相关治疗作用靶点的研究可为临床上治疗AKI 提供理论依据,未来还需再进一步对TFA治疗AKI的相关通路以及多靶点治疗进行研究。
