低频电场冰温保鲜对虾的水分迁移规律及品质变化的影响
2022-09-27梁钻好陈海强梁凤雪敖菲菲邓锦杰
余 铭,梁钻好,陈海强,梁凤雪,敖菲菲,邓锦杰
(1.阳江职业技术学院食品与环境工程系,广东阳江 529566;2.广东省食品低温加工工程技术研究中心,广东阳江 529566)
南美白对虾(),又称凡纳滨对虾,对虾科、滨对虾属动物,原产于中、南美洲太平洋沿岸的温暖水域,与斑节对虾、中国对虾并列为世界三大养殖虾类,也是我国重要的养殖虾类。2019 年全国养殖产量超180 万吨,其中广东占比35%,位居全国第一。由于对虾水分含量极高,蛋白质丰富,内源性蛋白酶活性强,离水后存活时间较短,通常以冷藏或冷冻的形式保鲜。但冷藏(0~4 ℃)温度相对较高,水产品货架期短;冷冻(通常为-18 ℃)食品解冻后汁液流失严重,品质下降。
冰温保鲜是一种中间温度带保鲜方法,指将食品置于0 ℃~冻结点温度区域保持不冻结状态,它既可以避免因冻结导致的一系列质构劣变现象,又能像冷藏那样保持高度新鲜状态,同时货架期更长,适用于果蔬、肉类及多种水产品的保鲜。如,冰温保鲜(-1.5 ℃冰水)相比冷藏保鲜(1.5 ℃冰水)可有效降低北极甜虾贮藏期间的菌落总数,抑制总挥发性盐基氮(TVB-N)和三甲胺的生成,明显延长微生物的生长滞后期;0 ℃冰温贮藏三疣梭子蟹,其TVB-N、总活菌数和K 值的变化速率均慢于冷藏,保质期延长1~2 d。然而冰温保鲜技术存在一定的推广难度。因为其温度本就介于冻结和非冻结的临界点,但当设备温度波动范围达不到要求时,可能会导致食品表面甚至内部产生冰晶,表面冰晶在温度波动情况下极易融化,那么冰晶对细胞的机械破坏就会加速食品的汁液流失和质构下降。因此,冰温保鲜技术对设备的温控要求非常严格,一方面提高了技术成本;另一方面温控精度较高的情况下压缩机频繁启动也会增加耗电等经济成本。
本研究引入低频电场(Low Frequency Electric Field,LFEF)的概念(低频的频率范围为≤300 kHz)。低频电场与食品中的水分子发生共振,会干扰水分子之间氢键的形成及稳定,从而抑制食品内部水分结冰。基于此原理,低频电场应用于食品冰温保鲜,在设备温度波动较大的情况下避免食品中水分的冻结,从而有望降低冰温保鲜对温控的要求。此外,电场对食品品质必然有一定的影响,如通过抑制微生物与酶的活性而延缓微冻带鱼、冷藏牛肉贮藏过程中的品质变化。本研究以南美白对虾为研究对象,在冰温保鲜过程中施加低频电场,分析对虾品质的变化,同时结合低场核磁共振技术(LF-NMR)追踪保鲜过程中对虾的水分状态、分布和迁移变化规律,探究低频电场辅助冰温保鲜对虾延长货架期的可行性。
1 材料与方法
1.1 材料与仪器
南美白对虾(海水养殖)阳江市场;盐酸、硼酸、氧化镁、氯化钠(分析纯)天津市福晨化学试剂厂;平板计数琼脂 广东环凯微生物科技有限公司。
低频电场发生器 实验室自主设计;MesoMR23-040V-I 核磁共振成像分析仪 苏州纽迈分析仪器股份有限公司;EVO MA 15 扫描式电子显微镜 德国ZEISS;ATN-300 全自动凯氏定氮仪 上海洪纪仪器设备有限公司;LAB 254e 电子精密天平 艾德姆衡器(武汉)有限公司;ZD-85 恒温震荡器 常州澳华仪器有限公司;LHS-250CL 恒温恒湿箱 上海齐欣科学仪器有限公司;SPX-250BIII 生化培养箱 天津市泰斯特仪器有限公司。
1.2 实验方法
1.2.1 对虾保鲜 根据虾的冻结点-2.5~-2.0 ℃,设定保鲜温度为(-1±1)℃,即0 ℃至冻结点的温域。选取大小一致(质量12~16 g)的鲜活对虾4 ℃预冷1 h,随机分成2 组,分别进行常规冰温保鲜(对照)和低频电场辅助冰温保鲜,定期取样检测。具体分组情况如下:
冰温:-1 ℃普通恒温恒湿箱(温控精度为0.1 ℃,温度波动±1 ℃,湿度50%);
LFEF+冰温:-1 ℃低频电场恒温恒湿箱(温控精度为0.1 ℃,温度波动±1 ℃,工作频率50 Hz,工作电压3000 V)。
1.2.2 低频电场恒温恒湿箱的制作 低频电场恒温恒湿箱如图1 所示,恒温恒湿箱舱体内部上下端平衡放置两块发射器,恒温恒湿箱外部的低频电场发生装置通过传导线与箱内发射器链接,通电后即可运作。其中,低频电场发生装置依据本团队的授权专利进行组装,装置内由输入控制模块、电场信号发生模块、输出控制模块、电场发生模块和安全保护模块组成。

图1 低频电场恒温恒湿箱Fig.1 Constant temperature and humidity box with low frequency electric field
1.2.3 理化指标测定 对虾去头、壳、虾线,虾肉搅碎后用于测定总挥发性盐基氮和菌落总数。
总挥发性盐基氮,参照GB 5009.228-2016《食品中挥发性盐基氮的测定》中的半微量滴定法进行测定;菌落总数,参照GB 4789.2-2016《食品微生物学检验 菌落总数测定》进行测定。
1.2.4 电镜扫描分析 参照Chen 等的方法,将对虾样品去头、壳,取第2 腹节2~3 mm 的样品用2.5%戊二醛固定12 h,然后用0.1 mol/L PBS 缓冲液(pH 7.2)浸泡10 min。依次使用30%、50%、70%、80%、90%和100%的乙醇对固定样品脱水10 min,最后用CO作为流体对样品进行临界点干燥。检测前将样品贴于有导电胶的检测台上,喷金30 s,使样品表面喷金约10 nm 厚后进行检测。
1.2.5 低场核磁共振的测定及其成像分析 对虾分别取虾头和第1~3 腹节(靠近虾头部位算起,带壳)作为测试对象,滤纸吸干表面水分,称重,用保鲜膜包好,进行核磁共振测试,测试方法和成像分析参照Chen 等的方法进行。
测试方法:放入玻璃试管(口径40 mm),然后将样品管置于核磁探头中,使用CPMG 序列测试横向弛豫时间T。其中,参数设置如下:磁体温度32 ℃;重复采样等待时间TW=3500.00 ms;重复采样次数NS=4;回波时间TE0.15 ms;回波个数NECH=10000;采样带宽SW=200 kHz。模拟增益RG1=20.0 db;数字增益DRG=3;前置放大器增益PRG=2。
MPI 成像分析,参数设置:层数=1;层厚=6.0 mm;视野FOV=100 mm×100 mm;重复采样次数Average=2;重复采样等待时间TR=1100.00 ms;回波时间TE=18.125 ms。
1.3 数据处理
每个实验重复3 次,数据用平均值±标准差表示。试验数据采用Execl 2010 进行处理,并用Origin 8.0 进行单因素方差分析和Fisher LSD 多重比较。
2 结果与分析
2.1 LFEF+冰温保鲜对虾肉菌落总数的影响
冰温保鲜期间虾肉菌落总数如图2 所示,贮藏前期,菌落总数随时间增加无显著性变化,而且两种保鲜方式之间也无显著差异(>0.05)。贮藏6 d 后,菌落总数开始增加,其中常规冰温保鲜的虾肉菌落总数增加得更快;第9 d 时,二者之间已有显著差异(<0.05);贮藏第12 d,LFEF+冰温组的菌落总数比常规冰温组低1 个数量级。

图2 冰温保鲜过程中虾肉菌落总数的变化Fig.2 Changes of TVC on prawn during CFPS
Fojt 等的研究发现,频率为50 Hz 的低频电磁场即可对大肠埃希菌、大肠杆菌和金黄色葡萄球菌有杀灭作用。本研究的对虾贮藏后期,LFEF+冰温组的菌落总数显著低于对照组(<0.05),也证明了低频电场对微生物的繁殖有抑制作用。在一定的电场条件刺激下,腐败菌细胞膜内外电势发生改变,导致微生物活力显著降低。
2.2 LFEF+冰温保鲜对虾肉TVB-N 的影响
如图3 所示,两种保鲜方式的对虾TVB-N 含量变化趋势一致,均为TVB-N 含量在保鲜前期缓慢上升,后期急剧增加,转折点在第9~11 d。0~9 d,常规冰温保鲜的虾肉TVB-N 含量相对平稳在9~20 mg/100 g 范围内,略大于LFEF+冰温保鲜的虾肉;第9 d时其含量增加速率明显增大,第11 d 时TVB-N 含量(29.77±2.84)mg/100 g,已接近国标GB 2733-2015对海水鱼虾总挥发性盐基氮含量的限值(≤30 mg/100 g);此后TVB-N 含量继续猛增。而LFEF+冰温保鲜的虾肉中TVB-N 含量在第11 d 才开始迅速增加,第16 d含量超标至(35.39±1.50)mg/100 g。可见,低频电场对冰温保鲜虾肉中TVB-N 的产生有显著影响(<0.05),可明显延缓腐败。

图3 冰温保鲜过程中虾肉TVB-N 含量的变化Fig.3 Changes of TVB-N content on prawn during CFPS
总挥发性盐基氮的产生是由于微生物和内源性蛋白酶对虾肉蛋白分解产生的含氮物质,低频电场对虾肉中TVB-N 的延缓产生的作用机制与低频电场降低内源性蛋白酶的活性有关,也可能是由于电场对微生物繁殖的抑制作用。本研究从2.1 中也得出了低频电场有利于降低菌落总数的结论。段伟文等也发现施加电场有利于延缓对虾冰温保鲜期间TVB-N 含量的增加。相关研究在牛肉、带鱼中也有类似效果。
2.3 LFEF+冰温保鲜对虾肉微观结构的影响
对虾保鲜11 d 后进行电镜扫描分析,并与新鲜对虾样品作对照,结果如图4 所示。鲜样虾肉肌纤维束紧密结合,排列致密,放大到4000X 倍数下部分区域仍可见均匀、有序、蜂窝状的三维网络结构。贮藏11 d 的常规冰温保鲜虾肉肌纤维间隙增大,4000X的放大倍数下更是明显可见的松散结构。这种大而无序的空隙不利于细胞质水的保留以及弹性、硬度、咀嚼性等质构的形成。而且松散结构与贮藏过程中肌原纤维蛋白的降解和变性也有密切关系,肌原纤维蛋白和肌基质蛋白含量在0 ℃附近温度储藏过程中会明显下降,导致肌纤维束减少。LFEF+冰温保鲜的虾肉肌纤维致密程度略差于鲜样的,肌纤维排列出现混乱现象,孔隙增加,但空隙较小而密集,松散程度明显小于常规冰温保鲜。电场辅助低温保鲜在其它水产品中也有应用。王杏娣等研究认为低压静电场的添加可以减缓微冻贮藏时竹节虾理化性质的变化程度,降低对肌肉组织结构的破坏程度;张家玮等利用电场辅助微冻保鲜带鱼,也证实了电场可明显削弱微冻贮藏过程对带鱼肌肉组织结构的破坏程度。

图4 虾肉纵切面电镜扫描图Fig.4 SEM chart of the longitudinal section of prawn
2.4 LFEF+冰温保鲜对虾水分分布情况与迁移规律
2.4.1 LFEF+冰温保鲜虾肉部位水分分布与迁移采用低场核磁共振技术采集虾肉水分子氢质子信号,通过横向弛豫时间T反向表征氢质子的自由度及其所受束缚力,两种保鲜方式得到的虾肉横向弛豫时间T反演图如图5(A、B、C)所示。虾肉 T反演图有 4 个峰,分别标记为 T、T、T、T。其中,T(0.02~0.66 ms)为强结合水,T(0.5~5.0 ms)为弱结合水,T(10~115 ms)为不易流动水T170~950 ms)为自由水。贮藏期间,两种保鲜方式的虾肉第3、7、11 d 的T反演图与鲜样(第0 d)的接近,二者之间也无显著差异,但贮藏第15 d 时,常规冰温组的T峰面积显著降低(图5A)。对比两种保鲜方式的虾肉第15 d 的T反演图(图5C)发现,结合水含量(T和T峰面积)无明显变化,但其T峰面积确实有明显差异,这部分水为不易流动水,对食品品质有重要影响。常规冰温保鲜组的不易流动水含量在贮藏第15 d 时相比鲜样下降1.8%,比LFEF+冰温组显著下降约2.5%(图5D)。
图5D 显示,虾肉中约92%的水是以不易流动水的形式存在的,即肌原纤维细胞间质和肌原纤维细胞内的水。不易流动水的损失表明冰温保鲜过程中微生物作用、虾肉自溶、生化反应在悄然进行,最终导致肌纤维结构破坏、持水率下降、汁液流失;此外,冰温保鲜温度本就介于冻结和非冻结的临界点,但当设备温度波动范围达不到要求时,可能会导致冰晶的产生。当冰晶融化后会导致部分不易流动水的迁移和变化。基于以上两点,低频电场辅助冰温保鲜改善虾肉品质的机制为:一方面通过抑制微生物生长(2.1)、延缓生化反应(2.2)以及降低内源性蛋白酶的作用,使虾肉细胞在一段时间内免于自溶,保持肌肉细胞的完整性和持水能力;另一方面通过诱导虾肉肌纤维内水分子发生共振,抑制结冰,避免大冰晶冻融现象对细胞和肌肉纤维的破坏,从而减少保鲜过程中虾肉不易流动水的迁移和变化。
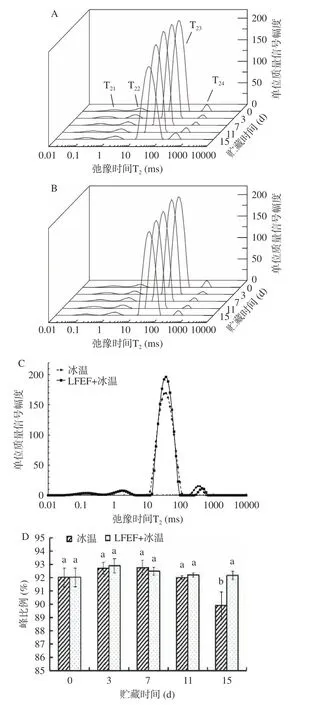
图5 冰温保鲜对虾虾肉部位的横向弛豫时间T2 反演图(A、B、C)和不易流动水含量变化(D)Fig.5 Refutation graph of transverse relaxation time T2 (A,B,C) and change of immobilized water content (D) on prawn meat during CFPS
2.4.2 LFEF+冰温保鲜虾头部位水分分布与迁移图6 为贮藏期间虾头部位的横向弛豫时间T反演图,贮藏第3、7、11、15 d,T反演图中的T峰(不易流动水)不断变小、右移动,T峰(自由水)不断变大变明显,即不易流动水向自由水转移,虾头部位在贮藏期间的腐败程度越来越严重。
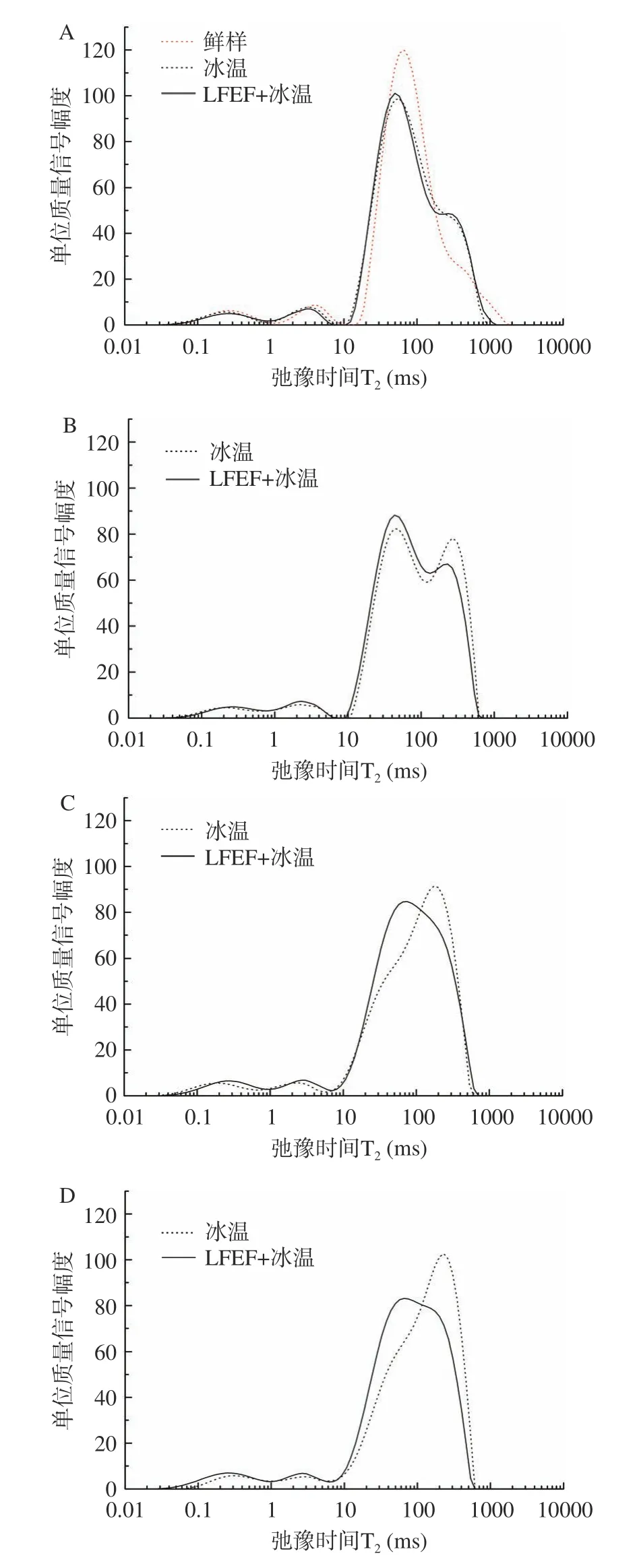
图6 冰温保鲜对虾虾头部位的横向弛豫时间T2 反演图Fig.6 Refutation graph of transverse relaxation time T2 on prawn head during CFPS
相比鲜样,贮藏第3 d,虾头部位的不易流动水就已经有明显的迁移,但是两种保鲜方式的对虾虾头T反演图重叠性良好,无显著差异。贮藏第7 d(图6B),两种保鲜方式的对虾虾头T反演图开始出现明显差异,相比LFEF+冰温保鲜组,常规冰温保鲜对虾虾头部位的T峰面积减少得更多,T峰变得更明显;贮藏第11 d(图6C),虾头部位的T和T峰已经混为一体(以下称混合峰),常规冰温保鲜对虾的混合峰顶点在230~270 ms 之间,自由水偏多,而LFEF+冰温保鲜组的混合峰顶点在70 ms 附近,以不易流动水偏多;贮藏第15 d(图6D),常规冰温保鲜对虾的自由水含量继续明显增加,LFEF+冰温保鲜组的自由水含量也略有增加,但增幅明显比常规冰温组小。可见,虾头部位从保鲜第3 d 开始就出现明显变化,第7 d 时低频电场可有效提高虾头的冰温保鲜效果。
对比虾肉和虾头的T反演图能明显看出,虾肉在贮藏第11 d 甚至第15 d(LFEF+冰温组)的T反演图还是与鲜样有良好重叠性,但虾头部位从贮藏第3 d 开始就出现明显变化。这是因为虾头部位的酶活性较其它部位要强得多,因此虾头最先出现腐败变质现象。而低频电场通过抑制酶活,在冰温保鲜期间有利于延缓虾头腐败。
2.5 LFEF+冰温保鲜对虾的虾头MRI 成像分析
冰温保鲜期间虾头部位的MRI 成像伪彩图如图7 所示,颜色的深浅代表氢质子密度引起的弛豫时信号强弱差别。图中显示,大部分水集中在虾头中心的虾膏(虾肝)部位,由于氢质子密度大,表现为很深的暗红色,虾肝附近往外扩散为黄色、绿色、天蓝色,水分含量逐渐降低。贮藏期间,红色部位逐渐扩散,水分流动性增大,逐渐由中心部位分散到虾头各个部位,即水分发生迁移和变化,自由水含量增加;直至贮藏第15 d,常规冰温保鲜的对虾几乎整个虾头都变红了,表明虾头虾肝部位自溶严重。相比之下,LFEF+冰温保鲜组的虾头水分迁移程度略低(红色部位扩散程度相对较小),直观证明了低频电场有利于延缓冰温保鲜对虾虾头的腐败自溶。

图7 冰温保鲜对虾贮藏期间虾头部位的MRI 成像伪彩图Fig.7 MRI pseudocolor images of prawn head during CFPS
新鲜对虾虾膏细胞膜完整,包裹着细胞内水和细胞间质水(不易流动水)。冰温贮藏期间虾头水分的明显迁移一方面源于虾死后虾头异常活跃的内源性蛋白酶作用导致的细胞自溶现象;另一方面源于温度的轻微波动导致的反复冻融,冰晶成长对细胞膜造成的机械破坏导致细胞膜破裂,不易流动水流失。低频电场在降低酶活和抑制结冰这两方面的作用,对延长冰温保鲜对虾货架期有利。
3 结论
以常规冰温保鲜技术为对照,采用低频电场辅助冰温保鲜对虾,监测贮藏期间对虾的菌落总数和TVB-N 含量变化,分析微观结构变化,通过LF-NMR技术探究贮藏期间虾肉和虾头的水分迁移和变化规律,得出如下结论:a.低频电场可明显延缓冰温保鲜对虾贮藏后期的微生物繁殖速率和TVB-N 含量的增加速率,延长货架期,一定程度上维持虾肉肌纤维的网状结构;b.低场核磁共振分析,贮藏期间的虾肉T反演图与鲜样的高度重叠,常规冰温保鲜组的不易流动水含量在第15 d 显著下降(<0.05),而低频电场冰温保鲜组无明显变化。虾头部位的不易流动水在贮藏第3 d 已有明显的迁移,但两种保鲜方式之间无显著差异(>0.05);随着贮藏时间的延长,虾头的不易流动水含量持续下降,自由水含量增加,但低频电场冰温保鲜组的水分迁移速率低于对照组。虾头部位的MRI 成像结果与T反演图变化规律一致;c.腐败最先发生在虾头部位,其次从虾肉的理化指标体现,虾肉的水分迁移变化稍有延迟。综合理化指标变化和水分迁移规律,表明施加低频电场后,有利于延长对虾冰温保鲜的货架期3~5 d。
