采用QuEChERS 结合UHPLC-MS/MS 定量分析热加工肉制品中的三种胺类物质
2022-09-27秦志伟
秦志伟,叶 博,2,刘 玲,
(1.沈阳农业大学食品学院,辽宁沈阳 110000;2.辽宁现代农业工程中心,辽宁沈阳 110000)
肉及肉制品能够提供多种营养物质,是人们日常饮食中的重要组成部分。人们每天食用100 g肉制品就能满足每日推荐量(RDA)50%的铁、锌、硒、维生素B、维生素B和100%的维生素A。其中的必需氨基酸、高品质蛋白质、锌、铁、硒和牛磺酸、肉碱、肌酸等生物活性物质,对人体健康十分有益。但是,热加工肉制品时容易产生一些有毒有害的物质,比如相关研究表明,我国肉制品传统加工方式烧烤、油炸、煎炸和酱卤中,高温加工产生大量致癌物丙烯酰胺(AA)、亚硝胺(NAs)和杂环胺(HAAs)等。它们通过食物摄入人体后,会通过胃肠道迅速吸收,并通过血液循环系统在肝脏、肾脏、胸腺和心脏等器官聚集,对人类健康造成不利影响。国际癌症研究机构已将部分HAAs 和NAs 归类为2B 类人体致癌物,而IQ 和AA 被列为2A 类人体致癌物。
近年来,文献报道了一些使用GC、GC-MS、LC、GC-MS、LC-UVD和 LC-MS/MS分析胺类物质的方法,其中采用GC-MS 进行AA和HAAs 的测定方法通常需要繁琐的衍生化处理。LC-MS 和LC-MS/MS 是目前最常用的方法,因为这些方法无需衍生化处理即可对复杂基质中的某种胺类物质进行分离和测定。然而,目前缺乏对热加工肉制品中主要胺类物质统一快速准确的分析方法。因此,本研究目标建立一种稳定且灵敏的方法用于热加工肉制品中AA、NAs 和HAAs 等20 种胺类物质的痕量分析。该方法采用简单、快速的乙腈盐析均相萃取,通过LC-MS/MS 进行测定,可应用于烧烤、油炸和煎烤等不同肉制品中AA、NAs 和HAAs 的分析。
1 材料与方法
1.1 材料与仪器
新鲜屠宰的猪肉里脊、牛肉里脊、鸡胸肉和羊后腿肉 购自沈阳市二台子清真牛羊屠宰厂(沈阳市绿洲生猪屠宰场和沈阳华美畜禽有限公司);杂环胺类:2-氨基-1,6-二甲基咪唑并吡啶(DMIP)、2-氨基-3-甲基-3H-咪唑并[4,5-f]喹噁啉(IQx)、2-氨基-3-甲基-3H-咪唑并喹啉(IQ)、2-氨基-3,8-二甲基咪唑并[4,5-f]喹恶啉(MeIQx)、2-氨基-3,7,8-三甲基-3H-咪唑并[4,5-f]喹噁啉(7,8-DiMeIQx)、2-氨基-3,4,8-三甲基-3H-咪唑[4,5-f]喹喔啉(4,8-DiMeIQx)、9H-吡啶并[3,4-b]吲哚(Norharman)、哈尔满碱(Harman)、3-氨基-1-甲基-5H-吡啶[4,3-b]吲哚(TRP-P-2)、2-氨基-1-甲基-6-苯基咪唑[4,5-b]吡啶(PHIP)、3-氨基-1,4-二甲基-5h-吡啶[4,3-b]吲哚乙酸(Trp-P-1)、2-氨基-9H-吡啶并[2,3-b]吲哚-15N3(AaC)、2-氨基-3,4-二甲基-3H-咪唑并喹啉(MeIQ)、内标:Nroharman-d7、4,7,8-TriMeIQx(纯度为99%)Toronto Research Chemicals 公司;丙烯酰胺:AA,纯度为99% 阿拉丁化学试剂有限公司;亚硝胺类:N-亚硝基二苯胺(N-nitrosodiphenylamine,NDPHA)、N-亚硝基二丙胺(N-nitrosodipropylamine,NDPA)、N-亚硝基二丁胺(N-nitrosodibutylamine,NDBA)、N-亚硝基哌啶(N-nitrosopiperidine,NPIP)、N-亚硝基吡咯烷(Nnitrosopyrrolidine,NPYR)、N-亚硝基吗 啉(Nnitrosomorpholine,NMOR),纯度为99% 麦克林化学试剂有限公司;正己烷、乙腈、甲醇 色谱纯,上海Sigma 公司;PSA、HC-C净化剂 上海安谱实验科技有限公司;整个实验使用Milli-Q 净水系统生产的超纯水。
CR21N(立式)高速冷冻离心机 日本日立株式会社;Lab Dancer 涡旋混匀器 德国IKA 公司;Waters 超高液相色谱-质谱联用仪(配有电喷雾离子源(ESI)及Masslynx V4.1 数据处理系统)美国Waters 公司;FSH-2A 高速均质机 上海康敏检验设备有限公司;Milli-Q 超纯水机 美国Millipore 公司;MP-2002 型分析天平 上海舜宇恒平科学仪器有限公司;ACQUITY UPLC BEH C柱 上海沃特世科技有限公司;Extend C柱和EclipsePlus C柱 中国安捷伦科技有限公司。
1.2 实验方法
1.2.1 标准溶液的制备 500 μg/mL 的单个AA、NAs、HAAs 及内标标准母液用乙腈配制。通过乙腈稀释母液获得混合标准储备溶液、混合内标储备溶液(5.0 mg/L)和标准溶液(1 mg/L)。使用前,将混合标准储备溶液用流动相(1 mmol/L 乙酸铵0.06%甲酸/乙腈,95/5,v/v)稀释成浓度为0.1、0.5、1.0、5.0、10.0、20.0、100.0 μg/L 的混合标准工作溶液,所有混合标准工作溶液都含有20 μg/L 的4,7,8-TriMeIQx和Norharman-d7。
1.2.2 样品的制备 原料肉洗净,修整,去除表面可见的脂肪和筋膜组织。原料肉切成(5.0 cm×3.0 cm×0.3 cm)立方体,将约1 kg 的木炭放在烤炉上,将50 mL汽油倒在煤炭上生火,在烤炉上方放上平底锅,在230 °C 以不同时间(3、5 和7 min)煎制。未处理的肉样作为对照组。肉样处理后均已达到可食用熟度。且在整个处理过程中未添加香辛料和食品添加剂等佐料。肉品处理后冷却,切成小颗粒(0.2 cm×0.2 cm×0.2 cm),真空包装在尼龙塑料袋中,-80 °C下储存。
1.2.3 样品的处理 取2 g 均匀肉样加入50 mL 离心管中,分次加入5 mL 正己烷涡旋除脂。将4 μL的混合内标储备溶液和4 μL 混合标准储备液依次加入离心管。加入4 mL 氢氧化钠溶液(1 mmol/L)和6 mL 的乙腈均质,涡旋分散并超声。加入2 g NaCl和2 g NaSO至离心管,涡旋。以4000 r/min 离心3 min,收集上清液,4 mL 的乙腈重提,合并上清液。旋转蒸发仪浓缩到0.5 mL,用流动相(1 mmol/L 乙酸铵0.06%甲酸/乙腈,95/5,v/v)稀释到1 mL,涡旋2 min,溶液转移至装有50 mg PSA 的2 mL 离心管中,以12000 r/min 离心3 min,上清液过0.22 μm 的滤膜,待分析。
1.2.4 检测仪器条件 AA、NAs 和HAAs 的色谱分离在安捷伦Eclipse C柱(2.1 mm×50 mm,1.8 μm)上进行,柱温为30 °C。流动相由溶剂A(1 mmol/L乙酸铵0.06%甲酸)和溶剂B(乙腈)组成。流速为0.2 mL/min,采用以下线性梯度洗脱程序:0~0.2 min,5% B;0.2~3.0 min,5%~40% B;3.0~7.0 min,40%~100% B;7.0~8.0 min,100% B;8.0~9.0 min,100%~5% B;9.0~12.0 min,5% B。进样量为3 μL。
ESI 以正模式进行,优化工作参数如下:毛细管电压:0.8 kV;锥孔电压:30 V;离子源温度:100 °C;脱溶剂气温度:650 °C;脱溶剂气(N)流量:1000 L/h;锥孔气(N)流量:3 L/h;MS/MS 分析采用多反应监测(MRM)模式。目标分析物和两种内标的保留时间、最佳碰撞能量和MRM 离子对等信息如表1 所示。
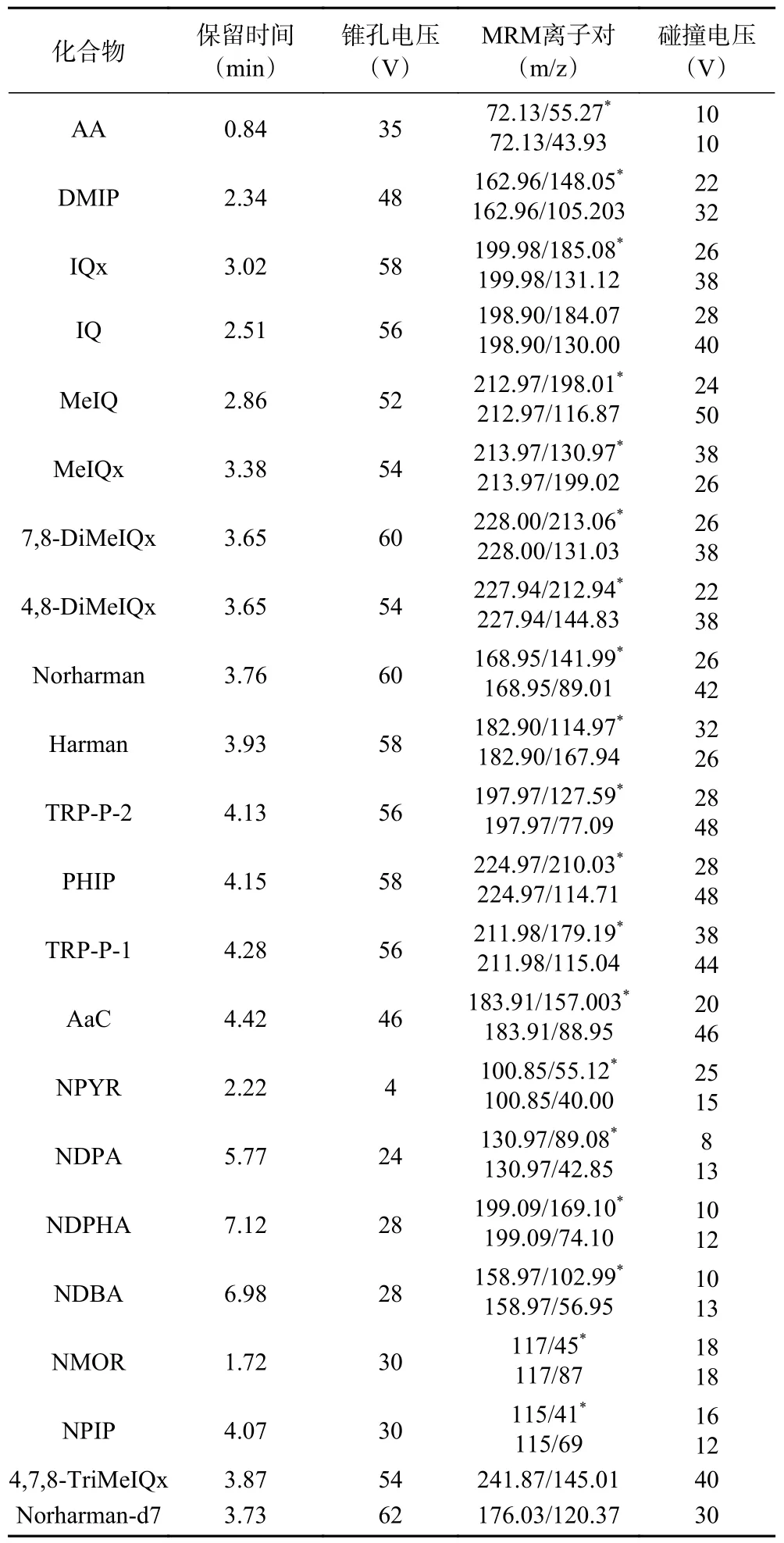
表1 AA、NAs、HAAs 的质谱条件Table 1 MS conditions of AA,NAs and HAAs
1.2.5 样品中胺类物质的定性和定量分析 利用色谱图中对应的保留时间和MRM 离子对对被检胺类物质进行定性。用阴性样品的基质提取液和纯溶剂配制相同浓度的基质匹配校准溶液和标准溶液,按照上述检测条件检测,AA 和NAs 以标准品浓度x(ng/mL)为横坐标,各组分的峰面积y 为纵坐标绘制标准曲线,采用外标法对其浓度进行定量。HAAs以标准品浓度x(ng/mL)为横坐标,各组分的峰面积与内标峰面积比值y 为纵坐标,绘制标准曲线,采用内标法对其浓度进行定量。
1.3 数据处理
所有试验均重复3 次,试验结果以平均值±标准差表示;20 种胺类物质的色谱图采用Masslynx V4.1软件进行分析;其他数据使用Microsoft Excel 2019进行处理,并使用Origin 2018 软件绘制图表。
2 结果与分析
2.1 流动相的优化
流动相中添加适当的乙酸铵可有效改善AA、NAs 和HAAs 的峰形,在ESI模式下乙酸铵的添加与胺类物质的电离抑制呈正相关,因此会影响其响应强度。分别以0.5~20 mmol/L 五种乙酸铵缓冲溶液为流动相考察对胺类物质响应强度的影响。图1 为20~0.5 mmol/L 的乙酸铵添加量下20 种胺类物质的色谱图。从图中红圈标注部分可看出随着乙酸铵添加量的减少部分胺类物质的响应强度增加。但是,当乙酸铵添加量降到0.5 mmol/L 时,峰形有明显的拖尾现象,且20 种胺类物质的整体响应强度低于乙酸铵添加量为1 mmol/L 的强度,因此选择1 mmol/L 乙酸铵作为最后乙酸铵的添加量。

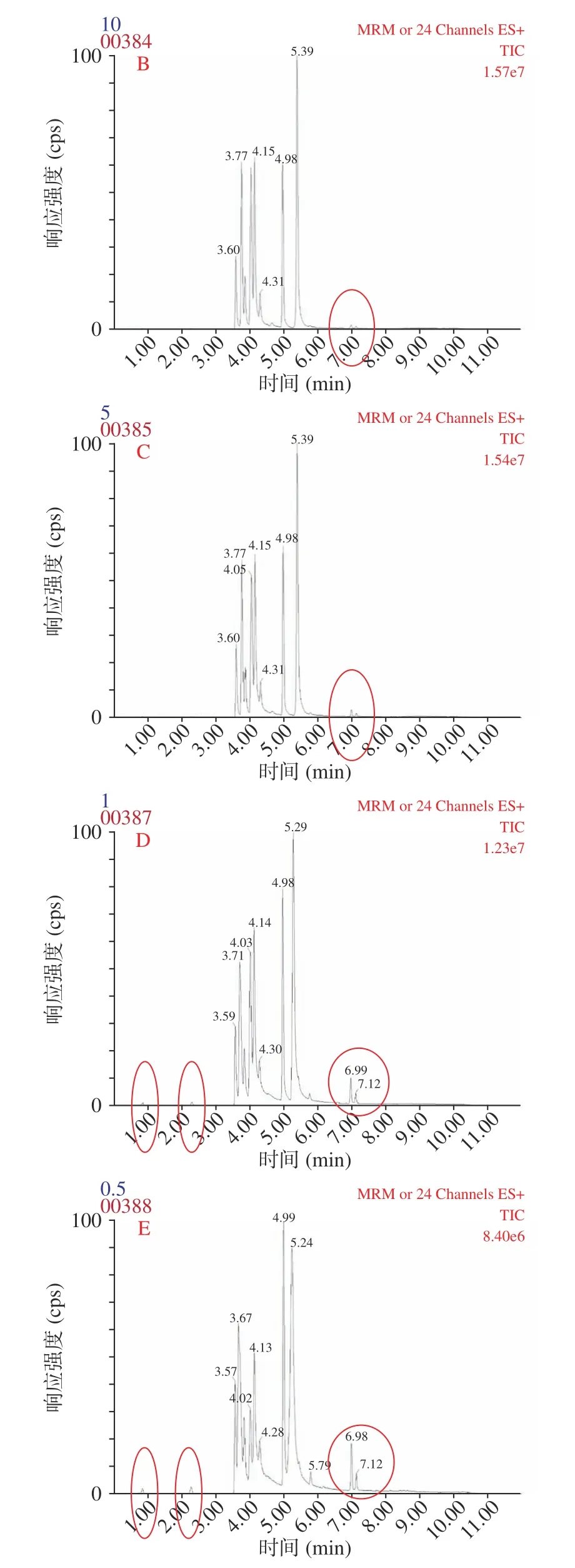
图1 流动相中不同乙酸铵添加条件下20 种胺类物质的色谱图Fig.1 Chromatograms of 20 amines under different ammonium acetate addition conditions in mobile phase
在ESI模式下,流动相中少量的甲酸、乙酸会提高化合物的电离效率并有助于其色谱分离,本文以1 mmol/L 的乙酸铵为流动相分析加入0.04%、0.06%、0.1%和0.2%甲酸对20 种胺类物的分离效果。结果表明(图略)随着甲酸浓度从0.04%增加到0.2%,胺类化合物迅速解离成离子形式,在C柱上的保留不断减弱,部分目标物出现保留时间缩短、色谱峰重叠和拖尾等现象。当甲酸添加量为0.04%、0.1%和0.2%时,MeIQx 和IQx、NPYR 和IQ、TRP-P-1和AaC、MeIQ 和DMIP 的色谱峰重叠,只有当甲酸添加量为0.06%时MeIQx、IQx、NPYR、DMIP、TRP-P-1、AaC 的色谱峰可以有效分离,因此选择0.06%的甲酸加入乙酸铵中。在优化的UHPLCMS/MS 条件下,20 种胺类物标准溶液的总离子流色谱图和提取离子流图如图2 和图3 所示。
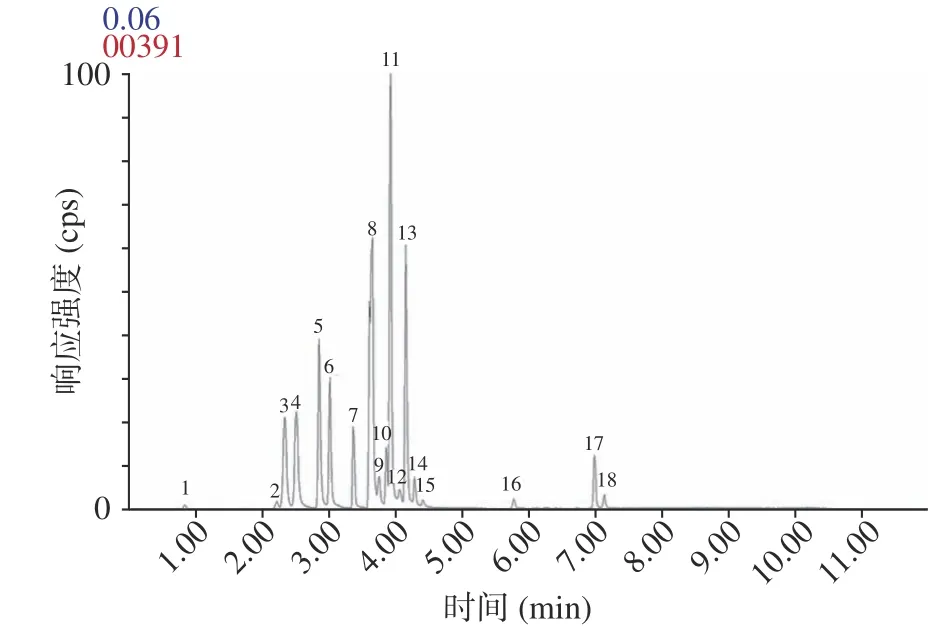
图2 流动相为1 mmol/L 乙酸铵0.06%甲酸条件下20 种胺类物质混合标准溶液色谱图Fig.2 Chromatogram of a mixed standard solution of 20 amines with the mobile phase 1 mmol/L ammonium acetate and 0.06% formic acid

图3 流动相为1mmol/L 乙酸铵0.06%甲酸条件下20 种胺类物质提取离子流图Fig.3 Ion flow diagram of 20 kinds of amines extracted with the mobile phase 1 mmol/L ammonium acetate and 0.06% formic acid
2.2 胺类物质提取条件优化
2.2.1 提取溶剂选择 不同化合物间极性差异较大,极性强度范围很广,热加工肉制品基质复杂,且富含油脂。因此,为了同时提取复杂基质体系中的目标化合物,非常需要探究提取溶剂适宜性。因此本研究以空白肉样为基质样品,分析90%乙腈水、乙腈、含0.1%甲酸的乙腈和乙腈/1 mmol/L 的NaOH 溶液(6/4,v/v)对20 种胺类物质回收率的影响。如图4 所示,以90%乙腈水、乙腈、含0.1%甲酸的乙腈为提取剂时,部分极性杂环胺和亚硝胺类的回收率低于60%,甚至NDBA 和NMOR 的回收率低于40%,在同时提取胺类物质时提取效率不稳定。当以乙腈/NaOH 溶液(6/4,v/v)为提取剂时,回收率稳定在69.46%~103.13%之间,具有良好的稳定性。

图4 20 种胺类物质在不同提取剂中的回收率Fig.4 Extraction recoveries of 20 amines in different extractants
2.2.2 纯化条件的优化 PSA 和HC-C是在QuECh-ERS 技术中常用的吸附剂。本研究以不同用量的PSA(20、30、40 和50 mg)以及30 mg PSA+30 mg HC-C分析对胺类物质回收率的影响。如图5 所示,随着PSA 用量的增加,胺类物质的回收率先降低后增加。当PSA 的用量增至50 mg,回收率相对较好。当以30 mg PSA+30 mg HC-C作为吸附剂时,DMIP、IQX、IQ 和MeIQ 的吸附率均低于60%,其余胺类物质的回收率降低。总体而言,使用50 mg 的PSA 作为吸附剂时可以获得良好的提取和纯化效果。
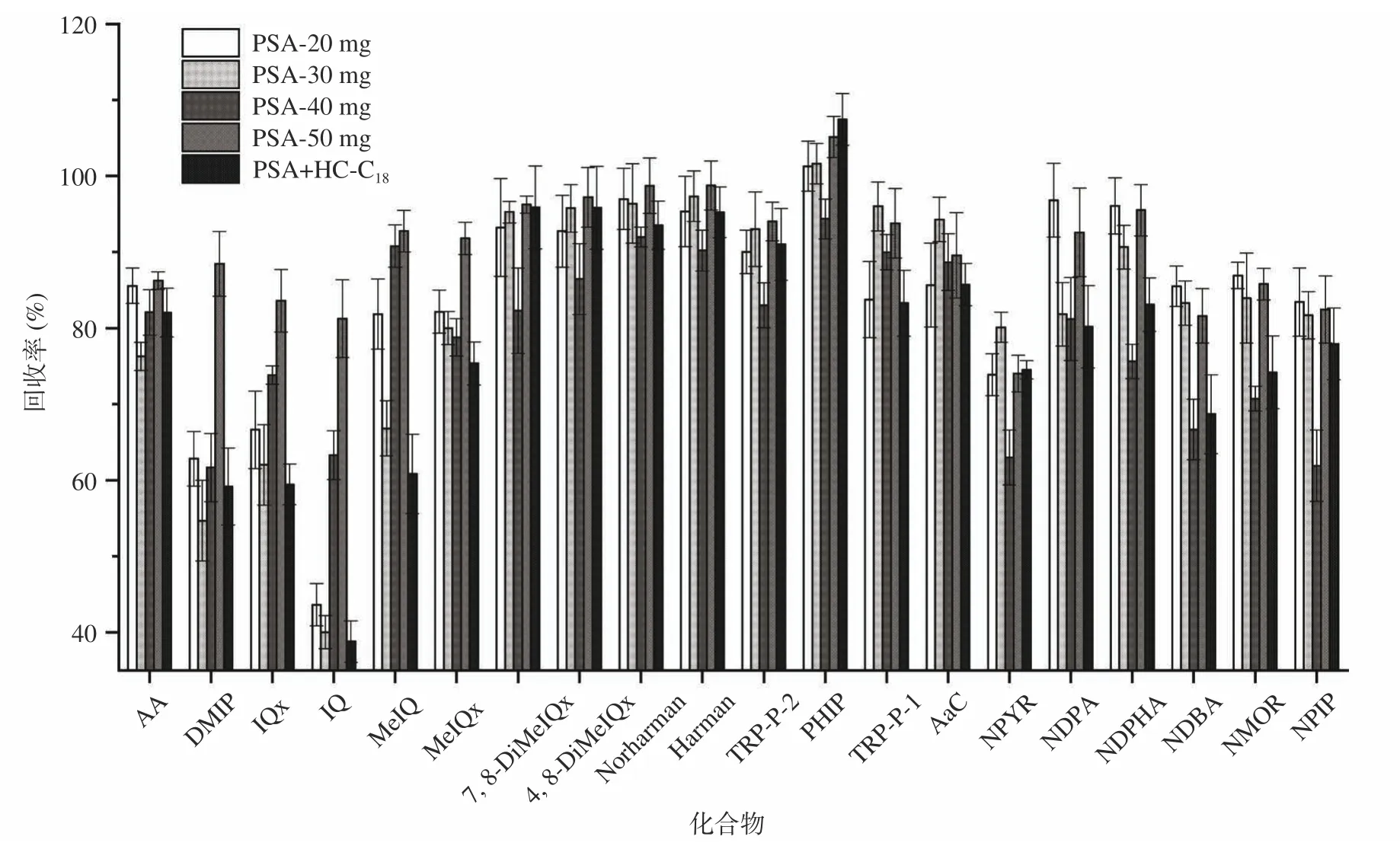
图5 20 种胺类物质在不同吸附剂中的回收率Fig.5 Extraction recoveries of 20 amines in different adsorbents
2.3 方法验证
2.3.1 线性关系、检出限、定量限和基质效应 基质效应(ME)由空白样品(B)和纯溶剂(A)的斜率之比计算(ME=B/A)。通常,ME<0.8 表示基质抑制,而ME>1.2 表示基质增强。基质效应结果如表2所示,DMIP、IQ 和TRP-P-2、NPYR 和NDPHA 的ME 均在0.41~0.79 之间,说明它们具有严重的基质抑制作用;IQx、NDPA 和NDBA 的ME 范围为0.80~0.83,具有轻微的基质抑制作用,可以忽略不计;其余目标化合物的ME 介于0.93~1.23 之间,基本没有基质效应。因此,为了进一步校准定量结果的准确性,采用基质校准曲线对目标化合物进行定量。
胺类物质的线性标准曲线和相关系数如表2 所示,溶剂校准曲线在其相应的浓度范围内呈线性,所有研究的AA、NAs 和HAAs 的测定系数均大于0.991。检测限(LOD)和定量限(LOQ)分别以产生信噪比的浓度(S/N)为3 和10 表示。20 种胺类物质的LOD 和LOQ 范围分别为0.01~1.6 ng/g 和0.03~4.8 ng/g,可以满足实际样品的定量检测。

表2 20 种目标化合物的标准曲线、检测限、定量限和基质效应Table 2 Standard curves,detection limits,quantification limits and matrix effects of 20 target compounds
2.3.2 回收率和精密度测试 通过3 个不同浓度(1×、5×和10×LOQ)下添加6 个重复样品来估算回收率。准确度表示为测量浓度和加标浓度之间的差异。精密度表示为相对标准偏差(RSD,%)。从表3 和表4 可见,日内回收率在66.3%~116.5%之间,3 个加标水平下回收率的平均值在70.2%~110.1%范围内。日内精密度在0.78%~9.0%之间,3 个加标水平精密度的平均值在3.8%~7.3%范围内。5×LOQ 加标水平计算的日间精度范围为3.4%~9.4%。结果表明这种特定类型脂肪基质的样品制备方法具有良好的可重复性,方法回收率高,准确度和精密度良好。整个方法具有良好的稳定性,可用于实际样品的检测。

表3 20 种胺类物质的加标回收率Table 3 Standard recovery rates of 20 amines

表4 20 种胺类物质的精密度Table 4 Precisions of 20 amines
2.4 煎烤产品的检测分析
采用本研究建立的方法测定3、5、7 min 下煎烤的四种肉制品,共检测出9 种胺类物质,见表5,包括AA,三种亚硝胺(NDPHA、NDBA 和NPIP),三种极性杂环胺(4,8-DiMeIQx、7,8-DiMeIQx 和PHIP)和两种非极性杂环胺(Norharman 和Harman),其他的胺类物质未检出。在相同的加热时间下,不同肉制品之间形成的胺类物质含量差异显著(<0.05)。这三个温度的设定,考虑分别界定煎烤模式下的微熟、熟和焦熟三种状态,但是由于四种肉的成熟条件有一定差异,又难以通过区别加热来衡量,因此在保证全部熟制条件下统一为如上三个时间。
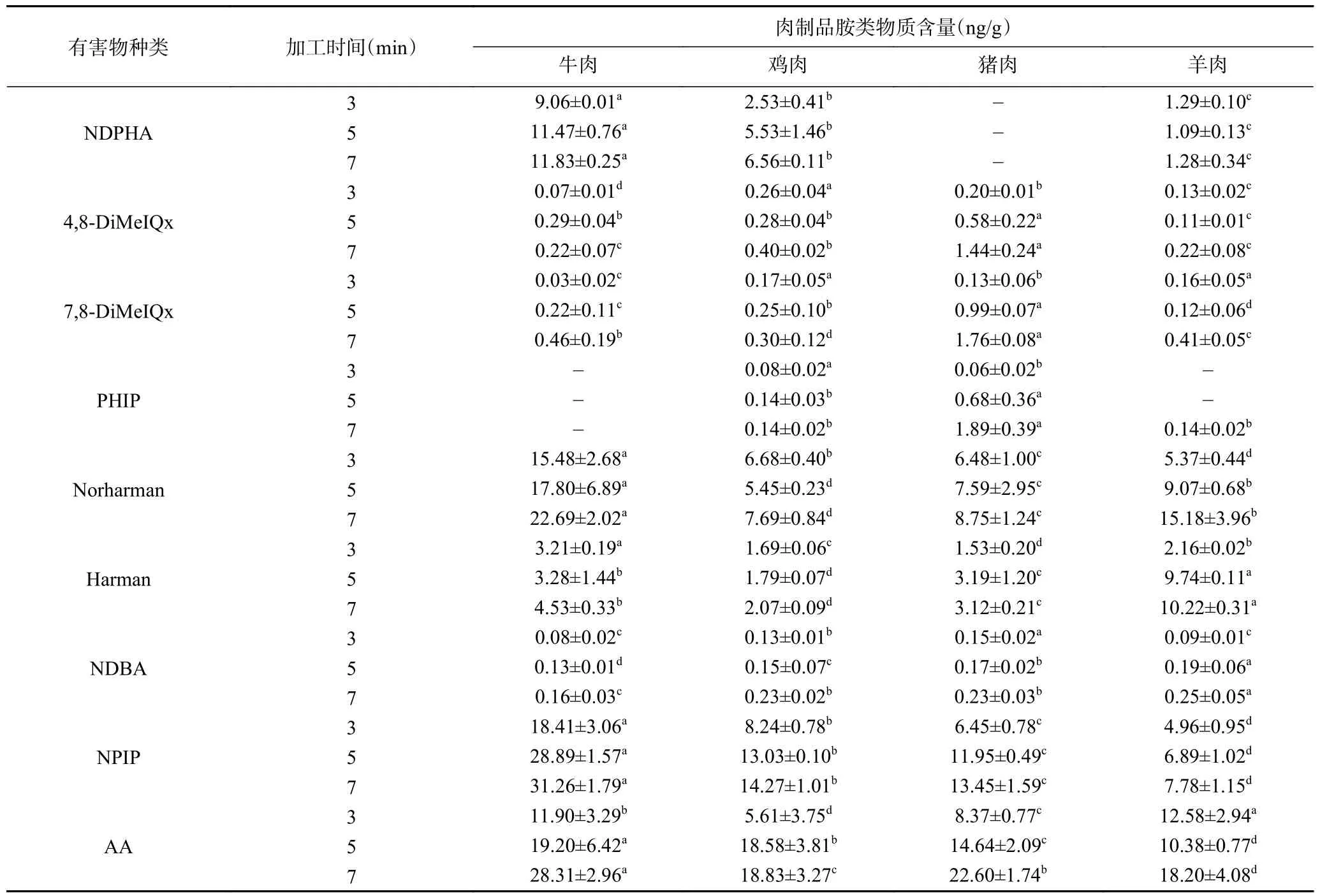
表5 煎烤3、5、7 min 四种肉品中胺类物质的含量Table 5 Amines contents in four types of meat products at grilling for 3,5,and 7 minutes
目前,国内未出台肉制品中AA、NAs 和HAAs的限量标准,但从表5 可见,随着煎烤时间的延长,每种肉制品中胺类物质含量均呈逐渐增加趋势。因此,在日常的煎烤肉制品过程中,在保证肉成熟的情况下避免煎烤时间过长,避免对人体健康造成危害。
3 结论
本文通过对色谱柱、流动相、盐析条件、提取剂、吸附剂等进行优化,建立了QuEChERS 技术结合UHPLC-MS/MS 同时检测分析肉制品中三种胺类物含量的方法。方法的线性范围在0.991~0.999之间,检测限和定量限分别在0.01~1.6 ng/g 和0.03~4.8 ng/g,日内平均回收率介于70.2%~110.1%之间。利用该方法测定煎烤肉品中胺类物质含量在0.03~31.26 ng/g。该方法实现了对三种胺成分的同时检测,改善了传统方法时间长、复杂、消耗溶剂量大的不足,能够对含脂肪基质原料(如猪肉、牛肉等)进行有效的胺类成分检测,适用于快速分析肉制品中的胺类成分。
