降温速率对梨瓜细胞冻干特性的影响
2022-09-27郎元路吴巧燕张志强陈佳楠计宏伟田津津
张 哲,郎元路,吴巧燕,张志强,陈佳楠,计宏伟,田津津
(天津商业大学机械工程学院,天津 300134)
冷冻干燥是最古老的食品保存技术之一,它使食品加工变得更容易,延长了食品货架期,并且允许相对较低的储存成本。真空冷冻干燥简称为“冻干”,是生产高质量产品的先进技术,同时也是一个复杂的过程,因为传质传热和物料微观结构的变化同时发生,微观结构的变化严重影响食品材料的整体运输过程和物理行为。
作为物料冻干的初始阶段,预冻在很大程度上决定了物料的冻干效果。因为果蔬物料切片冻结过程是一个发生在一定温度范围内的复杂相变过程,伴随有传质传热、晶核化、玻璃化、晶体生长、再结晶等阶段,均是真空冷冻干燥过程中至关重要的一部分。冰晶的形成及生长模式极大地影响了细胞的结构以及质量。Takako 等对有无电流负荷下植物组织细胞内冰晶的形成行为进行了分析,发现微电流负荷会降低细胞的变形程度和胞内冰晶晶粒尺寸。此外,超声波直接接触法、拉曼光谱法及灰度变化检测法等也被运用到冰晶的观测中。果蔬微观结构在预冻过程中的冰晶生成很大程度上影响着干燥速率,而降温速率决定了冰晶的形成和大小情况;降温速率对冻结体的结晶情况具有重要影响,会对冻干过程产生决定性影响。同时,预冻阶段决定了物料的空隙大小、形状以及连通性,适当的预冻速率即降温速率可以使物料样本获得较好的冰晶分布,大大提高冻干效果和产品质量。
降温速率的大小对细胞结晶具有重要影响。Shishehgarha 等研究了草莓样本组织切片和完整草莓在不同的货搁板温度下的各种特征参数(干燥动力学、颜色和体积变化)。张哲等研究了冷冻-复温过程中葡萄细胞的冰晶生长以及对细胞渗透率的影响,发现提高复温温度能有效减少细胞的破损。刘斌等研究了速冻速率对洋葱细胞的影响,发现细胞的结晶温度与细胞膜渗透率呈正相关。韦玉龙等研究发现物料干燥过程中随着湿度的减少,果肉细胞、空腔结构等参数的变化趋势均不具有一致性或连续性。通常情况下,细胞在高渗溶液中会发生皱缩,Prickett 等利用这一原理研究了细胞体积和细胞内冰晶形成之间的关联,发现在同一冻结条件下,细胞体积越大,生成冰晶的几率越大。Chi 等研究了真空冷冻干燥时淀粉凝胶的微观结构,由于水的冻结和冰晶的升华,冷冻干燥处理导致淀粉结构明显无序。
因此,本文采用实验室最新引进的新型真空冷冻干燥显微冻干台对梨瓜细胞在冻干过程中的结构变化进行动态观察研究,并量化分析过程参数对组织细胞结构的影响,深入研究果蔬微观结构的干燥机理,以获得梨瓜细胞冷冻的最佳降温速率,为梨瓜的预冻处理提供数据参考。
1 材料与方法
1.1 材料与仪器
本文所用实验材料为天津市韩家墅批发市场采购的新鲜梨瓜,果肉饱满,大小一致。在实验前进行清洗、切片。
实验设备为BX-53 型真空冷冻干燥显微分析仪(奥林巴斯株式会社),设备原理图如图1所示。该实验仪器主要由温度和压力控制系统、观测系统、FDSC196 型冷热冻干台(Linkam Scientific Instruments)、真空系统和液氮制冷系统组成。控制系统包括计算机、Linksys 操作软件以及控制器;观测系统由显微镜、CCD 相机、显示屏以及图像采集软件“TCapture”组成。真空系统包括Duo 3M 型高精度真空泵(德国PFEIFFER)以及冷热台内封闭腔室;制冷系统包括液氮罐、液氮泵以及装载物料垫片的冷热台台芯。在控制器的作用下由液氮泵将液氮充注入台芯从而达到制冷的目的。该系统可用于观察冻结与干燥过程中细胞内冰晶的位置、形成模式以及升华模式,并评估由于细胞内的冰晶而导致的细胞变形程度,以及不同冷却速率下细胞内冰晶的生长速率、粒度以及升华程度,在本研究中可对梨瓜组织细胞进行实时动态观测研究并获取冻干过程显微图像。文章采用的切片机为德国Leica Biosystems 生产的Leica VT1000 型切片机。此外,利用DSC(Q1000 型,美国TA 公司)测量共晶点、冰点温度,并利用Hot Disk 热常数分析仪(TPS2500S 型,凯戈纳斯仪器)测定梨瓜组织的导热系数。
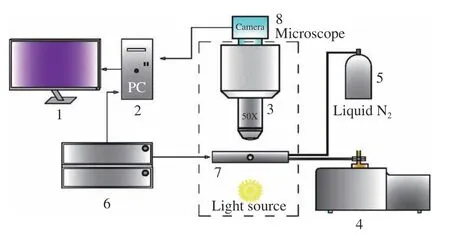
图1 真空冷冻干燥显微镜系统原理图Fig.1 Schematic diagram of vacuum freeze-drying microscope system
1.2 实验方法
本文首先经由真空冷冻干燥显微镜系统获取冻干过程的示意图,再通过图像处理获取梨瓜细胞形态参数,同时进行导热系数测量、密度测量、冰点温度及共晶点温度测量,所用测量仪器如图2 所示。
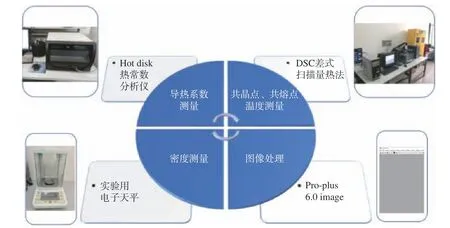
图2 实验参数测量仪器示意图Fig.2 Schematic diagram of the experimental parameter measuring instrument
1.2.1 真空冷冻干燥条件及显微镜观察 真空冷冻干燥显微镜系统操作流程如下:
a.用酒精棉将冻干台台芯和载玻片擦拭干净待其干燥;用Leica VT1000 切片机将梨瓜薄壁组织切成200 μm 厚度的样本,用镊子将切片置于专用载玻片上后放置在冻干台台芯,将盖玻片放在切片上,盖上冷台的密封盖,在环境温度压力下静置3 min 使样本状态稳定。
b.开启Linkam 降温控制系统和BX-53 显微镜,设置细胞放大倍数,选择轮廓清晰且饱满的细胞并进行聚焦。
c.设定过程控制程序,以一定的降温速率(5、15、25、35、50 ℃/min)进行冻结,在冻结终点停留1 min,以保证冻结完全,然后在一定真空度(10 Pa)下完成升华和解析干燥,整个过程中CCD 相机连续拍摄细胞照片以获得其冻干过程变化情况。将降温开始的时间设为冻结时间的开始。
d.利用图像处理软件处理梨瓜组织显微照片,获得结构特征参数,量化分析细胞变化情况。
1.2.2 导热系数测定 Hot Disk 热常数分析仪可用于测定梨瓜组织的导热系数,精度可达±3%,温度范围为10~1000 K;梨瓜组织被切成0.3 cm 左右的薄片;实验前开启Hot Disk 热常数分析仪预热半小时,然后将探头置于梨瓜切片切面上。通过软件对梨瓜在常温常压下的导热系数进行计算,进行三组平行实验计算测得的平均值。
1.2.3 密度测定 首先找一个干净的量筒,注入适量纯净水,用电子天平称量水和量筒的重量m,并记录量筒内水的体积V,然后切取一小块果蔬(长宽约1 cm)放入装水的量筒内,待其完全浸入水中,称量此时量筒的重量m并记录量筒刻度V,代入公式(m-m)/(V-V),计算出果蔬的密度。以同样方式对冻结前和冻结后的果蔬块分别进行三次平行实验计算平均值,获得冻结前后的果蔬密度。
1.2.4 共晶点、冰点温度的测定 利用差式量热扫描法测量共晶点、冰点温度。首先进行仪器校正,切取18 mg 左右的梨瓜样品置于样品坩埚内,用压封装置将坩埚皿与坩埚盖压紧,将样品坩埚与参比坩埚一同放入热圆盘内,设定冷冻复温程序进行实验,在进行差式扫描量热实验时,选择冻结终点温度为-35 ℃,以保证梨瓜样本内液相完全转变为固相。以50 ℃/min 的降温速率进行降温,然后以35 ℃/min的速率完成复温。
1.2.5 细胞形态学参数计算
1.2.5.1 细胞形态学参数 梨瓜细胞多呈圆形或椭圆形,本文假设细胞都为圆形,通过面积参数就可获得当量直径。利用BX-53 光学显微镜自带的TCapture图像处理软件即可以直接获得细胞的形貌,再利用Image Pro-plus 6.0 软件测取细胞的面积和周长。
当量直径d 计算公式如下:

式中:A 为细胞面积,μm;π 取3.14;d 为当量直径,m。
本研究中假设细胞形状为球形,各项载荷均匀分布,细胞形变与其体积V 和内压ΔP 的变化相关联,因此从三维角度分析细胞形变时可采用以下公式进行计算:

式中:L 为果蔬细胞周长,m;h 为果蔬细胞壁厚度,取1.26×10m;E 为果蔬细胞壁弹性模量,取2.67×107 N/m;ΔL 为果蔬细胞周长的变化量,m;为果蔬细胞壁的泊松比,取0.33;R 为变形后果蔬细胞的半径,m;r 为初始细胞半径,m;V 为细胞体积,m;ΔP 为细胞内压,kPa。
孔隙率是多孔介质内部孔隙的体积与整个多孔物料的体积之比,即多孔介质中孔隙占整个物料比例的大小;其通常包括线孔隙率、面积孔隙率以及体积孔隙率;孔隙率变化范围为0~1;对于从空间上随机选取的任意一点,线、面积和体积孔隙率一般是相同的,统称为多孔介质孔隙率。本课题采用面积孔隙率,采用下式进行计算:

式中:A为梨瓜组织显微照片中的孔隙面积,μm;A为显微图像中孔隙与非孔隙部位的总面积,μm。
1.2.5.2 形态学参数测量 图像处理软件Image Proplus 6.0 包括诸多方便且操作便利的模块,可以对实验数据图像进行采集、处理、测量和分析等操作。本文首先利用显微系统自带的TCapture 软件获取细胞冻干过程中的变化图并作标尺处理,再利用图像处理软件Image Pro-plus 6.0 对处理后的梨瓜细胞显微图像进行渲染处理,然后测量并计算分析其形态学参数,可直接测量细胞周长及当量直径,描述细胞平面结构特征的面积参数可根据像素点计算得到,然后将数据导入Origin 中生成为点线图,最终获得不同条件下微观结构参数的变化趋势。
2 结果与分析
2.1 梨瓜细胞冻干过程形态演化分析
2.1.1 梨瓜细胞群冻干过程形态演化分析 为了对单个梨瓜细胞的真空冷冻干燥过程进行科学深入的研究,有必要对包含多个细胞的组织切片进行实验研究,为单细胞冻干过程提供参考与对比。
如图3、4、5 所示为100 倍放大倍数下的多个梨瓜组织细胞(细胞群)在冷冻干燥过程中的微观形貌结构变化图像,分别以5、15、25 ℃/min 的降温速率进行冻结,发现梨瓜切片在原始状态下由于组织细胞内外充满细胞组织液,光可以穿透组织细胞内部从而使得视野亮度较大,能看到轮廓清晰且饱满的组织细胞,随着温度降低,光线逐渐变模糊至暗,这是由于冰晶的初步形成和增长至完全结晶这一过程中冰晶颗粒对光的散射效应所致。对已完全冻结的微观组织细胞进行干燥时,通过动态观察升华过程中不同时刻的冰晶分布,发现视野内细胞位置和大小分布各异,升华干燥时显微组织表面发生分散式升华,即在不同细胞表面或细胞间隙同时进行固气相变;由于冰晶升华界面的退却,表面由冻结时的光滑变得粗糙,随着细胞内外冰晶颗粒升华汽化的结束,组织内部逐渐有光通过多孔孔道;当解析干燥过程进行或完成时,组织微观结构几乎不再发生变化,光线只能穿过固定的孔道,此阶段只是去除具有较高吸附能的结合水,因此冻干显微镜视野内亮度不再发生变化;直观上发现与最初的具有饱满细胞的组织切片显微图像相比,干燥物料表面发生皱缩,形成疏松多孔的龟甲状或蜂窝状物料,有部分光线从孔隙穿过。

图3 梨瓜组织细胞结构变化(5 ℃/min)Fig.3 Changes in the structure of pear melon tissue cells (5 ℃/min)
2.1.2 单个梨瓜细胞冻干过程形态演化分析 如图6、7 所示为35 和50 ℃/min 的降温速率下冻结的单个梨瓜细胞在真空冷冻干燥周期中对应于不同阶段的细胞图片。由图可知,梨瓜细胞在干燥过程中由于相变和水分迁移等一系列复杂的传质传热过程而发生结构变化。从整体上看,显微照片的亮度呈现由亮变暗再变亮的趋势,原始细胞和干燥后的细胞轮廓分明清晰,而在冻干过程中其形态轮廓显得更为模糊,这是由于冻结和干燥过程中存在相态变化和水分迁移所致;在预冻过程中随着温度的降低,细胞内外逐渐形成冰晶并最终被冰晶包围,由于冰晶对光有散射效果,因此细胞图片会随着冷冻的进行逐渐模糊,当完全变暗时说明此时细胞已完全冻结固化;在干燥过程中,由于冰晶的升华,逐渐有光通过使得细胞图片变得清晰。同时,实验发现与原始的外表光滑、粒度饱满的细胞相比,干燥后细胞几何尺寸发生变化,细胞明显皱缩且细胞壁发生折叠。伴随着细胞的皱缩,细胞密度随之减小,实验测得冻结前的梨瓜组织密度为895.13 kg/m,与之相比,不同降温速率下冻结后的细胞密度均发生减小(表1),该结果表明细胞在冷冻干燥过程中损失了大量水分。
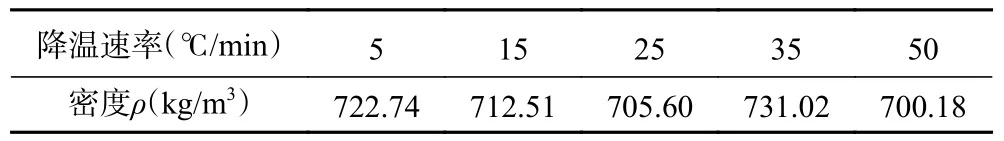
表1 不同降温速率下的冻结后样品密度Table 1 Density of frozen samples at different cooling rates
由图3、4、5 可知,随着降温速率的增加,梨瓜细胞在降温过程中的透光性也随之减弱,解析干燥后的细胞会逐渐变暗,轮廓愈加不清晰。这主要是由于冻结阶段冰晶的散射效果以及干燥阶段细胞内孔道的分布(孔隙率)所致。其中,图4 中的细胞皱缩程度最大,图4 与图5 相比,图5 中的细胞皱缩程度缩减,说明随着降温速率的增大,细胞形态变化程度开始减小。图6 与图7 中的单个梨瓜细胞干燥后同样变暗,图7 中的细胞轮廓变化程度比图6 中的高,说明随着降温速率的进一步提高,细胞形态变化程度开始增高。

图4 梨瓜组织细胞结构变化(15 ℃/min)Fig.4 Changes in the structure of pear melon tissue cells (15 ℃/min)

图5 梨瓜组织细胞结构变化(25 ℃/min)Fig.5 Changes in the structure of pear melon tissue cells (25 ℃/min)

图6 梨瓜组织单个细胞结构变化(35 ℃/min)Fig.6 Changes in single cell structure in pear melon tissue (35 ℃/min)
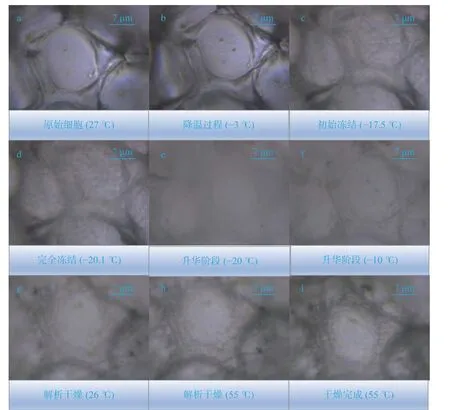
图7 梨瓜组织单个细胞结构变化(50 ℃/min)Fig.7 Changes in single cell structure in pear melon tissue (50 ℃/min)
2.1.3 冰点温度的变化 预冻结过程中降温速率对冻结过程所需时间和冻结温度具有较大影响。由图8可知,在慢速降温时,即当降温速率低于15 ℃/min时,随着预冻过程降温速率的增长,冻结时间以较大的梯度减小,而当降温速率大于15 ℃/min 时,冻结过程的时间变化梯度逐渐趋于平缓。降温速率为25 ℃/min 时,冻结过程的时间为102 s;而在50 ℃/min下冻结过程仅需51 s。因此,随着降温速率的增加,冻结过程所需时间由快速降低转为缓慢降低。由热常数分析仪测得,室温条件下,梨瓜组织的导热系数为0.367 W/m·K。快速降温过程中热流密度增大,单位时间内导热量增加,加快了传热速率,而降温速率越大,热流密度越大,使得冻结过程的时间越短。因此,随着降温速率的不断越大,冻结过程的时间越短。然而,较高的过冷度会破坏梨瓜细胞原有的结构进而影响其热物性,所以当降温速率大于15 ℃/min时,细胞热物性受到影响,随着速率的提升,传热速率的提升过程受阻,冻结过程时间的减小趋势开始变缓。
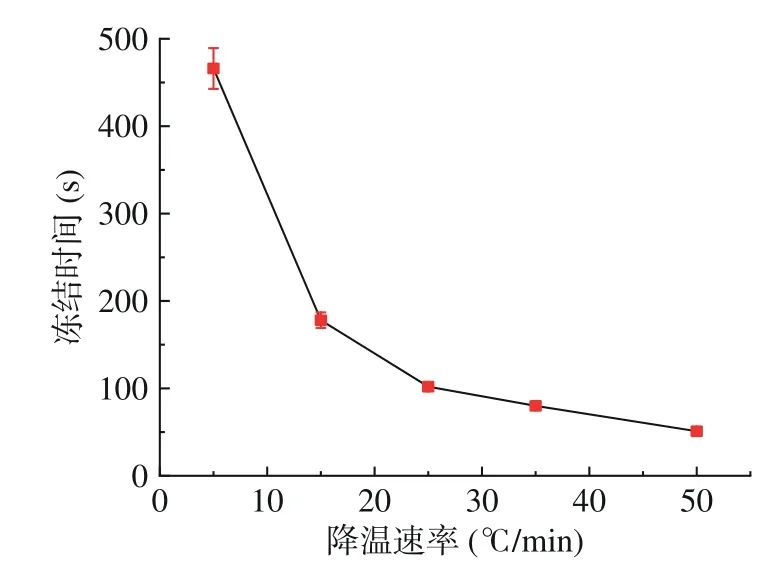
图8 不同降温速率下的冻结时间Fig.8 Freezing time at different cooling rates
由DSC 测得的梨瓜共晶点温度为-20.6 ℃(图9),在50 ℃/min 的降温速率下细胞冰点温度接近共晶点温度,这是由于较高的降温速率导致较大的过冷度,相应的冰点温度降低。图9 所示为冷冻-复温过程中的热流密度及温度曲线,从蓝线(温度线)可以看出,随着时间的延长,梨瓜细胞温度首先不断降低,随后在拐点处突然升高,这是由于液体在结晶瞬间释放大量的潜热,因而温度会突然升高,因此该拐点为共晶点。由图10可知,不同于冻结时间的变化趋势,冻结温度随着降温速率的增长整体呈逐渐降低的趋势。当降温速率为25 和50 ℃/min 时,冰点温度分别为-16.06 和-20.01 ℃。图中发现当降温速率大于25 ℃/min 时,梨瓜细胞的冰点温度下降趋势加快,这是由于低降温速率下胞外液体首先被冻结固化,使得细胞内外浓度不同,在渗透压作用下胞内水分向外迁移,在胞外形成块状大冰晶;在固液相变过程中,当降温速率较小时,相变所释放的潜热会弱化对细胞的降温,并且在较小的温度梯度下过冷度较小,故细胞的冰点温度出现大幅降低。而在快速降温时,温度梯度过于大,过冷度也大,相变潜热的影响就显得微不足道,也不再出现冰点温度骤降的现象。同时,果蔬切片内部冰晶形成需满足两个基本条件,即过冷度和晶核形成,当达到一定的过冷度时,随着温度降低,水分子由于密度变化发生迁移不断结合到晶核上,转件生长最后形成冰晶,而适当增加降温速率可以达到要求的过冷度。
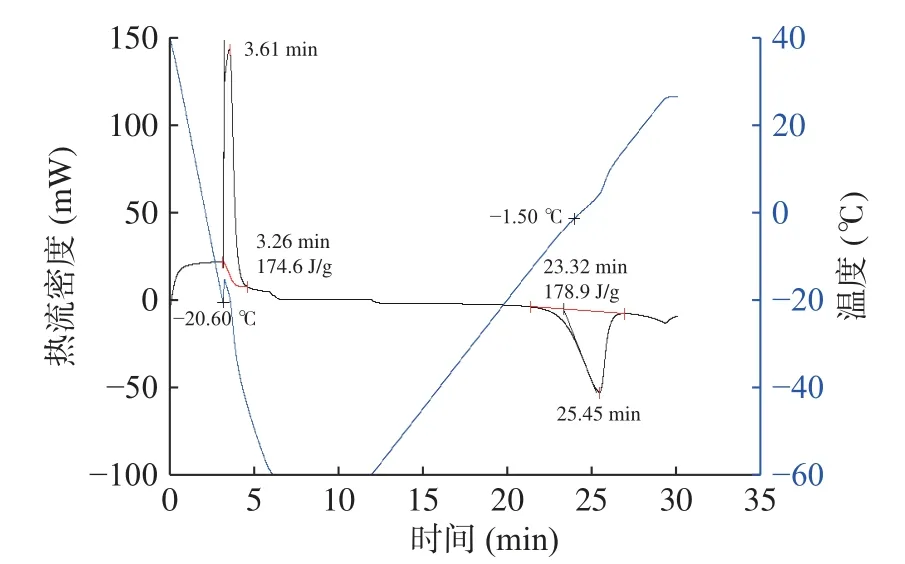
图9 冷冻-复温过程DSC 曲线Fig.9 DSC curve of freezing-rewarming process
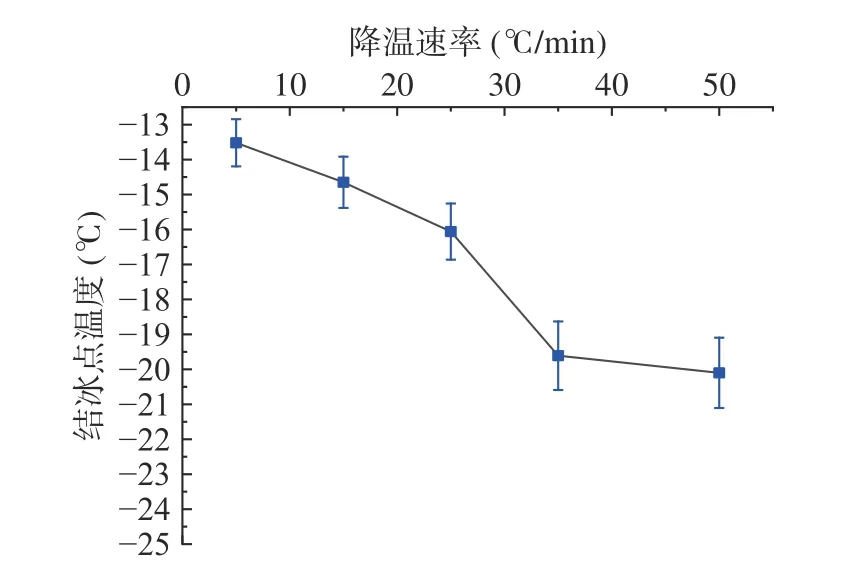
图10 不同降温速率下梨瓜细胞冰点温度变化Fig.10 Variation of the freezing point of pear melon cells at different cooling rates
2.2 细胞形态学分析
为了全面反映预冻速率对梨瓜细胞结构在真空冷冻干燥过程中的影响,可以对梨瓜细胞形态结构利用不同维度的形态学参数描述并进行量化分析,本部分首先通过图像处理软件获得细胞的结构特征参数,针对梨瓜细胞在5、15、25、35 和50 ℃/min 的降温速率下进行预冻结时冻干过程中细胞结构参数的变化进行研究分析,设置了冻干时间,表示细胞的冻结过程及随后的干燥过程的时间变化。
2.2.1 一维结构参数变化 一维形态学参数(周长、当量直径)是描述细胞结构变化最直观的参数,由图11 可知,在各预冻降温条件下,测得的细胞周长和当量直径的变化趋势基本一致;同时,随着真空冷冻干燥过程的进行,一维形态学参数变化率逐渐增加,即周长和当量直径随着过程的进行不断减小,在5、15、25、35 和50 ℃/min 的降温速率下,周长和当量直径的最大变化量分别为20.8%、9.69%、9.3%、11.85%、15.3%和20.96%、11.81%、9.05%、15.05%、17.1%,发现随着降温速率的增长,细胞一维几何参数的变化率先减小再增大。该现象表明细胞一维形态表面与降温速率呈波动关系,细胞表面结构在低降温速率与高降温速率下均出现大幅的变化,不利于细胞结构的稳定。由此可见,较低和较高的降温速率都不利于冻干过程中细胞一维原始形态结构的维持。

图11 一维形态学参数随冻干时间的变化Fig.11 Changes of one-dimensional morphological parameters with freeze-drying process time
2.2.2 二维形态学参数变化 如图12 所示为单个梨瓜细胞在冻干过程中面积参数的变化情况,从图中可以发现,随着冻干过程的进行,面积变化率不断增加,即细胞表面积逐渐皱缩减小;不同预冻条件(5、15、25、35、50 ℃/min)下完成干燥时,与初始时刻饱满细胞的面积相比较,干燥前后细胞面积分别变化了29.9%、22.7%、17.3%、27.8%和31.3%,随着预冻速率的增大呈先减小再变大的趋势,以25 ℃/min 的降温速率预冻后完成干燥时的变化率最小,故在该降温速率下细胞二维形态学参数变化最小,在25 ℃/min的预冻速率下冻结的梨瓜组织中细胞破坏和分离程度较低,有利于传质过程的顺利进行,最终较好地维持了初始状态下的二维微观结构特征。
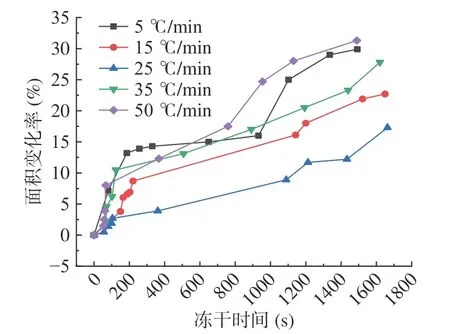
图12 细胞面积随冻干时间的变化Fig.12 Changes of cell area with freeze-drying process time
2.2.3 三维形态学参数变化 细胞体积变化量可以立体化地反映细胞受外界载荷作用时的变化程度,根据软件测得的细胞周长,代入公式计算得到细胞的体积几何参数。冷冻降温速率对细胞的不可逆破坏对干燥阶段质量传递的扩散系数具有影响,即显著影响梨瓜细胞脱水过程,最终体积发生变化的同时结构稳定性也有所改变。同时,冷冻速率和膜的渗透性对细胞的体积收缩具有显著影响,其中膜的渗透性对细胞体积收缩率的影响较冷冻速率更为显著。针对同一种物料而言,细胞膜的渗透性相差无几,因而冷冻速率是影响梨瓜细胞体积收缩的主要因素。
如图13 所示为细胞冻干过程中对应于不同预冻速率的体积变化过程,可以发现随着真空冷冻干燥过程的完成,细胞体积变化率呈现出不同程度的增长。在各降温速率下,与原始状态相比,干燥后细胞体积的变化率分别为50.35%、26.35%、25.39%、31.5%、39.14%。即随着预冻速率的增大,细胞体积变化率在干燥前后呈先减小再缓慢增长的趋势,在25 ℃/min的预冻条件下三维特征参数变化值最小。细胞体积的变化主要受细胞内液体(细胞内液、自由水及结合水)含量的影响。在低降温速率下,梨瓜细胞在膜的渗透作用下会发生失水现象,导致梨瓜细胞产生明显收缩,同时,低降温速率产生的温度载荷同样使细胞损伤严重,同时受到细胞外形成的冰晶的挤压,体积变化率较大。在较高的降温速率下,细胞在冻结阶段不会发生明显的收缩,细胞间隙快速产生大量分布均匀的小冰晶,不会挤压细胞,然而,较高的过冷度使得细胞内快速产生小冰晶,胞内冰晶的密集排布会损害细胞基质,细胞内发生水分迁移,共同造成了细胞体积变化率较大的现象,最终使细胞变化率随降温速率的增大呈现先减小后增大的趋势。

图13 细胞体积随冻干时间的变化Fig.13 Changes of cell volume with freeze-drying process time
2.2.4 细胞内压变化 如图14 中所示为5 种不同降温速率下冻结后冻干过程细胞内压的变化情况,在200 s 以内的预冻结阶段,内压变化量较小,其在冻结阶段最大为350 kPa,在高降温速率下冻结阶段单位时间内的内压变化较大。随着过程的进行内压变化逐渐增大,同时发现随着降温速率的增长,内压的最大变化量先减小再增大,而且由于细胞大小差异,同一降温速率下冻干的细胞在干燥后内压也会出现较大差距。

图14 细胞内压随冻干时间的变化Fig.14 Changes of intracellular pressure with freeze-drying process time
过低的降温速率下,细胞内压与细胞体积的关联性较强,二者的变化呈正相反。这是由于低降温速率下细胞内自由水发生膨胀,细胞内压减小进而使细胞体积增大,随着细胞间隙产生大的冰晶,细胞内压增大,在内压作用加之慢速冻结时细胞膜的渗透作用,细胞内水分析出并流至细胞间隙,使得细胞间隙的冰晶体积进一步增大,再度挤压细胞使得细胞体积减小。
过高的冷冻速率对梨瓜细胞在冻干过程中也产生不利影响,快速冷冻在微观组织中形成更小、分布更均匀的胞内冰晶的可能性很大,但是产品的质量并未完全保持。可以从两方面解释,一方面可能是快速冷冻过程伴随较大过冷度和瞬时冰晶成核促进了剧烈的水分迁移,即细胞内的水分朝细胞间隙迁移,因此引起梨瓜细胞结构的显著降解。另一方面,在快速降温工况下,细胞内部水分来不及向外迁移,从而在胞内生成较为密集的冰晶,致使冰晶对细胞内部造成机械损伤,内部细胞器受到破坏。因此,并非降温速率越高越好,不论是对果蔬的冷冻还是冻干保存,选择适当的降温速率显得至关重要。
2.2.5 孔隙率变化 孔隙率作为表征多孔介质孔隙分布的参数,可以用来评价干燥后果蔬物料的结构稳定性,如图15 展示了冻干后的梨瓜切片组织孔隙率受预冻阶段降温速率的影响情况,可以看出,随着降温速率的增加,孔隙率迅速增大然后趋于平缓,在5 ℃/min 的降温速率对应的孔隙率为32.7%;而当降温速率大于5 ℃/min 时,孔隙率受降温速率影响较小,在一定范围(46%~47%)内波动,不再有明显增长或减小。这可能是由于快速降温形成细小冰晶,细小冰晶升华后的微孔有助于解析干燥的进行,在干燥阶段细微结构受温度和压力影响较小所致。此外,不同的降温速率下冻结阶段造成细胞的破裂与分离程度也不同,进一步对干燥阶段产生影响,致使干燥物料的质构和稳定性发生不同程度的变化,所产生的物料孔隙率也各不相同。物料的孔隙率越大,其结构稳定性越高。由图15 可以看出,15~50 ℃/min 的降温速率下梨瓜组织细胞具有较高的孔隙率,孔隙分布区域越大,越有助于梨瓜组织真空冷冻干燥时保持梨瓜内部的微观孔道结构,结构稳定性较好。

图15 孔隙率随降温速率的变化Fig.15 Variation of porosity with cooling rate
3 结论
为了探索保持梨瓜细胞微观形态结构的最佳冷冻速率,本文研究了预冻过程中不同降温速率对梨瓜细胞微观结构及相关特征参数的影响,分析了细胞在不同预冻条件下干燥时细胞面积、周长、当量直径、体积、内压和孔隙率的变化情况,结果表明:在25 ℃/min 的降温速率下,梨瓜细胞结构最稳定,最有利于保存。当降温速率为25 ℃/min 时,细胞形态学参数和内压变化最小,对果蔬组织的损害最小;当降温速率大于5 ℃/min 时,孔隙率受降温速率的影响较小,在一定范围内发生微小波动,各个细胞间结合稳定度最好。
过高和过低的降温速率都不利于梨瓜细胞的冻干。过高与过低的降温速率下,细胞形态学参数变化率较大,一维至三维参数(面积、周长、当量直径、体积)均随着降温速率的增大而呈现先减小后增大的波动趋势。
梨瓜细胞轮廓的透光度受冰晶散射及孔隙率的影响。在冻结阶段,冰晶散射强度随降温速率的提高呈先减小后增大的趋势;在干燥阶段,降温速率大于5 ℃/min 时,孔隙率一直保持在较高的数值,与5 ℃/min 条件下相比,干燥后的细胞轮廓更加清晰。
