碳氢燃料在激波管内的裂解试验与动力学研究
2022-09-26马志豪吕恩雨董永超刘瑜娜
马志豪,吕恩雨,董永超,王 鑫,刘 成,刘瑜娜
(河南科技大学 车辆与交通工程学院,河南 洛阳 471003)
在内燃机缸内燃烧过程中,裂解反应总伴随着氧化反应同时进行.在高温下,燃料裂解生成小分子产物,主要包括一些 C2、C3和 C4物种,然后进行下一步氧化,这些物种的成分决定了燃料的氧化速率进而影响其燃烧特性[1].此外,这些物种可由后续的聚合反应生成高碳物种,如多环芳香烃(PAHs).理论研究[2]表明,PAHs是碳烟的前驱体.因此,为了更深入地了解燃烧过程,提高燃烧效率和降低排放,详细地研究燃料的裂解特性是十分有必要的.此外,对热解过程中稳定物种摩尔分数的测量也可为化学反应动力学模型的构建提供重要的参考[3].由于发动机中试验条件比较复杂、变量较多,难以对温度或压力等单一变量对裂解过程的影响进行深入研究.激波管、流动反应管和间歇式反应器等都是用来研究燃料裂解的工具,然而激波管可通过激波对介质进行非等熵、绝热压缩,能够在毫秒级甚至更短的时间内将混合气提升至理想的压力和温度,实现压力和温度的准确控制;同时,激波管能从高温状态以极短的时间降至室温,可直接通过气相色谱或者质谱分析裂解产物,试验可重复性高,是研究化学反应动力学的首选设备[4].Malewicki等[5]利用高压激波管进行了正癸烷和正十二烷热解与氧化试验.Johnson等[6]通过不同的多波长方法测量了激波管中 JP-10热解产物的种类.Murata等[7]利用激波管研究了异辛烷/氢气高温裂解过程中碳烟的形成.
正庚烷和异辛烷是用于评价汽油辛烷值的两种参考燃料.正庚烷是化石燃料中较为重要的长直链烷烃,十六烷值为 56,与柴油的十六烷值比较接近[8],应用十分广泛.异辛烷是具有代表性的长支链烷烃,辛烷值为 100,抗爆性能好.为了更好地研究内燃机燃料的燃烧特性,众多学者常选用正庚烷和异辛烷作为柴油和汽油的替代燃料,因为柴油和汽油由数百种烃类组成,成分十分复杂,对其直接进行燃烧化学反应动力过程的研究相当困难.因此,笔者选用正庚烷和异辛烷为裂解试验燃料,从而为柴油和汽油等实际燃料的燃烧过程提供重要的参考价值.
国内外学者通过各种试验装置如激波管[9-12]、射流搅拌反应器[13-15]和快速压缩机[16-18]对正庚烷和异辛烷的燃烧和氧化等方面进行了广泛的试验,而关于这两种燃料的热解研究相对较少.其中,Chakraborty等[19]通过管式反应器在 793~953K、0.10~2.93MPa条件下研究了正庚烷的热解过程,发现随着压力的增加,裂解产物氢气、甲烷、乙烯和丙烯的生成量降低,丙烷、正丁烷和正丁烯的生成量增加,并对 Rice-Kossiakoff机理进行了修正.Pilla等[20]研究了在1350~1950K和0.13~0.33MPa条件下正庚烷和乙烯分别在氩气稀释下的热解.Yasunaga等[21]利用激波管研究了正戊烷、正己烷和正庚烷高温条件下的热解,测量了1000~1500K、0.10~0.25MPa条件下裂解产物的摩尔分数.国内关于正庚烷的热解主要集中于数值模拟研究.Li等[22]利用化学动力学模拟和反应力场方法研究了正庚烷在高温条件下的热解,发现热解产物的产量主要由温度决定,乙烯的产量随着温度的升高迅速增加.Ding等[23]利用 ReaxFF分子动力学方法模拟了正庚烷在 2000~3000K条件下的热解,详细地分析了温度对正庚烷高温裂解过程以及产物分布的影响表明,正庚烷的热解可分为三个阶段,高温可以促进正庚烷的分解,但是当温度达到一定程度后其影响逐渐变小.
Davidson等[24]通过测定反射激波后甲基的摩尔分数研究异辛烷和正庚烷的热解过程,认为甲基的生成反应主导了热解反应的进行.Shen等[25]利用射流搅拌反应器(jet-stirred reactor,JSR)在 0.1MPa和873~1173K条件下进行了包括异辛烷在内的C8烃类的热解试验,发现异辛烷的主要裂解小分子产物为氢气、甲烷和丙烯.Malewicki等[26]使用加热的高压单脉冲激波管研究了异辛烷的热解与氧化及相应的化学动力学模拟.Wang等[27]通过同步加速器真空紫外光电离质谱法研究了低压下流动反应器中异辛烷的热解.
国内外研究者对于正庚烷和异辛烷的研究主要集中于其燃烧和氧化特性,而对于裂解的试验数据相对较少,构建一个精确的化学反应动力学模型也需要温度和压力范围更广的试验数据来完善.碳氢燃料裂解会产生含量不等的几十到上百种产物,目前很难通过仪器得出所有组分含量,所有裂解产物中较多的还是小分子的烷烃(如甲烷、乙烷和丙烷等)和烯烃(乙烯、丙烯和丁烯等).因此,笔者利用激波管对燃料在 1200~2100K、0.22~0.28MPa条件下的裂解过程进行了研究,测量了燃料裂解完成后 C1~C4以下的小分子产物(CH4、C2H4、C2H2、C3H6、C3H8和C4H8-1)的摩尔分数,并利用 CHEMKIN 软件模拟激波管内部的裂解过程,详细地分析了这些小分子产物的生成路径以及敏感性分析,以期为发动机燃烧与排放特性的优化提供一些参考,并为验证化学反应动力模型提供试验依据.
1 试验装置及方法
1.1 试验装置
试验在横截面为圆形的不锈钢化学激波管上进行,关于激波管的详细介绍参见文献[28].试验前,利用真空泵将高、低压段和混气罐抽至极限真空,关闭混气罐与低压段连接的阀门,在混气罐内预先配制好混合气.打开阀门,然后将配制好的混合气充入低压段,将高纯氦气(99.999%)按照设定的压力充入高压驱动段,通过针刺破膜方式实现破膜高、低压段形成的压力差,可产生所需激波,从而诱导燃料裂解.试验装置如图1所示.
试验段侧壁放置 3个相互间隔为 200mm的压力传感器,因为采集到的压力信号较微弱,故在每个压力传感器后加装低噪声电压前置放大器,以准确采集测量点在试验过程中压力的变化.通过示波器连接所有压力传感器,示波器采集模式为单次采集,以PCB1为其触发信号.根据各压力测量点之间的距离和激波到达不同测量点之间的时间差,计算出激波的平均速度,结合理想正激波方程,得到反射激波后的裂解温度和压力.由于激波的衰减,激波速度不确定度约为0.2%.对应的裂解温度误差为±15K,压力计算误差为±0.01MPa.试验完成后,打开低压段末端的阀门,通过采样袋对裂解产物进行收集,由于激波管冷却速度过快,常温下呈现液态的产物遇到管壁立即液化,因而采样袋收集方式只针对气体产物.将收集的产物再通入气相色谱仪(GC),利用 50m BOND/KCL毛细管色谱柱和氢火焰离子化检测器(FID)进行定量分析,测量得到的物种摩尔分数的相对误差在 10%以内.为了保证试验结果的准确性,在试验之前,设定相同的试验工况(T≈1400K)重复试验3次,每次试验结束后收集的裂解产物均通过GC测量3次,得到的实际温度以及物种摩尔分数值均在误差范围内,如图2所示.图中,n(C)代表产物的摩尔分数,n(C0)表示燃料的初始摩尔分数.
所用燃料为正庚烷和异辛烷,纯度均为 99%,稀释气体选用高纯氩气(99.999%).通过激波管雾化预混系统配制混合气,正庚烷和异辛烷都易挥发,经过拉伐尔喷管产生的高速气流剪切进而破碎雾化,可在混气罐中形成混合均匀的两相气溶胶.为减少液滴撞击进气管路壁面以及壁面吸附,采用大管径、低速流和小拐角的低压试验段端部进气装置设计.此外,在靠近膜片的位置安装抽气口,使混合气在试验段内形成连续进气状态,持续抽气 1~2min,可在试验段形成均匀稳定的混合气.廖钦等[29]用二维米勒散射法测量了低压段激波管内的煤油/空气溶胶粒径的分布状态,发现连续进气方式可以有效地使混合物在低压段均匀分布,气溶胶平均粒径维持在 2~5µm,根据气溶胶理论,粒径小于10µm可形成稳定可悬浮的气溶胶.另外,Davidson等[30]认为在激波试验中,燃料经过拉伐尔喷管雾化形成的气溶胶颗粒尺寸与燃料种类关系不大.
1.2 动力学模型
基于激波管试验,通过 CHEMKIN软件中的闭式均相反应器模块模拟燃料的裂解过程,模拟条件与激波管内的试验条件一致,试验温度为 1200~2100K.对于正庚烷,选用正庚烷的氧化模型(NUIG模型)[31],该模型适用温度范围(600~1800K)较广,包括 1268种组分和 5336个反应.此外,还选用Herbinet模型[32],该模型包含正构烷烃在低温和高温条件下所有类型的基本反应,其有 303种组分和1994个反应.异辛烷选用 Atef模型[33]和 Wang模型[27],这两个模型在低温和高温(550~1700K)以及内燃机重要的宽压力(0.3~5.0MPa)范围内都表现良好,其中 Atef模型包括 2768种组分和 9263个反应,Wang模型包括321种组分和1569个反应.基于生产率分析(ROP)和敏感性分析讨论了正庚烷和异辛烷的反应路径.
2 试验结果及分析
2.1 正庚烷的裂解试验
2.1.1 裂解产物摩尔分数分布
试验检测了 1200~2100K、0.22~0.28MPa和3%的正庚烷在氩气稀释中的裂解产物.在试验温度范围内,通过对裂解产物中气体成分进行分析,得到主要的低碳裂解产物 CH4、C2H4、C3H8、C3H6、C2H2和 C4H8-1的摩尔分数分布,并将相同试验工况下的模拟结果与试验结果进行对比,如图3所示.C2H2摩尔分数随着温度的增加而升高,且升高速率较快.其他产物的摩尔分数均随着温度的升高先增加后降低,其中,CH4的摩尔分数缓慢增加,在 1850K 时达到最大值然后开始下降;C2H4的摩尔分数约在 1600K达到最大值;C3H6约在 1500K达到最大值;C3H8和C4H8-1的摩尔分数约在1400K达到最大值.在正庚烷热解过程中,C2H4是最主要的产物,占比最高;CH4、C3H6和C2H2也是比较重要的产物.在所测的3种烯烃产物中,C2H4>C3H6>C4H8-1,且最大摩尔分数对应的温度随着含碳数的增加而减小,这主要是因为更高的裂解温度促进了二次裂解的进行,使得碳数较多的产物裂解为更小和更稳定的分子.此外,除C2H2外,其他产物在最低试验温度均有生成,而C2H2在1600K左右才明显生成.由ROP分析可知,C2H2主要是由 C2H4的进一步分解生成的,故 C2H2高于 C2H4的生成温度.另外,C2H2所含有的碳碳三键的键能大于 C2H4中碳碳双键的键能,键能越高其生成难度越大.因此,可以推测,随着温度的升高,裂解生成的小分子烃类的不饱和度增加.

图3 正庚烷裂解产物摩尔分数随温度的变化Fig.3 Mole fraction of n-heptane pyrolysis products varying with temperature
在温度为1200~1450K时,Yasunaga等[21]试验数据与笔者试验数据变化趋势基本类似,这也直接证明了笔者试验结果的可靠性.模拟与试验得出的产物摩尔分数变化趋势有较好的一致性,但模拟结果整体高于试验结果,且 Herbinet模型未完全包括 C3H8的相关反应,故缺少 C3H8的摩尔分数曲线.两种模型中,NUIG模型对试验结果的预测更为准确.
2.1.2 反应路径分析
为探究不同温度对正庚烷裂解反应路径的裂解影响,在试验温度内选择 1300K和 1600K进行路径分析.在 1300K时,正庚烷的分解转化率为35.3%,1600K时则对应较高的转化率为 84.6%.反应路径分析如图4所示,分数代表该反应消耗燃料所占的比例(红色表示温度为 1300K;蓝色表示温度为1600K).
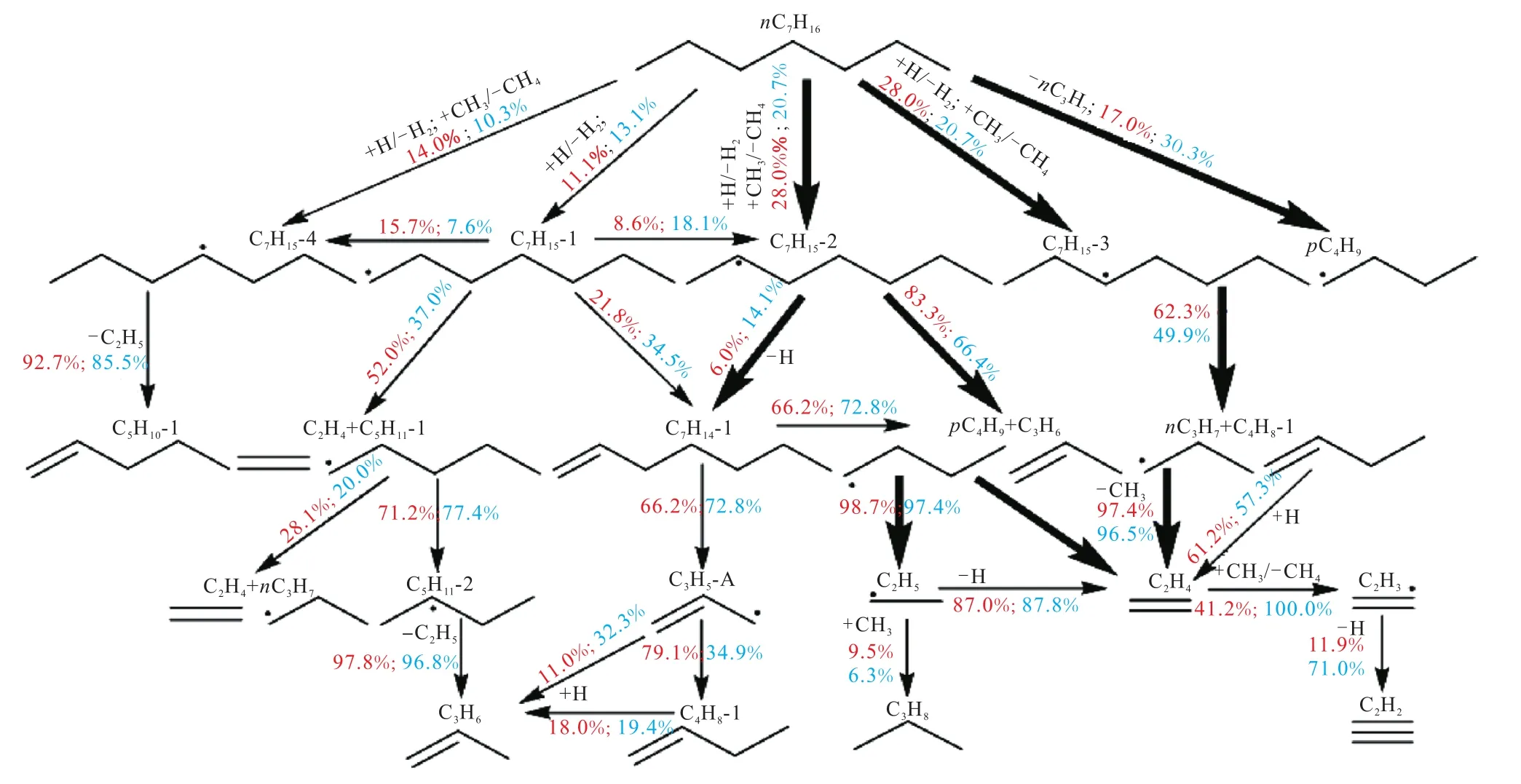
图4 正庚烷裂解反应路径分析Fig.4 Reaction pathways analysis of n-heptane pyrolysis
由反应路径分析可以看出,正庚烷主要通过直接断裂 C—C键和夺氢反应消耗.在 1300K时,通过直接断裂 C—C键生成的 nC3H7(正丙基)和pC4H9(正丁基)消耗了正庚烷总量的 17.0%.当温度升至 1600K时,正庚烷通过直接断裂 C—C键消耗的比例上升至30.3%,主要原因是更高的温度可提供给正庚烷反应体系更高的能量,进而能够引发更大比例的C—C键断裂.H/CH3自由基夺氢反应几乎完全占据了剩余正庚烷的消耗,并生成 4种不同结构的C7H15自由基,正庚烷2号位和3号位上碳原子脱去氢原子的比例较大(28.0%,20.7%),4号位次之(14.0%,13.1%),1 号位最低(11.1%,13.1%).反应占比不同的主要原因是键能大小的差异,如图5所示.Yuan 等[34]通过 CCSD(T)(Coupled Cluster,Singles,Doubles and Triples)方法计算得到的正庚烷的键解离能,伯碳上的 C—H 键能(408.8kJ/mol)比仲碳的 C—H 键能(396.7kJ/mol)高,故仲碳上的夺氢反应更容易进行.此外,由于正庚烷是直链烷烃,分子结构具有对称性,故生成的 C7H15-2和 C7H15-3约是生成C7H15-4的2倍.

图5 正庚烷的C—C和C—H键解离能Fig.5 C—C and C—H bond dissociation energies of nheptane
正庚烷初级分解产生的 4种 C7H15自由基后续通过异构化、C—C键断裂和 β断裂生成较小的烷基和烯烃,烷基自由基会进一步发生 β断裂,而烯烃主要通过夺氢反应被消耗.其中,C7H15-2主要通过 β断裂生成 pC4H9和 C3H6,该反应是 C3H6的主要生成路径.pC4H9进一步发生β断裂,生成C2H5自由基和C2H4,C2H5自由基脱氢生成 C2H4,这两个反应均是生成 C2H4的主要来源.C3H8主要来自于 CH3和C2H5的结合反应.C7H15-3主要通过β断裂反应生成nC3H7和 C4H8-1,这两种自由基均能通过断裂 C—C键生成 C2H4.C2H4通过 CH3夺氢生成 C2H3,C2H3继续脱氢生成C2H2.结合C2H2摩尔分数分布图和反应路径分析可知,C2H2在温度为1300K时几乎没有生成,在 1600K时才有明显生成,这主要是因为只有在更高的温度条件下,大量的 C2H4被进一步消耗,生成 C2H2,而 C2H4摩尔分数开始降低.CH4主要是由CH3引发的夺氢反应生成的.
2.1.3 敏感性分析
将某些特定反应的指前因子 A变化一极小量△A,其所引起的目标物种的摩尔分数 C的变化量△C,即为敏感性分析,是一个偏微分的概念,灵敏度系数 S的定义如式(1)所示.为了探究某些重要的反应对正庚烷以及裂解产物摩尔分数的影响,进行了正庚烷以及裂解产物在1300K和1600K下的敏感性分析,如图6所示.正灵敏度系数表示对产物摩尔分数增加有促进作用,反之,负值表示对产物摩尔分数的增加有抑制作用.

由图6可知,加快正庚烷热解最重要的反应为C—C键的直接断裂反应(R8),并导致C2H4、C2H2和C3H8的摩尔分数升高.R8对 C2H4生成影响最大的原因是 nC3H7和 pC4H9均是生成 C2H4的重要来源.pC4H9通过 β断裂反应生成 C2H4和 C2H5,C2H5通过 R4反应生成 C2H4,由反应路径可知 C2H5是生成C2H4的主要路径,故R4对C2H4的敏感度仅次于R8.除了 R8,对 C2H2生成影响最大的反应是 R7和R6,因为两者均能生成C2H3,而C2H3正是C2H2的主要来源.促进C3H8生成最重要的反应为R5,反应R4抑制 C3H8的生成,因为 C2H5是生成 C3H8的主要来源,而反应R4和R5竞争C2H5.

图6 NUIG模型正庚烷及裂解产物在1300K和1600K下的敏感性分析Fig.6 Sensitivity analysis of n-heptane and its pyrolysis products by NUIG model at 1300K and 1600K
其次,夺氢反应(R10,R11)对促进正庚烷的热解也起重要的作用,同时促进了 CH4和 C4H8-1的生成.CH4的生成主要来自 CH3引发的夺氢反应,故R11对 CH4生成的敏感度最大.与此同时,R9和R10也显著影响 CH4的摩尔分数,尽管 CH4并不参与这两个反应,这是因为C7H15-3经过β断裂生成了CH3,而 C7H15-2生成的 C2H5则需要消耗 CH3,故R10可促进 CH4的生成,R9抑制 CH4的生成.对C3H6的生成影响最大的两个反应是 R3和 R9,因为C7H15-2的β断裂是生成C3H6的主要路径.
当温度升高至 1600K时,促进正庚烷热解最重要的反应仍为 R8,并且促进作用增强.随着温度升高,大多数反应对产物的摩尔分数的升高都表现为抑制作用,只有少数反应(R7和R16)对CH4和C2H2摩尔分数的升高起促进作用.
2.2 异辛烷的裂解试验
2.2.1 裂解产物摩尔分数分布
试验测量了温度为 1200~2100K、压力为0.22~0.28MPa和3%的异辛烷在氩气稀释中的裂解产物.异辛烷的裂解产物摩尔分数随温度的变化如图7所示.C3H8、C3H6和 C4H8-1的摩尔分数均随着温度的增加先升高后降低,大约在 1450K左右开始降低.CH4和 C2H4的摩尔分数均随着温度的升高先增加后减小,CH4的摩尔分数升高速率较低,其摩尔分数在1800K时达到最大值;C2H4的摩尔分数升高较快,在 1700K达到最大值.C2H2在较低的温度生成量较少,裂解温度在大于 1600K时,C2H2的摩尔分数快速升高.在这几种产物中,C2H4和 C3H6是最丰富的产物,且在温度小于 1450K时,C3H6的摩尔分数高于 C2H4.因为 C2H4的主要来源为 C3H6的分解,在温度较高时,C3H6分解增多,故C3H6的摩尔分数开始减小,C2H4的摩尔分数上升速率加快.

图7 异辛烷裂解产物摩尔分数随温度的变化Fig.7 Mole fraction of iso-octane pyrolysis products varying with temperature
2.2.2 反应路径分析
由图7可知,除了 Wang模型对于 C3H8的预测值偏高较多,Wang和Atef模型对于异辛烷的裂解产物摩尔分数分布的预测与试验结果比较一致,选用Atef模型对异辛烷在1300K和1600K温度下进行反应路径分析如图8所示.在1300K时异辛烷的分解转化率为 42.6%,1600K时则对应较高的转化率为85.9%.
由图8可知,异辛烷的初始分解路径主要为3个不同位置的 C—C 键断裂,生成了 CH3、yC7H15、pC7H15、tC4H9和 iC4H9.在 1300K 条件下这 3个反应消耗异辛烷的总比例为 65.2%.其中生成 yC7H15的反应占据了近 50%异辛烷的消耗.这主要因为 A位碳原子的C—C键解离能最小(348.2kJ/mol),Ning等[35]通过 CCSD(T)方法计算得到异辛烷的键解离能,如图9所示,故反应iC8H18=CH3+yC7H15(R21)反应更容易发生.其次,由 H/CH3引发的夺氢反应也是异辛烷的主要分解途径,并生成 4种不同结构的C8H17自由基,占据 27.6%异辛烷的消耗,后续主要通过C—C键的β断裂生成更小的产物.随着温度的升高,异辛烷的分解路径发生了变化,在温度为1600K的条件下,反应 R21占据异辛烷消耗率为51.6%,略高于 1300K条件下的分支比,而由 H和CH3引发的夺氢反应的比例下降,这主要是由于更高的温度下异辛烷更趋向于通过直接断裂 C—C键的方式消耗.

图8 异辛烷裂解反应路径分析Fig.8 Analysis of reaction pathways of iso-octane pyrolysis

图9 异辛烷的C—C和C—H键解离能Fig.9 C—C and C—H bond dissociation energies of isooctane
由反应路径分析可知,异辛烷初始分解产生的yC7H15自由基主要通过 β断裂生成了 iC4H8和iC3H7,iC4H8主要是通过 H 和 CH3引发的夺氢反应来消耗的,对应的产物为 iC4H7、H2和 CH4,这也是CH4的主要来源之一.iC4H7后续发生 C—C键 β断裂反应,生成 C3H4-A和 CH3,C3H4-A后续可以通过异构化反应生成 C3H4-P以及夺氢反应生成 C3H3自由基,C3H4-P后续的分解导致了 C2H2的生成,这也是 C2H2的主要来源.iC3H7自由基主要脱去氢原子生成 C3H6,这也是 C3H6最重要的来源.而后 C3H6主要通过与H发生取代反应生成C2H4,C3H6还可通过 CH3夺取其 H原子生成 C3H5-A和 CH4,故 C3H6是 CH4和 C2H4的重要共同来源.此外,C2H4还可来自 CH3自由基结合生成的 C2H6,C2H6后续主要通过夺氢反应生成 C2H5自由基,C2H5自由基也可通过脱氢反应生成C2H4.
2.2.3 敏感性分析
图10给出了异辛烷以及裂解产物的敏感性分析.异辛烷的单分子分解反应(R21)生成 CH3和yC7H15对于异辛烷分解灵敏度最大.这主要是由于A位碳原子的 C—C键的解离能最小,这与 ROP分析的结果是一致的.由于 C2H4、C3H6和 CH4是异辛烷热解过程中较为重要的产物,故仅讨论这3种产物的敏感性.C3H6与 H原子发生取代反应(R15)对C2H4的生成影响最大,一方面是由于 C3H6在1300K时具有较高的摩尔分数;另一方面,ROP显示 60.6%的 C2H4来自反应 R14.对 CH4生成敏感性最大的反应是 R22,这也证实了由 CH3引发的夺氢反应才是 CH4的最主要来源.对于 C3H6的生成,iC4H9的C—H键断裂反应R18的敏感性最高,主要是因为反应R18生成的iC4H8是C3H6的主要来源.

图10 Atef模型异辛烷及裂解产物在1300K和1600K下的敏感性分析Fig.10 Sensitivity analysis of iso-octane and its pyrolysis products by Atef model at 1300K and 1600K
当温度升高至 1600K时,促进异辛烷热解最重要的反应为 R24,这主要是因为更高的温度可直接促使初级产物 yC7H15直接断裂 C—C键,生成活泼自由基nC3H7加入到后续的反应进程中,进而促进异辛烷的消耗.对 C2H4生成影响最大的反应仍为 R14,这与ROP分析结果是一致的.对CH4生成影响最大的反应为 R16,因为 CH4主要来自夺氢反应,故反应R16生成 CH3,CH3后续发生夺氢反应生成 CH4,敏感性最大.
2.3 正庚烷和异辛烷的对比
正庚烷和异辛烷同属于饱和烷烃,故二者在热解过程中存在许多相似之处.由 ROP分析可知,正庚烷和异辛烷的主要热解消耗路径为单分子解离反应和夺氢反应,C1~C4小分子产物的生成主要归因于自由基后续的 β断裂反应.此外,由试验结果可知,正庚烷和异辛烷在热解过程中的裂解产物主要是CH4、C2H4和C2H2等烃类.由图3和图7可知,在较高的温度下(大于1800K)C3以上的产物的摩尔分数都非常低,而 CH4和 C2H2则达到较高的摩尔分数值.这是因为C3和C4产物在高温下进一步被分解为CH4等小分子产物.除 C2H2外,其余小分子物种均存在随着温度增加摩尔分数先增加后减小的趋势,这是由于在热解过程中其余小分子物种均有进一步裂解生成更大不饱和度烃类的趋势.而 C2H2由于其非常稳定的碳碳三键结构,不容易继续分解消耗.
正庚烷为直链烷烃,异辛烷为支链烷烃,结构上的差异又导致了热解的不同之处.其中,异辛烷由于支链的存在对单分子解离反应有较大的影响.根据二者键解离能可知,伯碳 C—H键解离能是:异辛烷>正庚烷,仲碳C—H键解离能是:异辛烷>正庚烷;同时所有 C—C键解离能均是:异辛烷<正庚烷.另外,支链在一定程度上会阻碍自由基进攻反应的发生.由 ROP分析可知,单分子解离反应对异辛烷消耗的贡献高于正庚烷,这是由于异辛烷分子中有3个甲基支链,其空间位阻大,对自由基进攻反应阻碍作用较大.这与 ROP分析中有较大比例的正庚烷通过夺氢反应消耗相一致,而异辛烷的裂解则对应更大比例的单分子解离反应来进行.
此外,由异辛烷的反应路径分析可知,其初始分解产生的自由基均能生成 iC4H8,故异辛烷最主要的裂解产物为 iC4H8,而正庚烷热解中最主要的产物为C2H4.除了生成烯烃种类不同,生成 CH4和 C2H4的量相差较多,且 C2H4摩尔分数峰值温度不同.这主要是因为异辛烷存在支链结构,Zámostný等[36]发现在碳链中存在两个相邻的叔碳原子或季碳是最有利于提高 CH4产率的构型,而—CH2—基团较少不利于C2H4的生成,并且 C2H4的主要来源为C3H6,C3H6在1700K时的摩尔分数较低,表明大部分的C3H6被分解为 C2H4,而后随着温度的升高,C2H4缺少生成来源,故其摩尔分数开始降低.而在正庚烷的热解过程中,C2H4的直接来源于烷基的 β断裂,在 1600K下C2H4被大量消耗生成 C2H2,其摩尔分数开始下降,C2H2摩尔分数明显上升.因此,与正庚烷相比,异辛烷的裂解产物中 C2H4的摩尔分数较低,峰值温度较高,而CH4的摩尔分数较高.
3 结 论
(1) CH4、C2H2、C2H4和 C3H6是正庚烷和异辛烷热解过程中主要的产物;在正庚烷的裂解中,C2H4是热解产物中最主要的产物;而在异辛烷热解过程中,iC4H8是最主要的产物.
(2) 由反应路径分析和敏感性分析可知,烷烃的支链数量会直接影响反应路径,较多的支链会导致C—C键解离能的降低,使得异辛烷通过 C—C键直接断裂的单分子解离反应消耗的比例要大于正庚烷;其次,由 H和 CH3引发的夺氢反应占据了绝大部分正庚烷和异辛烷的消耗.
(3) 由正庚烷和异辛烷对比可知,异辛烷支链结构的存在对产物产量有较大的影响,其导致了更高产率的CH4和更低产率的C2H4.
