电针通过抑制瘦素/亲肽素轴改善多囊卵巢综合征模型大鼠排卵功能障碍及性激素水平
2022-09-25郭敏杨雁鸿卢宗林赵嘉梅温莹莹张艳艳刘杰
郭敏,杨雁鸿,卢宗林,赵嘉梅,温莹莹,张艳艳,刘杰
(1.洛阳市中医院妇科门诊,河南洛阳 471000;2.河南省中医药研究院,河南郑州 450000)
多囊卵巢综合征(polycystic ovary syndrome,PCOS)是青春期和育龄期女性常见的生殖内分泌代谢紊乱性疾病,临床以持续无排卵、排卵不足、胰岛素抵抗、雄激素分泌过多和卵巢多囊性改变为主要特征,同时还存在着远期并发症包括糖代谢异常和代谢综合征、心脑血管疾病、肿瘤风险及心理问题等的危险[1-2]。目前,PCOS的治疗主要以改变生活方式、药物诱导排卵为主[3];但研究发现,药物治疗过程可能产生卵巢过度刺激综合征风险,且停药后复发率较高[4]。作为传统的中医疗法,针灸在治疗妇科疾病方面有着悠久的历史。电针作为一种低风险的干预措施,已被证明有明显纠正PCOS内分泌紊乱、促进排卵的作用[5-7],但其具体治疗机制仍不清楚。促性腺激素释放激素(GnRH)是生殖轴的主要控制器,调节促性腺激素的合成和分泌,亲肽素(kisspeptin,KP)是已知诱导GnRH释放的最有效因子,而KP神经元则是介导瘦素(leptin,LEP)作用于下丘脑-垂体-性腺(HPG)轴的直接靶点。研究表明,LEP/KP轴在生殖功能尤其是卵巢发育及激素分泌等方面具有重要的调节意义[8-9]。故本研究通过构建PCOS大鼠模型,给予电针治疗,并以治疗PCOS的标准药物二甲双胍[10]作为阳性对照,观察电针对PCOS大鼠LEP/KP轴的影响,以期阐明电针对PCOS的干预机制及为电针临床治疗PCOS方案提供一定的参考依据,现将研究结果报道如下。
1 材料与方法
1.1 实验动物SPF级5周龄雌性Wistar大鼠70只,体质量为(200±20)g,购自长沙市天勤生物技术有限公司,动物生产许可证号:SCXK(湘)2019-0013。饲养环境:室温(22±2)℃,相对湿度50%~70%,12 h/12 h光暗交替,普通饲料喂养。研究过程遵循实验动物人道主义及3R原则。
1.2 主要药物、试剂与仪器二甲双胍(纯度≥98%,宝鸡市国康生物科技有限公司,批号:657-24-9)。脱氢表雄酮(dehydroepiandrosterone,DHEA,纯度≥98%,美国Med Chem Express公司,批号:HY-14650);LEP酶联免疫吸附分析(ELISA)试剂盒(上海臻科生物科技有限公司);雌二醇(E2)、睾酮(T)ELISA试剂盒(上海恒远生化试剂有限公司);促黄体生成素(LH)、促卵泡激素(FSH)ELISA试剂盒(上海通蔚生物有限公司);兔抗瘦素受体(LEPR)多克隆抗体(艾美捷科技有限公司);兔抗KP、兔抗G蛋白偶联受体54(GPR54)、兔抗促性腺激素释放激素(GnRH)等多克隆抗体(美国Abcam公司);辣根过氧化物酶标记的羊抗兔IgG抗体(北京百奥莱博科技有限公司)。低频脉冲电针治疗仪(上海聚慕医疗器械有限公司);多功能酶标仪(南京德铁实验设备有限公司);化学发光凝胶成像系统(北京佰乐良成科技有限公司)。
1.3 造模与分组大鼠适应性饲养1周后,称体质量,随机选取15只作为正常组,剩余55只用于构建PCOS模型。造模方法[11]:连续21 d于大鼠颈背部皮下注射DHEA,剂量为60 mg/kg,每日1次。正常组仅注射0.2 mL磷酸盐缓冲液(PBS)。造模期间通过阴道涂片亚甲蓝染色观察大鼠连续10 d的发情周期,阴道壁细胞以有核上皮细胞为主表明处于发情前期,以角化鳞状上皮细胞为主表明处于发情期,若发情周期紊乱则判断为PCOS大鼠造模成功[12-13]。结果48只大鼠造模成功。随机剔除3只,将剩余45只大鼠随机分为模型组、电针组及西药组,每组各15只,称体质量。
1.4 电针刺激及给药成模24 h后,给予电针及药物治疗。电针组给予电针干预:木板上固定大鼠,剃除穴位处被毛,不锈钢针(直径0.30 mm,长13 mm)插入双侧足三里(ST36,胫骨前结节点外侧4 mm处)6~7 mm深度,三阴交(SP6,内侧踝近端3 mm,位于胫骨后缘)4~5 mm深度,连接脉冲电针仪,频率设为2 Hz,电流强度为2 mA,持续30 min。正常组、模型组及西药组大鼠均给予非穴位点(ST36下侧5 mm、SP6下侧5 mm)电针干预。另西药组大鼠给予二甲双胍灌胃,剂量为300 mg/kg[14],正常组、模型组、电针组大鼠灌胃等体积生理盐水。每日1次,连续15 d。
1.5 观察指标与方法
1.5.1 样本采集及处理 治疗结束后,处于发情期各组大鼠禁食8 h,称体质量,腹腔内注射70 mg/kg氯胺酮及10 mg/kg甲苯噻嗪麻醉,心脏穿刺采集血液,以3 000 g、4℃离心10 min,收集血清保存于-80℃冷冻备用;采血后,颈椎脱臼处死大鼠,解剖并收集脑组织,分离出下丘脑弓状核保存于液氮内备用;腹侧正中线作切口,取出卵巢并去除多余脂肪组织,称质量并测量直径,后将卵巢组织保存于4%多聚甲醛固定液中过夜备用。
1.5.2 HE染色法观察大鼠卵巢组织病理形态 卵巢组织于体积分数4%多聚甲醛固定24 h后,常规石蜡包埋并制备为5μm厚度切片。二甲苯脱蜡至水,滴加适量苏木素染核5 min,1%盐酸酒精分化10 s,0.6%氨水返蓝,流水冲洗后滴加适量伊红染液染色30 s,梯度乙醇脱水,二甲苯透明,晾干后中性树胶封片。于400倍显微镜镜下观察卵巢组织病理形态,并测量囊性卵泡(CF)、发育中卵泡(DF)及黄体(CL)数量。
1.5.3 ELISA法检测大鼠血清内相关激素水平 设置标准品孔和样本孔,根据说明书加入标准品和样品(样品5倍稀释)和辣根过氧化物酶(HRP)标记的检测抗体37℃温育1 h。甩干液体,洗板机洗板4~5次,加底物A、B各50μL,37℃避光孵育15 min,终止液终止反应。应用酶标仪于450 nm波长处测定各孔光密度(OD)值,以标准品浓度作横坐标,对应OD值作纵坐标,绘制出标准品线性回归曲线,按曲线方程计算各组大鼠血清中LEP、E2、T、LH及FSH水平。
1.5.4 蛋白免疫印迹(Western Blot)法检测大鼠下丘脑弓状核组织LEPR、KP、GPR54、GnRH蛋白表达水平 取液氮中下丘脑弓状核组织,研钵内碾碎并转移至放射免疫沉淀分析(RIPA)裂解液中,匀浆后以12 000g离心10 min取上清。统一蛋白浓度并变性蛋白,5%压缩胶及12%浓度分离胶进行电泳(压缩胶60 V,25 min;分离胶120 V,60 min),转膜(200 mA,2 h),后将PVDF膜于5%脱脂乳中封闭2 h,一抗(均1∶500稀释)4℃孵育过夜。次日洗膜,换液3~6次后,二抗(1∶8 000稀释)孵育2 h;再洗膜并换液3~6次,电化学发光试剂(ECL)显影,应用化学发光凝胶成像系统曝光并拍照记录。采用ImageJ软件分析条带灰度值,以蛋白LEPR、KP、GPR54、GnRH与内参GAPDH灰度值比值表示目的蛋白的相对表达量。
1.6 统计方法采用SPSS 22.0统计软件进行数据分析,计量资料以均数±标准差(±s)表示,多组间比较采用单因素方差分析,两组间比较采用LSD-t检验。P<0.05为差异有统计学意义。
2 结果
2.1 各组大鼠体质量变化情况比较表1结果显示,正常组大鼠造模前、造模后及治疗后体质量比较,差异均无统计学意义(P>0.05)。与造模前比较,成模后模型组、电针组及西药组大鼠体质量均显著增加(P<0.05),提示内分泌代谢紊乱导致肥胖发生。与成模后比较,模型组大鼠经非穴位点电针刺激后体质量无显著性变化(P>0.05),电针组及西药组大鼠治疗后体质量均显著性降低(P<0.05)。
表1 各组大鼠体质量比较Table 1 Comparison of body mass among various groups of rats (±s)

表1 各组大鼠体质量比较Table 1 Comparison of body mass among various groups of rats (±s)
①P<0.05,与造模前比较;②P<0.05,与成模后比较
组别正常组模型组电针组西药组鼠数/只15 15 15 15体质量/g造模前214.25±18.25 187.45±19.98 194.32±25.16 208.15±28.14成模后216.32±22.30 253.25±25.74①258.56±27.79①269.45±30.35①治疗后211.14±23.72 249.12±27.56①217.64±24.25①②219.64±24.12①②F值1.383 33.561 23.873 20.822 P值0.262<0.001<0.001<0.001
2.2 各组大鼠卵巢质量及直径比较表2结果显示,4组间大鼠卵巢质量和直径比较,差异均有统计学意义(P<0.05)。进一步两两比较结果显示:与正常组比较,模型组大鼠卵巢质量及直径均显著增大(P<0.05);与模型组比较,电针组及西药组大鼠卵巢质量及直径均显著减小(P<0.05);与电针组比较,西药组大鼠卵巢质量及直径显著减小(P<0.05)。
表2 各组大鼠卵巢质量及直径比较Table 2 Comparison of mass and diameter of ovaries among various groups of rats (±s)
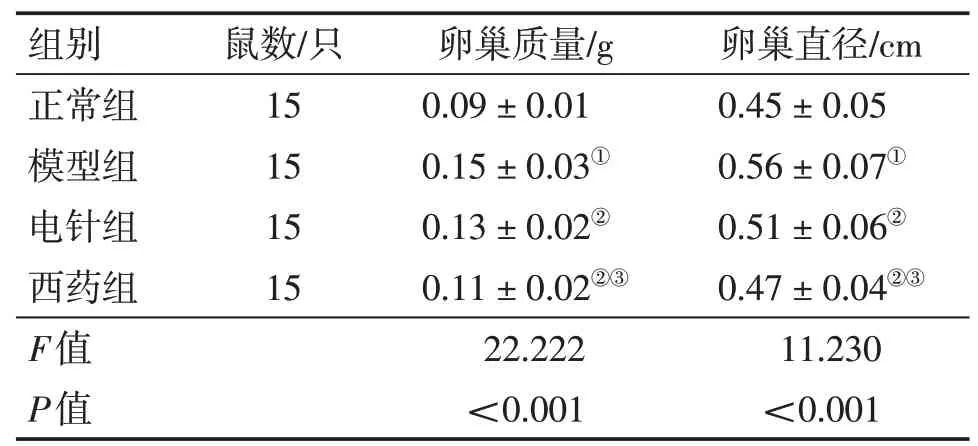
表2 各组大鼠卵巢质量及直径比较Table 2 Comparison of mass and diameter of ovaries among various groups of rats (±s)
①P<0.05,与正常组比较;②P<0.05,与模型组比较;③P<0.05,与电针组比较
组别正常组模型组电针组西药组F值P值鼠数/只15 15 15 15卵巢质量/g 0.09±0.01 0.15±0.03①0.13±0.02②0.11±0.02②③22.222<0.001卵巢直径/cm 0.45±0.05 0.56±0.07①0.51±0.06②0.47±0.04②③11.230<0.001
2.3 各组大鼠卵巢组织病理形态比较图1、表3结果显示,正常组大鼠具有完整的卵巢组织结构,CL体积大且数目多,DF存在明显较厚颗粒层;模型组大鼠卵巢组织结构不规则,见有多量薄层颗粒细胞的CF,提示卵巢多囊性病变;电针组及西药组大鼠卵巢组织结构趋于正常,与模型组相比较,CF数目减少,CL和DF数目增多,卵泡颗粒层增厚,提示卵巢组织病理学异常及POCS得到改善。经测定各组大鼠CF、DF、CL数目,4组间大鼠卵巢组织CF、DF、CL数目比较,差异均有统计学意义(P<0.05);进一步两两比较结果显示:与正常组比较,模型组大鼠CF数目显著增多,DF、CL数目显著减少(均P<0.05);与模型组比较,电针组及西药组CF数目显著减少,DF、CL数目显著增多(均P<0.05);与电针组比较,西药组CF数目显著减少,DF、CL数目显著增多(均P<0.05)。

图1 各组大鼠卵巢组织HE染色结果(×400)Figure 1 HE staiting results of ovarian tissues in variousgroups of rats(×400)
表3 各组大鼠囊性卵泡(CF)、发育中卵泡(DF)、黄体(CL)数目比较Table 3 Comparison of the number of cystic follicles(CF),developing follicles(DF)and corpus luteum(CL)among various groups of rats (±s)

表3 各组大鼠囊性卵泡(CF)、发育中卵泡(DF)、黄体(CL)数目比较Table 3 Comparison of the number of cystic follicles(CF),developing follicles(DF)and corpus luteum(CL)among various groups of rats (±s)
①P<0.05,与正常组比较;②P<0.05,与模型组比较;③P<0.05,与电针组比较
组别正常组模型组电针组西药组F值P值鼠数/只15 15 15 15 CF/个0.00±0.00 4.26±0.47①3.14±0.36②1.98±0.24②③486.719<0.001 DF/个3.82±0.40 0.64±0.26①3.22±0.35②3.48±0.34②③272.467<0.001 CL/个4.34±0.75 0.00±0.00①3.12±0.37②3.50±0.42②③246.394<0.001
2.4 各组大鼠血清LEP、E2、T、LH及FSH水平比较表4结果显示,4组间大鼠血清LEP、E2、T、LH及FSH水平比较,差异均有统计学意义(P<0.05);进一步两两比较结果显示:与正常组比较,模型组LEP、E2、T及LH水平显著升高,FSH水平显著降低(均P<0.05);与模型组比较,电针组及西药组LEP、E2、T及LH水平显著降低,FSH水平显著升高(均P<0.05);与电针组比较,西药组LEP、E2、T及LH水平显著降低,FSH水平显著升高(均P<0.05)。
表4 各组大鼠血清瘦素(LEP)、雌二醇(E2)、睾酮(T)、促黄体生成素(LH)、促卵泡激素(FSH)水平比较Table 4 Comparison of serum leptin(LEP),estradiol(E2),testosterone(T),luteinizing hormone(LH),and follicle stimulating hormone(FSH)levels among various groups of rats (±s)

表4 各组大鼠血清瘦素(LEP)、雌二醇(E2)、睾酮(T)、促黄体生成素(LH)、促卵泡激素(FSH)水平比较Table 4 Comparison of serum leptin(LEP),estradiol(E2),testosterone(T),luteinizing hormone(LH),and follicle stimulating hormone(FSH)levels among various groups of rats (±s)
①P<0.05,与正常组比较;②P<0.05,与模型组比较;③P<0.05,与电针组比较
组别正常组模型组电针组西药组F值P值鼠数/只15 15 15 15 LEP/(ng·mL-1)24.25±3.85 45.21±5.07①34.68±3.76②29.84±3.04②③74.319<0.001 E2/(pg·mL-1)18.15±2.93 35.32±4.47①27.24±3.63②24.35±3.01②③60.022<0.001 T/(ng·mL-1)38.48±6.87 85.22±10.39①68.44±7.68②54.26±6.16②③94.662<0.001 LH/(mU·mL-1)17.26±3.19 28.25±4.15①23.18±3.35②19.36±2.17②③32.260<0.001 FSH/(mU·mL-1)16.12±1.89 9.35±1.05①12.42±1.44②14.16±1.62②③52.789<0.001
2.5 各组大鼠下丘脑弓状核LEPR、KP、GPR54、GnRH蛋白表达比较图2、表5结果显示,4组间大鼠下丘脑弓状核组织内LEPR、KP、GPR54及GnRH蛋白表达水平比较,差异均有统计学意义(P<0.05);进一步两两比较结果显示:与正常组比较,模型组大鼠下丘脑弓状核组织内LEPR、KP、GPR54及GnRH蛋白表达水平均显著升高(P<0.05);与模型组比较,电针组及西药组大鼠LEPR、KP、GPR54及GnRH蛋白表达水平均显著降低(P<0.05);与电针组比较,西药组大鼠LEPR、KP、GPR54及GnRH蛋白表达水平均显著降低(P<0.05)。表明电针可调节LEP/KP轴的活化状态。
表5 各组大鼠下丘脑弓状核组织内瘦素受体(LEPR)、亲肽素(KP)、蛋白偶联受体54(GPR54)、促性腺激素释放激素(GnRH)蛋白表达水平比较Table 5 Comparison of protein expression levels of(LEPR),kisspeptin(KP),protein-coupled receptor 54(GPR54)and gonadotropin-releasing hormone(GnRH)in hypothalamic arcuate nucleus tissue among various groups of rats(±s)
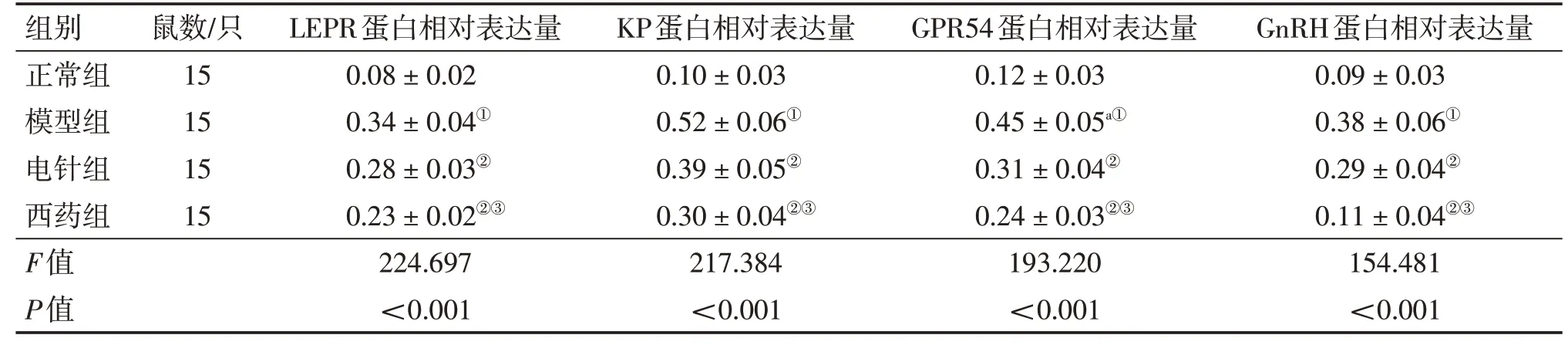
表5 各组大鼠下丘脑弓状核组织内瘦素受体(LEPR)、亲肽素(KP)、蛋白偶联受体54(GPR54)、促性腺激素释放激素(GnRH)蛋白表达水平比较Table 5 Comparison of protein expression levels of(LEPR),kisspeptin(KP),protein-coupled receptor 54(GPR54)and gonadotropin-releasing hormone(GnRH)in hypothalamic arcuate nucleus tissue among various groups of rats(±s)
①P<0.05,与正常组比较;②P<0.05,与模型组比较;③P<0.05,与电针组比较
组别正常组模型组电针组西药组F值P值鼠数/只15 15 15 15 LEPR蛋白相对表达量0.08±0.02 0.34±0.04①0.28±0.03②0.23±0.02②③224.697<0.001 KP蛋白相对表达量0.10±0.03 0.52±0.06①0.39±0.05②0.30±0.04②③217.384<0.001 GPR54蛋白相对表达量0.12±0.03 0.45±0.05a①0.31±0.04②0.24±0.03②③193.220<0.001 GnRH蛋白相对表达量0.09±0.03 0.38±0.06①0.29±0.04②0.11±0.04②③154.481<0.001
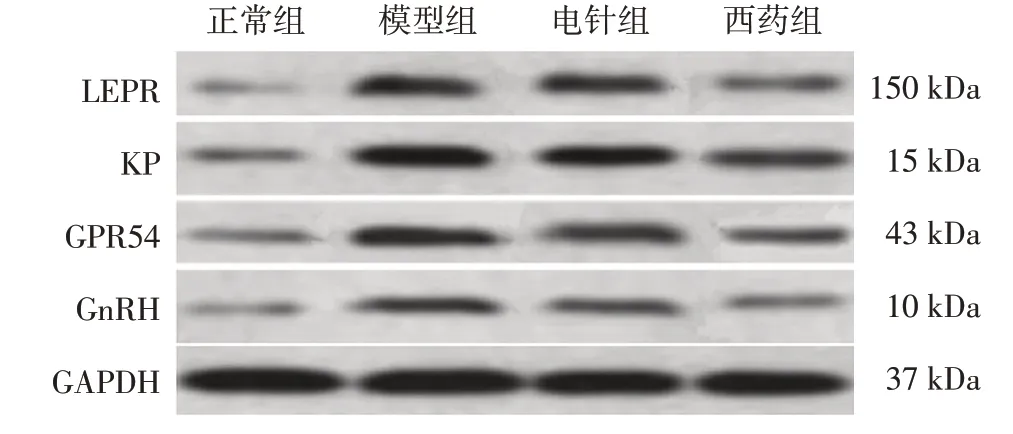
图2 各组大鼠下丘脑弓状核瘦素受体(LEPR)、亲肽素(KP)、蛋白偶联受体54(GPR54)、促性腺激素释放激素(GnRH)蛋白的Western Blot电泳条带图Figure 2 Western Blot electrophoresis bands of leptin receptor(LEPR),kisspeptin(KP),protein-coupled receptor 54(GPR54),and gonadotropin-releasing hormone(GnRH)proteins in hypothalamic arcuate nucleus among various groups of rats
3 讨论
多囊卵巢综合征(PCOS)是一种与性激素、生化因素和卵巢组织变化等有关的复杂内分泌代谢紊乱病,其中下丘脑-垂体-性腺轴激素分泌紊乱,雄性激素(如T)及LH水平升高是PCOS卵巢多囊、寡排卵/无排卵的一个明确病因[13]。PCOS患者中肥胖者居多[15]。本研究中,经DHEA诱导后,大鼠体质量显著增加,提示肥胖发生;DHEA诱导大鼠卵巢质量及直径显著增大,且卵巢组织中CF数目显著增多,CL和DF数目显著降低,提示卵巢排卵功能障碍[16];PCOS的重要诊断标准之一是性激素水平的改变,本研究中DHEA诱导大鼠血清E2、T及LH水平显著升高,FSH水平显著降低。综合看来,DHEA可成功诱导构建PCOS大鼠模型。
在过去的20年中,二甲双胍已被广泛用于治疗PCOS患者,尤其是代谢和生殖异常的患者,可增加排卵并降低血清睾酮水平,提高胰岛素敏感性、缓解代谢紊乱和改善多囊症状[17]。故选择二甲双胍作为阳性对照药物。《金匮要略·妇人杂病脉证并治》篇曰:“妇人之病,因虚、积冷、结气,为诸经水断绝。”肾虚、血瘀、肝郁是PCOS的主要病机,故针刺选穴治疗以调理与现代医学中下丘脑-垂体-性腺轴呈对应关系的“肾-天癸-冲任-胞宫轴”[18]为主,常选用三阴交、足三里、子宫、关元及中极穴作为治疗PCOS的主穴。研究发现,三阴交、足三里穴与内分泌紊乱或生殖综合征相关[19-20]。电针三阴交穴能够在一定程度上提高机体内环境稳态,缓解雌激素分泌不足导致的机体下丘脑-垂体-卵巢轴紊乱,可有效促进卵泡的分裂、成熟和排出[21];针刺足三里则可使冲脉气血充盛,化生肾间动力,上下循行周身,是促成排卵的重要因素[22]。故本研究选择双侧三阴交和足三里穴进行电针治疗,并以二甲双胍作为阳性对照药物,结果显示:与模型组比较,电针组大鼠体质量、卵巢质量及其直径降低,CF数目减少,CL和DF数目升高,血清E2、T及LH水平下降,FSH水平上升;电针治疗效果虽然低于二甲双胍,但与其作用效果表现出一致性。提示电针可有效减轻PCOS大鼠的伴随性肥胖,调节性激素水平,促进卵巢排卵功能障碍的恢复。
放大PCOS临床严重程度的因素是肥胖[23]。PCOS患者同时伴有高胰岛素血症,而胰岛素可增强LEP分泌[24]。研究发现,高瘦素血症通过阻止卵泡发育直接影响卵巢生理[25]。KP是一组对下丘脑-垂体-性腺轴起调节作用的多肽激素,KP神经元是LEP影响促性腺激素分泌途径的关键组成部分。KP受体GPR54的表达是功能性促性腺激素轴激活的关键条件,两者结合后通过刺激GnRH神经元分泌性激素进而调控排卵[26]。本研究结果显示,PCOS大鼠血清LEP水平显著升高,提示PCOS大鼠合并高瘦素血症;另PCOS大鼠下丘脑弓状核中LEPR、KP、GPR54及GnRH蛋白表达水平显著升高,提示PCOS大鼠LEP/KP轴处于激活状态;经电针治疗后,大鼠血清LEP水平及LEPR、KP、GPR54、GnRH蛋白表达水平均显著降低,提示电针刺激可能通过抑制LEP/KP轴的激活进而调控PCOS大鼠的排卵。
综上所述,电针可改善PCOS大鼠排卵功能障碍,调节性激素水平,其机制可能与其抑制LEP/KP轴、平衡机体内分泌紊乱有关。
