肾移植术后抗体介导排斥反应中不同亚型的巨噬细胞浸润分析
2022-09-23邓格豆猛宫惠琳郑秉暄石玉婷卫田丁晨光郑瑾丁小明薛武军田普训西安交通大学第一附属医院肾脏病医院肾移植科陕西西安7006西安交通大学第一附属医院病理科陕西西安7006
邓格,豆猛,宫惠琳,郑秉暄,石玉婷,卫田,丁晨光,郑瑾,丁小明,薛武军,田普训(.西安交通大学第一附属医院肾脏病医院肾移植科,陕西 西安 7006;.西安交通大学第一附属医院病理科,陕西 西安 7006)
肾移植已成为终末期肾脏病最成功的治疗手段,然而抗体介导排斥反应(antibody-mediated rejection,ABMR)仍是制约移植肾长期存活的重要因素。作为固有免疫系统的重要组成成分,近年来巨噬细胞在越来越多疾病中显示出独特作用[1-2]。在移植免疫中,巨噬细胞可以引发适应性免疫反应,维持T 细胞介导的细胞性排斥反应和B 细胞介导的ABMR。虽然由T 细胞、B 细胞组成的适应性免疫在同种异体移植排斥反应和耐受中的作用已得到广泛认可,但先天免疫的重要性却未得到充分认识。而巨噬细胞是一种具有明显异质性的细胞群体,在不同环境中可以转换为不同亚型、发挥不同作用[3-4]。本研究旨在阐明ABMR 发生时巨噬细胞及不同亚型在移植肾组织内的表达及浸润部位,分析巨噬细胞浸润与肾功能的相关性,有望揭示巨噬细胞参与ABMR 移植肾损伤的可能机制。
1 资料与方法
1.1GEO 数据集及数据处理:选取GEO 数据库中由加拿大埃特蒙顿肾脏病学和移植免疫学系上传的肾移植受者的微阵列表达数据集GSE36059,使用R 语言“limma”包对数据进行log2 转换并归一化。通过CIBERSORT 生物信息学算法评估样本中的免疫细胞浸润及比例。R 语言“ggplot2”包用于对数据进行可视化。
1.2进行病理染色的本院肾移植受者的纳入标准:① 于本院进行首次同种异体肾移植的患者。② 术后规律随访。③ 肾脏穿刺病理组织活检证实为抗体介导的排斥反应。
1.3进行病理染色的本院肾移植受者的排除标准:① 二次及以上同种异体肾移植患者;② 亲属活体肾移植受者;③ 未进行肾脏穿刺病理组织活检。
1.4进行病理染色的患者分组及一般资料:选取2021 年1 月— 2021 年12 月于本院进行同种异体肾移植并行肾脏穿刺病理组织活检的患者作为Stable 组和ABMR 组,选取行肾脏穿刺病理显示肾小球、肾小管及间质等结构正常,但lifeport 灌注参数阻力较高的DCD 供者弃肾作为Control 组。共选取15 例患者,分为3 组,每组5 例。Control 组包括3 例男性、2 例女性,平均年龄为(38.20 ±10.45)岁,收集标本时尿蛋白均为阴性,肌酐为(54.40±8.73) μmol/L。Stable 组包括1 例男性、4 例女性,平均年龄为(36.40 ± 9.34)岁,5 例患者原发肾病均为肾小球肾炎,收集标本时肾移植术后时长为(2.31±1.77)个月,5 例患者尿蛋白均为阴性,肌酐为(124.00±44.97) μmol/L,群体反应性抗体(panel reactive antibody,PRA)均为阴性。ABMR 组包括4 例男性、1 例女性,平均年龄为(43.20±11.50)岁,4 例患者原发性肾病为肾小球肾炎、1 例为IgA 肾病,收集标本时肾移植术后时长为(4.25±3.65)个月,5 例患者尿蛋白均为阳性,肌酐为(457.60±152.27) μmol/L, PRA均为阳性 (基线资料见表1)。3 组患者在性别、年龄方面差异无显著性(P >0.05)。本研究中公民逝世后器官捐献来源的肾移植供者、受者均按照中国人体器官分配与共享计算机系统(COTRS)程序分配且经过本院《人体器官移植技术临床应用与伦理会》批准。
表1 基线资料表(±s)

表1 基线资料表(±s)
项目 Control 组(n =5) Stable 组(n =5) ABMR 组(n =5) P 值性别(例) 0.153男3 1 4女2 4 1年龄(岁,images/BZ_41_1599_1402_1619_1446.png±s) 38.20 ± 10.45 36.40 ± 9.34 43.20 ± 11.50 0.582 HLA 错配数(个) 0.435 0 2 1 1 2 2 1 1 3 3 及以上 0 0原发肾病(例) 0.292慢性肾炎 5 4 IgA 肾病 0 1术后时间(月,images/BZ_41_1599_1402_1619_1446.png±s) 2.31 ± 1.77 4.25 ± 3.65 0.317尿蛋白(例) <0.05阴性 5 5 0阳性 0 0 5肌酐(μmol/L,images/BZ_41_1599_1402_1619_1446.png±s) 54.40 ± 8.73 124.00 ± 44.97 457.60 ± 152.27 <0.05 PRA(例) 0.008阳性 0 5阴性 5 0
1.5 肾移植受者免疫诱导及免疫抑制方案:根据器官移植免疫抑制剂临床应用技术规范(2019 版)[4],肾移植受者术前及术中免疫诱导方案为兔抗人胸腺细胞免疫球蛋白50 ~75 mg/d,自手术当天开始连用3 d)或兔抗人T 淋巴细胞免疫球蛋白(200 mg/d,自手术当天开始连用3 d);术后免疫抑制维持方案为钙调神经磷酸酶抑制剂CNI 类(他克莫司或环孢素A)+吗替麦考酚酯或麦考酚钠+甲泼尼龙为基础的三联免疫抑制方案,根据血药浓度监测结果适当调整免疫抑制剂用量。
1.6 标本收集:Control 组标本来源于DCD 供者的肾脏穿刺组织。Stable 组和ABMR 组标本来源于肾移植受者超声引导下的穿刺活检组织。
1.7 免疫组织化学染色:肾脏穿刺组织经4%多聚甲醛溶液固定至少24 h 后,进行石蜡包埋,并切成4 μm 厚度的连续石蜡切片。切片65℃烘烤2 h,经二甲苯脱蜡、梯度酒精水化、抗原修复、内源性H2O2酶阻断后,选择相应一抗稀释后滴加至切片上37℃孵育2 h (表2),再滴加对应酶标二抗IgG 聚合物37℃孵育30 min 后,进行DAB 显色5 ~7 min,自来水冲洗终止显色。显色完毕,经苏木素溶液进行复染、分化返蓝,梯度酒精脱水、二甲苯透明、中心树脂胶封片。

表2 免疫组化染色所用一抗
1.8 结果观察:染色后的切片在光学显微镜的不同放大倍数下进行观察,10×20 放大倍数下随机选取不同视野进行拍照,同一患者的标本根据连续切片选取同一视野。每例患者的切片在光学显微镜下随机选取10 个肾小球视野进行拍照,手动计数每个肾小球内CD68+及CD86+巨噬细胞的数量,取平均值后进行统计学分析。
1.9 统计学方法:采用GraphPad Prism9.0 软件对数据进行统计学分析。分类资料的组间比较采用卡方检验或Fisher 确切概率法。正态分布资料以均值±标准差(±s)表示,组间比较采用t 检验,
两组以上的均值比较采用单因素方差分析。相关性分析采用Pearson 法。P <0.05 表示差异具有统计学意义。
2 结 果
2.1GSE36059 数据集中的巨噬细胞浸润情况:通过CIBERSORT 算法对GSE36059 中的免疫细胞浸润进行分析(图1),结果表明,与Stable 组相比,ABMR 组中的M0 巨噬细胞及M1、M2 型巨噬细胞比例显著增加,其中M1 型巨噬细胞比例的增加具有统计学意义(图2)。

图1 GSE36059 数据集中所有样本内不同免疫细胞比例的条形图
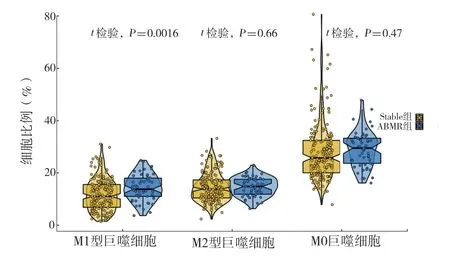
图2 GSE36059 数据集中Stable 组和ABMR 组之间M0巨噬细胞及M1、M2 型巨噬细胞比例的小提琴图
2.2不同组间浸润巨噬细胞的数量及部位:相比Control 组和Stable 组,ABMR 组的移植肾组织内浸润的总巨噬细胞(CD68+)数量明显增多 (图3A d ~f,3B),且浸润的巨噬细胞主要分布在微血管周围(肾小球内和间质毛细血管,CD31+,图3A a ~c)。
2.3浸润总巨噬细胞的亚型:对肾组织内的总巨噬细胞进一步分型染色,结果显示,浸润在微血管周围的总巨噬细胞以促炎性的M1 型巨噬细胞(CD68+CD86+)为主(图3A g ~i,3C),组织修复、抑炎相关的M2 型巨噬细胞(CD68+CD206+)无显著浸润(图3A j ~l)。
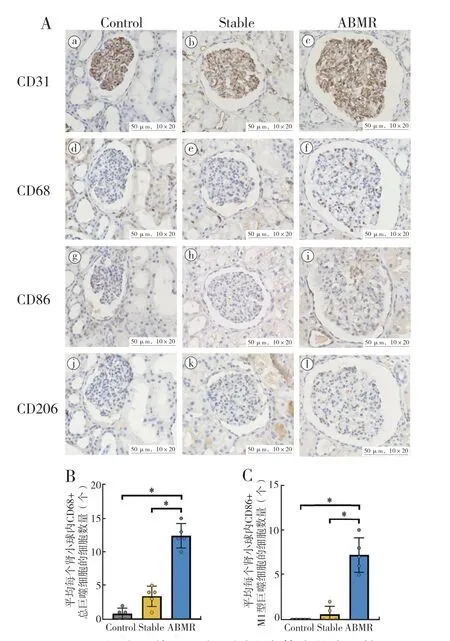
图3 巨噬细胞及其亚型在不同患者体内的表达情况
2.4巨噬细胞的浸润程度与移植肾功能的相关性:采用Pearson 相关性分析检验肾移植受者血清肌酐与平均每个肾小球内总巨噬细胞、M1 型巨噬细胞的细胞数量的相关性。结果显示:血清肌酐与平均每个肾小球内总巨噬细胞(图4A)、M1 型巨噬细胞(图4B)的细胞数量之间具有相关性,且相关系数分别为0.795、0.823,P 值均小于0.05,表明平均每个肾小球内巨噬细胞(总巨噬细胞以及M1型巨噬细胞)的细胞数量与移植肾功能密切相关。
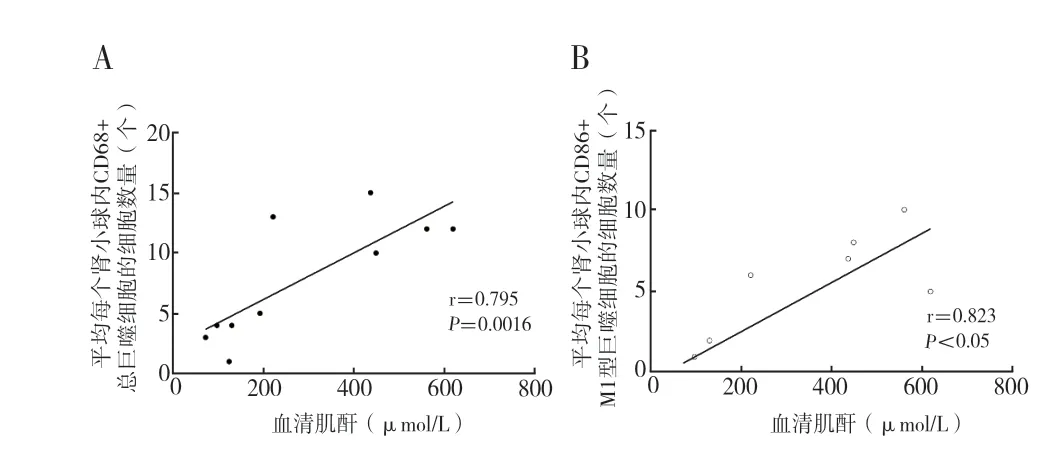
图4 肌酐与肾小球内总/M1 型巨噬细胞数量的Pearson 相关性分析
3 讨 论
随着外科技术手段的进步及现有免疫抑制剂的广泛使用,肾移植术后急性排斥反应的发生率显著下降,移植肾1 年存活率可以达到90%以上[6-8]。但目前肾移植术后早期发生的急性排斥反应中超50%为ABMR,且超60%的晚期肾移植失败原因也为ABMR[9]。ABMR 尚缺乏有效治疗手段。巨噬细胞是先天免疫系统的关键效应细胞。传统免疫学中,巨噬细胞主要被视为清道夫细胞,其主要功能是清除病原体、死亡细胞和外来分子,近年来越来越多的研究表明巨噬细胞在组织炎症和修复中起着重要作用[10]。
本研究显示发生ABMR 时,巨噬细胞在移植肾组织内具有显著浸润,浸润巨噬细胞的数量与肾脏功能具有显著相关性。李宪昌教授团队2020 年发表在Science 上的一项重大研究发现,在小鼠同种异体肾移植和心脏移植中,巨噬细胞具有和适应性免疫系统相似的免疫记忆,在缺乏T 细胞、B 细胞的免疫环境中可显示出对排斥的独特贡献[11]。2018 年Jordi Ochando 教授的研究团队在Immunity发表的重要论著则表明,第一时间浸润同种异体移植物的巨噬细胞可以通过移植物中的损伤相关分子模式进行“训练”,而这种“训练过的”巨噬细胞直接参与了移植物排斥反应[12]。以上研究均证明巨噬细胞作为先天性免疫系统的一部分,在移植排斥反应中发挥着我们过去尚未完全认识到的重要作用。
巨噬细胞是一群具有显著可塑性的细胞,可以从一种表型转换为另一种[3-4]。1980 — 2000 年间,科学家们发现巨噬细胞可以由Th1 型细胞因子γ-干扰素(interferon-γ,IFN-γ)或Th2 型细胞因子白介素-4(interleukin 4,IL-4)和IL-13诱导为经典活化的M1 型巨噬细胞(classically activated macrophages)[13]或替代活化M2 型巨噬细胞(alternatively activated macrophages)[14]。M1 亚型的极化可以促进多种炎症因子产生,如IL-1β、IL-6、肿 瘤 坏 死 因 子-α(tumor necrosis factor,TNF-α)、环氧合酶2(cyclooxygenase 2,COX2),以及诱导型一氧化氮合酶(inducible nitric oxide synthase,iNOS)和MHC-Ⅱ的高表达[15-16],诱发或加重组织的炎症反应。M2 亚型的巨噬细胞可以通过吞噬凋亡细胞,阻止凋亡细胞内炎性介质的释放,产生抗炎介质,如IL-10、转化生长因子β(transforming growth factor-β,TGF-β)[17-18],TGF-β 可以促进血管生成和成纤维细胞激活[19],IL-10 则可以抑制效应性T 细胞、促进Foxp3+调节性T 细胞(regulatory T cells,Treg)的产生[20];IL-4、IL-13 可以使M2 型巨噬细胞产生高水平的精氨酸酶1(arginase-1,Arg-1)催化鸟氨酸等底物以促进纤维化和伤口愈合[21]。巨噬细胞的可塑特性使得研究者们需要进一步了解浸润在移植物中巨噬细胞的具体表型,从而更好地阐明巨噬细胞在ABMR 的发生发展中的作用机制。
本研究中,利用CIBERSORT 对GSE36059 数据集中浸润的巨噬细胞分型进行分析,结果显示M1 型巨噬细胞在ABMR 发生时显著增多,而M2型巨噬细胞浸润的差异则不明显,对本中心肾移植受者的肾脏活检组织的IHC 染色也进一步证明了该结果,且相关性分析显示M1 型巨噬细胞的数量与移植肾功能同样具有显著相关性。其他研究表明在小鼠心脏移植模型中,M1 样单核细胞可以从骨髓浸润至心脏移植物中,参与排斥反应的发生[22]。
上述结果确定了巨噬细胞尤其是M1 型巨噬细胞在ABMR 中具有重要作用,但移植物中巨噬细胞的来源以及它介导移植物损伤的具体机制目前研究尚不清楚。我们的IHC 染色发现巨噬细胞主要浸润在微血管周围(肾小球内和间质毛细血管周围),而ABMR 发生的关键特征是内皮细胞的损伤和激活[23],因此,巨噬细胞和内皮细胞的共定位现象使得我们推测二者间存在相互作用,这种作用可以趋化巨噬细胞浸润至移植物内、参与ABMR移植物损伤的发生发展。Pabois 等[24]研究也表明,在心脏移植受者活检组织和体外实验中发现,内皮细胞可以通过notch 信号通路募集巨噬细胞并诱导其向M1 极化,参与ABMR 的发生。巨噬细胞可以产生iNOS 促进内皮细胞损伤和肾小管毒性[25]。
综上,本研究发现M1 型巨噬细胞在ABMR 中显著增多,且巨噬细胞、B 淋巴细胞和内皮细胞之间可能存在相互作用,但移植物中巨噬细胞的来源以及与内皮细胞的具体作用机制、如何造成移植物损伤,都是我们进一步研究的重点内容。
