三疣梭子蟹(Portunus trituberculatus)的保活参数优化及其代谢响应*
2022-09-21曾廷兰母昌考王春琳叶央芳
曾廷兰 陈 燕 母昌考, 2 王春琳, 2 史 策, 2 叶央芳①
三疣梭子蟹(Portunus trituberculatus)的保活参数优化及其代谢响应*
曾廷兰1陈 燕1母昌考1, 2王春琳1, 2史 策1, 2叶央芳1①
(1. 宁波大学海洋学院 浙江宁波 315832; 2. 宁波大学应用海洋生物学教育部重点实验室 浙江宁波 315832)
为延长三疣梭子蟹()在捕捞后的存活时间, 在优化保活温度和充氧量的基础上, 再采用基于核磁共振(NMR)的代谢组学技术, 比较分析了三疣梭子蟹前鳃代谢谱在充氧和不充氧保活过程中的变化。结果发现, 12 °C下的三疣梭子蟹存活率最高, 80%的三疣梭子蟹能存活3.5 d。加大充氧量能提高三疣梭子蟹的存活率, 3.6 L氧气可满足一只三疣梭子蟹成蟹存活到3 d以上。因此, 保活三疣梭子蟹的适宜温度和充氧量分别是12 °C和3.6 L。不充氧保活会导致三疣梭子蟹前鳃中乳酸、丙氨酸和葡萄糖等代谢物的快速积累, 但充氧保活可抑制这些代谢物的变化, 表明氧气通过缓解三疣梭子蟹前鳃的缺氧和渗透压失衡, 从而有效延长三疣梭子蟹的存活时间。研究结果为三疣梭子蟹的保活运输提供可借鉴的方法和理论参考。
三疣梭子蟹; 保活; 氧气; 核磁共振; 代谢组学
三疣梭子蟹(, 以下简称梭子蟹)隶属于甲壳纲(Crustacea)、十足目(Decapoda)、梭子蟹科(Portunidae)、梭子蟹属(), 是我国重要的海洋经济蟹类。鲜活的梭子蟹口感细腻, 肉质鲜美, 但在捕捞后很容易死亡, 在酶和微生物的共同作用下快速腐败, 严重影响梭子蟹的质量和口感(Lu, 2015; Grassi, 2019)。
为了保活梭子蟹, 人们采用活水舱运输、充氧水运和保湿干运的方法用于鲜活梭子蟹的运输(林永平, 1989; 王春琳等, 2001; 王寒冰, 2006)。湿法运输的梭子蟹存活率通常高于干法运输(谢佳彦等, 2010), 但鲜有方法能有效保活梭子蟹到3 d以上。鲜活梭子蟹存活期短可能与多种因子有关。鳃是梭子蟹进行离子和气体交换的场所, 鳃瓣的粗糙结构和大的比表面积有利于离子的转运和气体的传输(佟蕊等, 2011)。捕捞后的梭子蟹往往被暴露在空气中, 空气暴露可导致鳃组织的湿度降低, 鳃瓣粘结, 对氧气的吸收能力下降, 进而导致梭子蟹血淋巴中的二氧化碳和胺类等有害代谢物质累积, 引起梭子蟹的组织内部缺氧(Dong, 2019)。即便在最优温度条件下, 干露就导致近90%的梭子蟹存活不到24 h, 仅有极小部分梭子蟹能存活到36 h (Dong, 2019)。除了空气暴露外, 梭子蟹还必须忍耐周围环境温度的变化, 导致梭子蟹体内剧烈的代谢波动。如高温不仅能加快梭子蟹的代谢速率, 还能导致血淋巴和肌肉中的葡萄糖、乳酸和腺嘌呤核苷酸等能量相关代谢物水平的显著变化(Lu, 2015, 2016)。因此, 过高或过低的环境温度都不利于梭子蟹的存活。此外, 在人工捆绑、分拣和装筐时, 梭子蟹还会遭受因挣扎、受惊和挤压等导致的生理压力和机械损伤; 以及在运输过程中受到饥饿、颠簸和噪音等因素的影响(Fotedar, 2011)。正是由于上述多种因子的综合作用最终导致梭子蟹在捕捞后的存活期较短, 有时甚至只有几个小时。
本研究利用保活袋单体包装梭子蟹, 分析了温度和充氧量对梭子蟹成蟹存活的影响, 并采用基于核磁共振(NMR)的代谢组学技术探讨了氧气对梭子蟹存活影响的代谢机理, 为三疣梭子蟹的活体运输提供理论和技术支持。
1 材料与方法
1.1 材料与试剂
于2017年10月自宁波一养殖场购买一批三疣梭子蟹, 选择重量为(124±20) g的30只梭子蟹用于温度实验、重量为(160±25) g的30只梭子蟹用于充氧量实验。于2018年10月在同一养殖场又购买重量为(170±45) g的150只梭子蟹用于代谢组学实验。采购的梭子蟹通过气泵充氧方式并加盖遮阳网在2 h内运回实验室, 在塑料筐(2.0×1.5×0.7 m)内充气暂养一周, 暂养用水为消毒后的天然海水, 每日投喂花蛤, 于次日早晨清理残渣。
甲醇、NaH2PO4·2H2O、K2HPO4·3H2O和NaCl购自上海国药集团化学试剂有限公司; 重水(99.9%氘代)和2,2,3,3-氘代三甲基硅烷丙酸钠(TSP)购自美国Sigma-Aldrich公司。
1.2 主要仪器与设备
GXZ智能型光照培养箱, 宁波江南仪器厂; Bruker Avance III 600 MHz核磁共振谱仪, 德国Bruker公司; Bioprep-24组织破碎仪, 北京同德创业科技有限公司; 5415R低温高速离心机, 德国Eppendorf公司; FreeZone冷冻干燥机, 美国Labconco公司。梭子蟹打包设备由氧气瓶、配套充氧设备、封口机、抽气泵和充氧打包袋组成。
1.3 梭子蟹的保活袋包装方法
把肢体完整的鲜活梭子蟹单独装入塑料盒中, 再放入含有适量海水的透明塑料保活袋(30 cm´10 cm, Shi, 2021)中, 手动挤出空气, 用封口机把袋子开口端封紧。从充气口充入适量体积的氧气, 挤平充气口。
1.4 温度和充氧量实验
为研究温度对梭子蟹存活的影响, 把选定的梭子蟹随机分成5组, 每组6只。设置海水量均为1.2 L, 充氧量均为4.8 L, 而每组的温度分别为8、12、16、20和24 °C。每只蟹独立包装后分别置于这5个温度的恒温培养箱中。每隔12 h观察梭子蟹的存活状况, 梭子蟹死亡的判断标准为眼柄无反应, 口器张开, 螯足和步足无反应, 并下垂(Barrento, 2011; Lu, 2016)。
为研究充氧量对梭子蟹存活的影响, 把选定的梭子蟹随机分成5组, 每组6只。设置海水量均为1.2 L, 保活温度均为优化温度(12 °C), 设置充氧量分别为1.2、2.4、3.6、4.8和6.0 L。每只蟹独立包装后分别置于优化温度(12 °C)的恒温培养箱中。每隔12 h观察梭子蟹的存活状况, 计算存活率。
1.5 代谢组学实验
把选定的梭子蟹随机分成2组, 每组75只。随机选取9只梭子蟹作为保活0 h组。对剩余梭子蟹分别独立包装, 设置海水量均为1.2 L。对充氧组的每个保活袋中充入优化的充氧量(3.6 L), 而对不充氧的对照组的每个保活袋中充入相同量(3.6 L)的空气。置于室温为(14.5±1.5) °C的房间内。每日观察梭子蟹的存活情况, 计算存活率。分别在保活24、36、48和54 h时随机选取对照组和氧气组中存活的梭子蟹各9只。由于氧气组的梭子蟹存活时间较长, 因此增加了一个108 h的取样点。鉴于前鳃组织的呼吸功能(周双林等, 2001), 本研究采集梭子蟹的第二和第三对鳃的鳃丝, 快速放入冻存管, 立即置于液氮中, 随后转移至–80 °C保存备用。精确称量0.05 g前鳃样品, 加入含有破碎珠的2.5 mL破碎管, 加入1 mL甲醇水溶液(2:1), 使用组织破碎仪破碎(4 500 r/min) 30 s, 对破碎液离心(4 °C, 12 000 r/min) 10 min, 取上清液。用上述方法对剩余沉淀物再重复提取一次, 将两次上清液合并, 使用真空抽滤泵除去上清液中的甲醇后冷冻干燥。获得的冻干样置于–80 °C保存备用。
在前鳃提取物的冻干样中加入600 μL钠钾缓冲液, 充分溶解后离心(4 °C, 12 000 r/min) 10 min, 转移550 μL的上清液至直径为5 mm的核磁管。使用配有超低温探头的核磁共振谱仪对样品进行一维与二维核磁谱的采集, 具体方法详见Xiao等(2008)。对前鳃样品的1H NMR谱进行分段积分, 选取谱区间为9.7~0.8, 去除5.0~4.75和3.38~3.35的信号区间以消除水和甲醇的干扰, 设置积分区间为2.4 Hz。对积分数据进行重量归一化处理以消除样品之间的重量差异。把归一化的NMR数据导入SIMCA-P+软件(V11.0, 瑞典Umetrics公司), 选择标准化的数据处理模式对NMR数据作主成分分析(PCA), PCA分析结果不仅可提供样本的聚类情况, 还可检测离群样本点。然后对NMR数据作正交偏最小二乘法-判别分析(OPLS-DA), 在OPLS-DA分析中, 设置自动规格化的数据处理模式, 并以NMR数据为变量, 以分组信息为变量。为验证OPLS-DA模型的可靠性, 采用9倍交叉验证的方法, 如果验证所得的2值较高说明模型的质量越高。此外, 还采用交叉验证的方差分析(CV-ANOVA)方法进一步验证OPLS-DA模型的可靠性, 如果所得<0.05, 则证明OPLS-DA模型是可靠的(Eriksson, 2008)。为了获得导致组间区分的物质, 先对自动规格化的NMR数据作回溯转换(Cloarec, 2005), 再借助MATLAB软件制作OPLS-DA模型相对应的相关系数图。相关系数图上每个点具有不同的颜色, 该颜色代表变量(即NMR数据)和变量(即分组信息)之间的皮尔森积差相关系数()值。根据本研究的样本重复数=9, 判定||>0.632的营养物质对组间区分具有显著意义(<0.05)。
为获得梭子蟹前鳃中重要代谢物水平在保活过程中的相对变化, 本文计算了这些物质相对于保活0 h对照中该代谢物增加或减少的变化百分率, 计算公式如下:
CR = 100×(M–0) /0, (1)
式中, CR表示代谢物的相对变化百分率(单位: %),M和0分别表示在保活某一时间点和保活0 h时的代谢物浓度。
1.6 生存曲线分析
采用Kaplan-Meier方法(GraphPad Prism 5, GraphPad Software, Inc., La Jolla, CA, United States)的Log-rank (Mantel-Cox)法获得中位生存时间和样本组之间的差异显著性。
2 结果与分析
2.1 三疣梭子蟹保活条件优化
鉴于温度和氧气是梭子蟹存活的重要环境因子, 本研究分析了不同温度和充氧量对梭子蟹存活的影响。结果表明, 在一定的充氧量条件下, 8~24 °C都不能确保梭子蟹在3 d内全部存活(图1a), 其中12 °C下的梭子蟹存活率最高, 有80%的梭子蟹能存活3.5 d, 但只有50%的梭子蟹能存活到第5天。次优的温度是8 °C, 有80%的梭子蟹能存活2.5 d, 随后存活率急剧下降, 到第5天时已全部死亡。其他三个温度下的梭子蟹存活率随着温度的提高依次降低, 24 °C下的梭子蟹在第2天已全部死亡。相比于温度, 充氧量对梭子蟹存活的影响较小(图1b), 且随着充氧量的增加, 梭子蟹的存活率逐渐提高。其中3.6 L或以上的充氧量可确保所有梭子蟹存活到3 d以上, 其中6.0 L组的梭子蟹存活率最高, 5 d存活率为50%。综合上述结果可知, 保活梭子蟹的适宜温度和充氧量分别是12 °C和3.6 L。
2.2 氧气对三疣梭子蟹存活率的影响
为解析氧气对梭子蟹存活影响的代谢机理, 本研究首先观察了充氧和不充氧条件下梭子蟹的存活率差异。结果发现, 充氧组的中位生存时间达到147.5 h (图2), 最接近于充氧量实验中6.0 L组别梭子蟹的半数生存期(图1b), 而显著高于不充氧对照组的57 h (图2,<0.000 1), 表明氧气在梭子蟹保活中的重要作用。
2.3 氧气对三疣梭子蟹前鳃代谢物的影响
为进一步明确氧气对三疣梭子蟹存活的影响, 实验采用代谢组学技术分析了充氧和不充氧条件下梭子蟹前鳃的代谢谱变化。结果发现, 在可检测到的36种前鳃小分子代谢物中(图3左; 表1), 有部分代谢物信号发生了较大幅度的变化。如与保活前(0 h)相比, 乳酸信号在不充氧条件下保活36 h时明显增强。借助无监督的PCA轨迹图(图3右)显示, 不充氧对照组的梭子蟹前鳃的代谢轨迹持续偏离0 h对照组, 而充氧组的代谢轨迹的偏离幅度减小, 且呈现震荡偏离的现象。表明氧气减缓了梭子蟹前鳃的代谢变化, 即便延长保活时间到108 h, 其整个代谢谱变化仍小于不充氧的对照组。

图1 温度(a)和充氧量(b)对三疣梭子蟹存活率的影响

图2 氧气对三疣梭子蟹生存曲线的影响
为揭示充氧和不充氧条件下前鳃代谢物的变化差异, 本研究采用监督的OPLS-DA方法分析了各保活时间点相对于0 h点的代谢物差异。本研究共构建了9个OPLS-DA模型(图4a~4d; 图5a~5b; 前三个时间点的氧气组模型未显示), 相应的2值均大于0.4, CV-ANOVA验证结果值均小于0.05, 说明所有OPLS-DA模型均可靠。OPLS-DA结果表明, 与保活0 h的对照相比, 在不充氧保活24 h可导致前鳃的丙氨酸、甜菜碱、牛磺酸、葡萄糖和色氨酸的水平显著升高(图4a’); 而充氧保活24 h仅导致海藻糖水平的显著升高(结果未显示)。同样与0 h前鳃相比, 在不充氧保活36 h可导致前鳃的乳酸、丙氨酸、甜菜碱、牛磺酸、葡萄糖、组氨酸和葫芦巴碱水平的显著升高(图4b’); 而充氧保活36 h仅导致葡萄糖水平的显著升高(结果未显示)。当保活到48 h时, 不充氧条件下的前鳃相比于0 h对照, 除仍含有更高水平的丙氨酸、甜菜碱、牛磺酸、葡萄糖与葫芦巴碱外, 还含有更高水平的酪氨酸和色氨酸(图4c’); 而充氧条件下的前鳃的甜菜碱、酪氨酸和色氨酸水平显著高于0 h对照(结果未显示)。当保活延长到54 h时, 不充氧条件下的前鳃相比于0 h对照, 含有更高水平的乳酸、丙氨酸和次黄嘌呤, 同时含有较低水平的谷氨酸、甜菜碱和2-吡啶甲醇(图4d’); 而充氧条件下的前鳃中仅葡萄糖和肌苷的水平显著高于0 h对照(图5a’)。由于取样和梭子蟹的死亡, 在保活108 h时, 仅充氧条件下的梭子蟹仍有存活。但其前鳃的代谢物开始出现较大变化, 比0 h对照含有更高水平的乳酸、丙氨酸、胆碱-O-硫化物、磷酸胆碱、甜菜碱、牛磺酸、酪氨酸、组氨酸、海藻糖、肌苷和2-吡啶甲醇(图5b’)。上述显著变化的代谢物的相关系数列于表2。
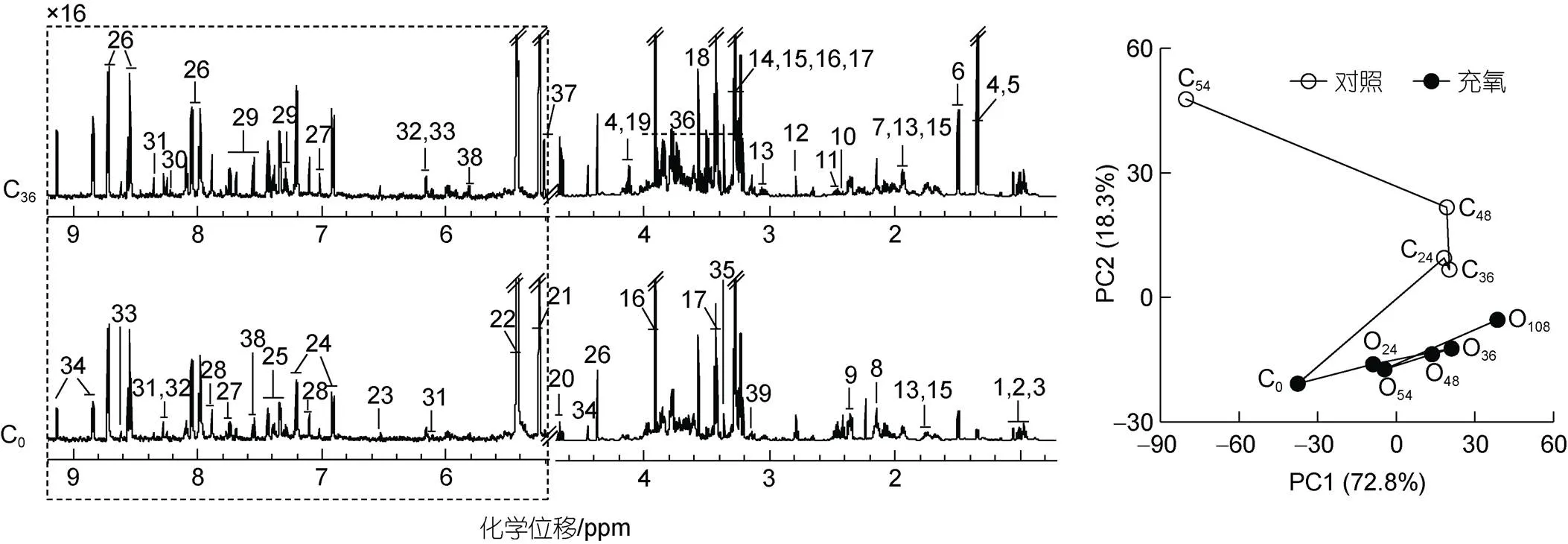
图3 充氧和不充氧条件下三疣梭子蟹前鳃组织提取物的典型600 MHz 1H NMR谱(左)及其代谢轨迹(右)
注: C0~C54: 对照组0 h、24 h、36 h、48 h和54 h; O24~O108: 充氧组24 h、36 h、48 h、54 h和108 h。虚线区域相比于4.7~0.7 ppm区域纵向放大了16倍
表1 三疣梭子蟹前鳃代谢物的核磁数据

Tab.1 NMR data of the metabolites in crab anterior gills extracts

续表
注: 多重性a: s. 单峰; d. 双峰; t. 三重峰; q. 四重峰; m. 多重峰; dd. 两重双重峰; dt. 两重三重峰; td. 三重两重峰
本研究进一步分析了前鳃中各代谢物在保活过程中的整体变化趋势, 发现只有乳酸的变化幅度最大(图6)。表现在不充氧条件下54 h时比对照增加了2 729.07%, 但充氧条件下, 乳酸水平在54 h内没有增加, 直到108 h时才增加为对照的244.42%。而其他代谢物如葡萄糖、丙氨酸、酪氨酸、色氨酸、次黄嘌呤、肌苷和胆碱-O-硫化物的最大累积增量为0 h对照的100%~300%, 而组氨酸、甜菜碱、牛磺酸、2-吡啶甲醇和葫芦巴碱的最大累积增量均不足0 h对照的100% (数据未显示)。

图4 不充氧保活的三疣梭子蟹前鳃提取物的OPLS-DA得分图(a~d)和相关系数图(a’~d’)
注: C0(黑色星号)、C24(红色圆圈)、C36(蓝色方框)、C48(紫色菱形)和C54(棕色三角形)分别代表保活0 h、24 h、36 h、48 h和54 h的前鳃。数字代表的代谢物信息见表1
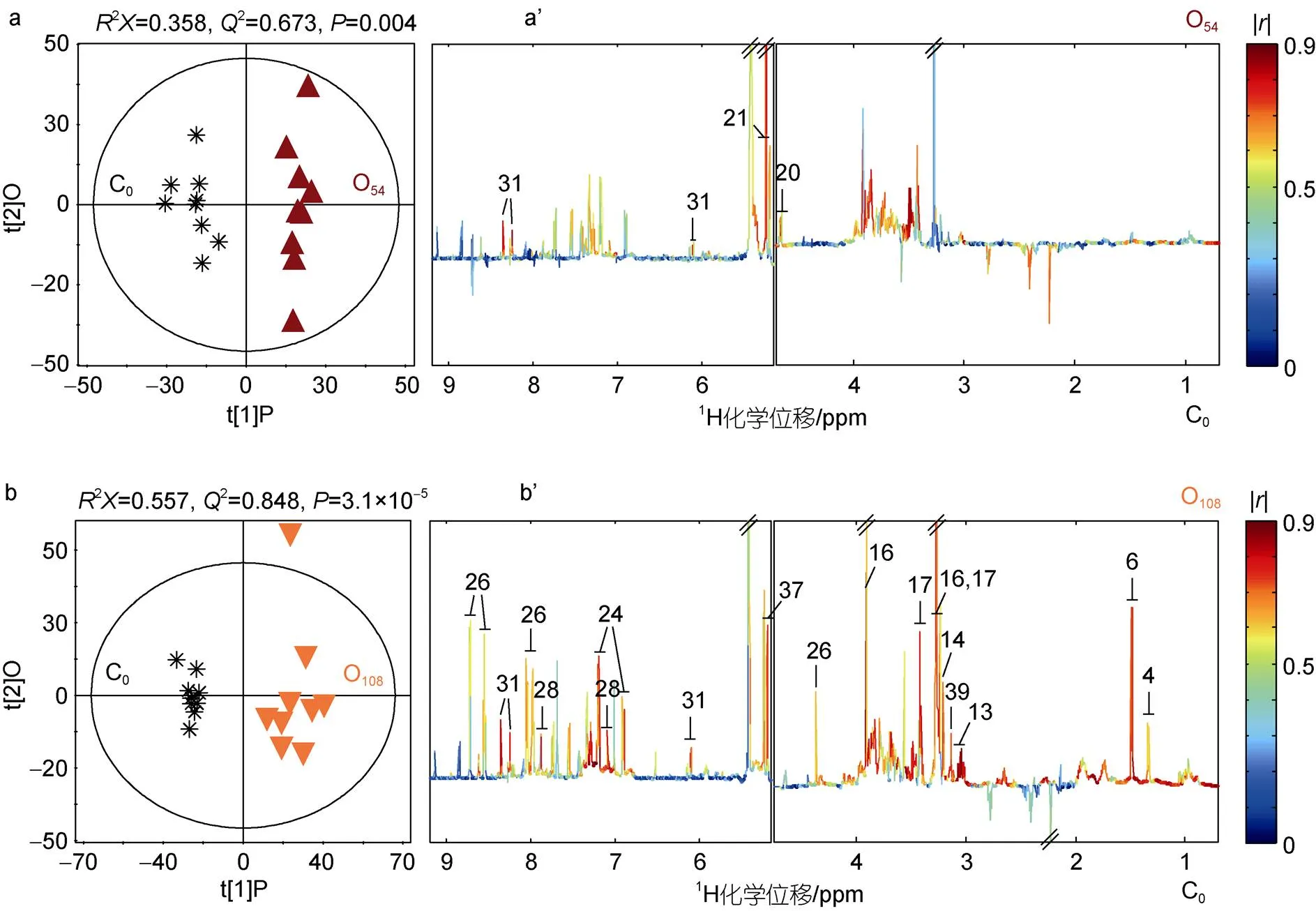
图5 充氧保活的三疣梭子蟹前鳃提取物的OPLS-DA得分图(a~b)和相关系数图(a’~b’)
注: C0(黑色星号)、O54(棕色三角)和O108(桔色倒三角)分别代表保活0 h、54 h和108 h的前鳃。数字代表的代谢物信息见表1
表2 在充氧和不充氧条件下三疣梭子蟹前鳃中显著变化的代谢物的OPLS-DA相关系数

Tab.2 OPLS-DA correlation coefficients for significantly altered metabolites in aqueous extracts of the anterior gills of P. trituberculatus kept in the air or supplemented oxygen

图6 充氧和不充氧条件下三疣梭子蟹前鳃乳酸的相对变化
3 讨论
3.1 温度和氧气对三疣梭子蟹存活表型的影响
三疣梭子蟹离水后的快速死亡很大程度上归因于环境因子的剧烈变化, 温度和氧气是其中两个关键因子。目前有较多学者关注温度对梭子蟹存活的影响(Lu, 2015, 2016; Dong, 2019), 但鲜有对氧气的研究。溶解氧的重要性在梭子蟹的常规养殖中并不凸显, 但在梭子蟹运输中却显得尤为重要。本研究发现, 温度和充氧量对梭子蟹的存活都起着决定性作用, 但两者的影响方式不同。就温度而言, 过低和过高的温度都不利于梭子蟹的存活, 12 °C是10月份梭子蟹保活的较适宜温度。这个适宜温度可能与环境温度有关, 已有研究发现, 蟹类的最适温度会随着环境温度的变化而变化(Lewis, 2014)。因此, 在不同月份下保活梭子蟹要适当调整保活温度。与温度影响不同的是, 充氧量越大, 梭子蟹的存活率就越高, 但高到一定程度后存活率的提高不明显, 表明梭子蟹对氧气的需求是有限值的。Liu等(2011)报道梭子蟹存活需要的溶解氧水平为2~4 mg/L。在本研究中, 0.7 L的充氧量可使保活袋中海水的溶解氧达到8.6 mg/L, 可满足梭子蟹存活所需。但随着保活时间的延长, 氧气被逐渐消耗, 因此充氧量要与梭子蟹的耗氧率相匹配。显然, 耗氧率越高, 保活袋的充氧量就越大。而梭子蟹的耗氧率又受到单位水体梭子蟹质量和外界环境因素等因子的影响(王馨等, 2014)。在本实验条件下, 3.6 L的充氧量可满足梭子蟹成蟹3 d存活的需要。但在不同保活条件下, 可能需要适当调整充氧量。
3.2 三疣梭子蟹对温度和氧气的代谢响应
温度和氧气都会影响梭子蟹的存活, 这可能与这两个因子影响梭子蟹的代谢有关。现有不少研究关注温度对蟹类代谢的影响。如高温能加快三疣梭子蟹的代谢速率, 导致血淋巴和肌肉中的葡萄糖、乳酸和腺嘌呤核苷酸等能量相关的代谢物产生剧烈波动(Lu, 2015, 2016); 高温也能改变蓝蟹() (Abol-Munafi, 2020)和榄绿青蟹() (Azra, 2020)的脂肪酸组成, 并显著提高招潮蟹(Capparelli, 2019)、(Da Silva Vianna, 2020)和(Manríquez, 2021)的耗氧量。而适度低温(10 °C)能显著提高梭子蟹肌肉中与渗透调节相关的海藻糖-6-磷酸合成酶基因和能量代谢相关的果糖1,6-二磷酸醛缩酶基因的表达(Zhao, 2015); 还能刺激拟穴青蟹()肌肉中四种ATPase的活性, 但过低的温度(5 °C)却显著抑制了Ca2+-ATP酶和Ca2+/Mg2+-ATP酶的活性(Kong, 2012)。显然, 过高和过低的温度都可能影响梭子蟹的正常代谢, 这可能在一定程度上解释了本研究中温度对梭子蟹存活影响的代谢原因。
相比于温度, 较少学者关注氧气对蟹类代谢的影响。Liu等(2011)发现, 三疣梭子蟹对溶解氧的敏感性高于帝王蟹(), 其消化腺的葡萄糖、胆固醇和酰基甘油水平随着溶解氧的下降而显著降低, 而乳酸脱氢酶活性和乳酸水平却显著升高, 显示出明显的好氧代谢向厌氧代谢转换的特征。本研究也发现了类似现象, 主要观察到乳酸在不充氧保活的梭子蟹前鳃中被大量积累。作为蟹类厌氧呼吸的主要末端终产物(Gäde, 1986), 乳酸的积累与蟹的缺氧紧密相关(Lowery, 1986; Van Aardt, 1987)。如蓝蟹()缺氧时的血淋巴乳酸积累量可达到正常时的40~60倍(Lowery, 1986)。本研究中, 前鳃乳酸水平的大幅度增加预示着梭子蟹在不充氧的保活袋中在24 h时已经缺氧, 到54 h时已严重缺氧。显然, 在缺氧条件下, 梭子蟹前鳃的能量代谢效率显著降低。为维持基本的生命活动, 生物需要消耗更多的葡萄糖用于产能(Larade, 2002)。但前鳃葡萄糖并没有全部进入糖酵解用于乳酸发酵, 而是被部分积累。这种现象类似于江蟹()在缺氧6 h时血淋巴中葡萄糖的积累(Van Aardt, 1987), 以及其他无脊椎动物海参()在缺氧时肌肉中葡萄糖的积累(Weinrauch, 2019)。Yoldas等(2021)认为, 葡萄糖的积累是为了维持细胞的正常体积和稳定大分子结构, 本研究中梭子蟹前鳃中葡萄糖的倍增可能与能量代谢和保护作用有关。本研究还发现葫芦巴碱水平的显著升高。葫芦巴碱是烟酸的甲基化产物(Upmeier, 1988), 不仅是植物的重要渗透保护物质(Lee, 2008), 还是动物特别是蟹类应对压力的主要渗透调节物质(Hammer, 2012)。本研究团队早前也发现梭子蟹应对低盐胁迫时肌肉中大量积累的葫芦巴碱(Ye, 2014), 表明梭子蟹产生更多的葫芦巴碱是为了维持前鳃在缺氧下的渗透平衡。甜菜碱、牛磺酸和丙氨酸水平的显著升高也进一步佐证了这一推测。这是因为甜菜碱是动植物中普遍存在的渗透调节物质(Cook, 1984; Peel, 2010), 更在海洋生物中发挥其渗透调节功能(Preston, 1993)。牛磺酸也被认为是鱼类在压力条件下的渗透调节因子(Fiess, 2007; Avella, 2009)。而丙氨酸是植物和动物响应外界胁迫的初级压力信号分子(Eberlee, 1988; Monselise, 2003)。因此, 这些代谢物在不充氧保活48 h前的大量累积可能都指示梭子蟹前鳃受到了缺氧的压力, 并积极进行能量代谢和渗透平衡的调节。但在54 h时, 只剩下丙氨酸水平显著高于对照, 同时甜菜碱水平显著低于对照, 表明呼吸酸化(Astall, 1991)和渗透压失衡可能最终促使了梭子蟹的死亡。
而氧气可有效缓解梭子蟹的缺氧状况, 在保活的前54 h, 不仅乳酸没有被大量积累, 而且只有个别代谢物发生了显著升高, 其中渗透调节物质海藻糖和葡萄糖水平的显著提高可稳定细胞内大分子的结构和功能(Simola, 2000), 有助于维持梭子蟹前鳃的代谢稳态。但在保活108 h时, 充氧组梭子蟹前鳃开始出现乳酸和丙氨酸等11种代谢物水平的显著升高, 预示着能量代谢、氨基酸代谢、核苷酸代谢等多种代谢的紊乱。
4 结论
在10月份, 在保活袋中充装一定量的海水、3.6 L或以上充氧量, 在12 °C下可保活梭子蟹成蟹3 d以上。不充氧保活可导致梭子蟹前鳃中乳酸、丙氨酸和葡萄糖等代谢物的快速积累, 但充氧保活可抑制这些代谢物的变化, 表明氧气可缓解梭子蟹前鳃的缺氧和渗透压失衡, 从而有效延长梭子蟹的保活时间。
王春琳, 金国英, 2001. 海鲜品保活长途运输技术[J]. 海洋渔业, 23(4): 189-191.
王寒冰, 2006. 三疣梭子蟹养殖技术之四三疣梭子蟹亲蟹的长途运输及其对育苗效果的影响[J]. 中国水产(2): 48-49.
王馨, 王芳, 路允良, 等, 2014. 光照强度对三疣梭子蟹呼吸代谢的影响[J]. 水产科学, 38(2): 237-243.
佟蕊, 成永旭, 吴旭干, 等, 2011. 3种不同栖息环境下蟹鳃的超微结构、脂类组成及含量的比较[J]. 水产学报, 35(9): 1426-1435.
林永平, 1989. 活梭子蟹出口暂养和运输技术试验[J]. 海洋渔业(3): 121-122.
周双林, 姜乃澄, 卢建平, 等, 2001. 甲壳动物渗透压调节的研究进展Ⅰ. 鳃的结构与功能及其影响因子[J]. 东海海洋, 19(1): 44-51.
谢佳彦, 朱爱意, 2010. 几种重要水产品活体运输技术研究[J]. 水产科学, 29(9): 532-536.
ABOL-MUNAFI A B, IKHWANUDDIN M, AZRA M N, 2020. Effects of temperature on the whole body fatty acid composition and histological changes of the gills in blue swimmer crabs,[J]. Aquaculture Reports, 16: 100270.
ASTALL C M, JONES M B, 1991. Respiration and biometry in the sea cucumber[J]. Journal of the Marine Biological Association of the United Kingdom, 71(1): 73-81.
AVELLA M, DUCOUDRET O, PISANI D F,, 2009. Swelling-activated transport of taurine in cultured gill cells of sea bass: physiological adaptation and pavement cell plasticity [J]. American Journal of Physiology: Regulatory Integrative and Comparative Physiology, 296(4): R1149-R1160.
AZRA M N, TAVARES C P D S, ABOL-MUNAFI A B,, 2020. Growth rate and fatty acid composition of orange mud crab instars,, reared at different temperatures [J]. The Egyptian Journal of Aquatic Research, 46(1): 97-102.
BARRENTO S, MARQUES A, VAZ-PIRES P,, 2011.(Linnaeus, 1758) physiological responses to simulated live transport: influence of temperature, air exposure and AQUI-S®[J]. Journal of Thermal Biology, 36(2): 128-137.
CAPPARELLI M V, BORDON I C, ARAUJO G,, 2019. Combined effects of temperature and copper on oxygen consumption and antioxidant responses in the mudflat fiddler crab(Brachyura, Ocypodidae) [J]. Comparative Biochemistry and Physiology Part C: Toxicology & Pharmacology, 223: 35-41.
CLOAREC O, DUMAS M E D, TRYGG J,, 2005. Evaluation of the orthogonal projection on latent structure model limitations caused by chemical shift variability and improved visualization of biomarker changes in1H NMR spectroscopic metabonomic studies [J]. Analytical Chemistry, 77(2): 517-526.
COOK R J, WAGNER C, 1984. Glycine N-methyltransferase is a folate binding protein of rat liver cytosol [J]. Proceedings of the National Academy of Sciences of the United States of America, 81(12): 3631-3634.
DA SILVA VIANNA B, MIYAI C A, AUGUSTO A,, 2020. Effects of temperature increase on the physiology and behavior of fiddler crabs [J]. Physiology & Behavior, 215: 112765.
DONG Z G , MAO S, CHEN Y H,, 2019. Effects of air-exposure stress on the survival rate and physiology of the swimming crab[J]. Aquaculture, 500: 429-434.
EBERLEE J C, STOREY K B, 1988. Tissue-specific biochemical responses during anoxia and recovery in the channeled whelk [J]. Journal of Experimental Marine Biology and Ecology, 121(2): 165-176.
ERIKSSON L, TRYGG J, WOLD S, 2008. CV-ANOVA for significance testing of PLS and OPLS® models [J]. Journal of Chemometrics, 22(11/12): 594-600.
FIESS J C, KUNKEL-PATTERSON A, MATHIAS L,, 2007. Effects of environmental salinity and temperature on osmoregulatory ability, organic osmolytes, and plasma hormone profiles in the Mozambique tilapia () [J]. Comparative Biochemistry and Physiology Part A: Molecular & Integrative Physiology, 146(2): 252-264.
FOTEDAR S, EVANS L, 2011. Health management during handling and live transport of crustaceans: a review [J]. Journal of Invertebrate Pathology, 106(1): 143-152.
GÄDE G, GRAHAM R A, ELLINGTON W R, 1986. Metabolic disposition of lactate in the horseshoe craband the stone crab[J]. Marine Biology, 91(4): 473-479.
GRASSI S, BENEDITTE S, OPIZZIO M,, 2019. Meat and fish freshness assessment by a portable and simplified electronic nose system (Mastersense) [J]. Sensors, 19(14): 3225.
HAMMER K M, PEDERSEN S A, STØRSETH T R, 2012. Elevated seawater levels of CO2change the metabolic fingerprint of tissues and hemolymph from the green shore crab[J]. Comparative Biochemistry and Physiology Part D: Genomics and Proteomics, 7(3): 292-302.
KONG X H, WANG G Z, LI S J, 2012. Effects of low temperature acclimation on antioxidant defenses and ATPase activities in the muscle of mud crab () [J]. Aquaculture, 370/371: 144-149.
LARADE K, STOREY K B, 2002. A profile of the metabolic responses to anoxia in marine invertebrates [J]. Cell and Molecular Response to Stress, 3: 27-46.
LEE G, CARROW R N, DUNCAN R R,, 2008. Synthesis of organic osmolytes and salt tolerance mechanisms in[J]. Environmental and Experimental Botany, 63(1/2/3): 19-27.
LEWIS L, AYERS J, 2014. Temperature preference and acclimation in the Jonah crab,[J]. Journal of Experimental Marine Biology and Ecology, 455: 7-13.
LIU C B, XIAO M, FENG Y H,, 2011. Effects of water dissolved oxygen level on physiological responses in(Miers, 1876) [J]. Chinese Journal of Animal Nutrition, 23(3): 506-513.
LOWERY T A, TATE L G, 1986. Effect of hypoxia on hemolymph lactate and behavior of the blue crabRathbun in the laboratory and field [J]. Comparative Biochemistry and Physiology Part A: Physiology, 85(4): 689-692.
LU Y L, WANG F, DONG S L, 2015. Energy response of swimming crabto thermal variation: implication for crab transport method [J]. Aquaculture, 441: 64-71.
LU Y L, ZHANG D, WANG F,, 2016. Hypothermal effects on survival, energy homeostasis and expression of energy-related genes of swimming crabsduring air exposure [J]. Journal of Thermal Biology, 60: 33-40.
MANRÍQUEZ P H, GONZÁLEZ C P, SEGUEL M,, 2021. The combined effects of ocean acidification and warming on a habitat-forming shell-crushing predatory crab [J]. Science of the Total Environment, 758: 143587.
MONSELISE E B I, PAROLA A H, KOST D, 2003. Low-frequency electromagnetic fields induce a stress effect upon higher plants, as evident by the universal stress signal, alanine [J]. Biochemical and Biophysical Research Communications, 302(2): 427-434.
PEEL G J, MICKELBART M V, RHODES D, 2010. Choline metabolism in glycinebetaine accumulating and non-accumulating near-isogenic lines ofand[J]. Phytochemistry, 71(4): 404-414.
PRESTON R L, 1993. Transport of amino acids by marine invertebrates [J]. Journal of Experimental Zoology, 265(4): 410-421.
SHI C, YE Y F, PEI F,, 2021. Survival and metabolic modulation of swimming crabduring live transport [J]. Frontiers in Marine Science, 8: 724156.
SIMOLA M, HÄNNINEN A L, STRANIUS S M,, 2000. Trehalose is required for conformational repair of heat-denatured proteins in the yeast endoplasmic reticulum but not for maintenance of membrane traffic functions after severe heat stress [J]. Molecular Microbiology, 37(1): 42-53.
UPMEIER B, GROSS W, KÖ STER S,, 1988. Purification and properties of-adenosyl-l-methionine: nicotinic acid--methyltransferase from cell suspension cultures ofL. [J]. Archives of Biochemistry and Biophysics, 262(2): 445-454.
VAN AARDT W J, WOLMARANS C T, 1987. Effects of anoxia on the haemolymph physiology and lactate concentrations in the freshwater crabCalman [J]. Comparative Biochemistry and Physiology Part A: Physiology, 88(4): 671-675.
WEINRAUCH A M, BLEWETT T A, 2019. Anoxia tolerance in the sea cucumbersandreflects habitat use [J]. Journal of Experimental Marine Biology and Ecology, 520: 151203.
XIAO C N, DAI H, LIU H B,, 2008. Revealing the metabonomic variation of rosemary extracts using1H NMR spectroscopy and multivariate data analysis [J]. Journal of Agricultural and Food Chemistry, 56(21): 10142-10153.
YE Y F, AN Y P, LI R H,, 2014. Strategy of metabolic phenotype modulation inexposed to low salinity [J]. Journal of Agricultural and Food Chemistry, 62(15): 3496-3503.
YOLDAS T, ERISMIS U C, 2021. Response of Anatolian mountain frogs (and) to freezing, anoxia, and dehydration: glucose as a cryoprotectant [J]. Cryobiology, 98: 96-102.
ZHAO Q, PAN L Q, REN Q,, 2015. Identification of genes differentially expressed in swimming crabresponse to low temperature [J]. Aquaculture, 442: 21-28.
THE OPTIMAL TEMPERATURE AND SUPPLEMENTED OXYGEN AMOUNT FOR LIVEAND THE METABOLIC RESPONSE OF ITS ANTERIOR GILL
ZENG Ting-Lan1, CHEN Yan1, MU Chang-Kao1, 2, WANG Chun-Lin1, 2, SHI Ce1, 2, YE Yang-Fang1
(1. School of Marine Sciences, Ningbo University, Ningbo 315832, China; 2. Key Laboratory of Applied Marine Biotechnology, Ningbo University, Chinese Ministry of Education, Ningbo 315832, China)
To extend the post-capture survival time of swimming crab, the temperature and oxygen amount to keep swimming crab alive in a transport bag were optimized. The metabolic changes of anterior gills of the crabs kept in transport bag with or without oxygen supply were investigated using a nuclear magnetic resonance (NMR)-based metabolomics technique. Results showed that the highest survival rate of the crab occurred in 12 °C, under which 80% of them could survive up to 3.5 days. The survival rate of swimming crab increased with the supplemented oxygen amount; 3.6 L oxygen was enough to keep an adult swimming crab alive for more than three days. Therefore, the optimal conditions to keep a swimming crab alive are 12 °C and 3.6 L oxygen supply, respectively. Moreover, metabolites such as lactate, alanine, and glucose were rapidly accumulated in the anterior gill of the crab exposed to air. However, oxygen could inhibit the changes of these metabolites, indicating that oxygen can extend the survival time of swimming crab by mitigating the oxygen deficit and osmotic imbalance in the anterior gill. This study provides a potential method and theoretical reference for keeping swimming crab alive during shipping.
; keeping alive; oxygen; nuclear magnetic resonance; metabolomics
Q785; S942.5
10.11693/hyhz20220100025
*宁波市科技创新2025重大专项, 2019B10010号; 财政部和农业农村部: 国家现代农业产业技术体系资助。曾廷兰, 硕士研究生, E-mail: 1182865178@qq.com
叶央芳, E-mail: yeyangfang@nbu.edu.cn
2022-01-27,
2022-04-23
