麻痹性贝毒在毛蚶体内的转化过程研究*
2022-09-21林卓如耿慧霞唐文娇于仁成
林卓如 耿慧霞 唐文娇, 5 于仁成, 2, 3, 4
麻痹性贝毒在毛蚶体内的转化过程研究*
林卓如1, 3耿慧霞1唐文娇1, 5于仁成1, 2, 3, 4①
(1. 中国科学院海洋研究所海洋生态与环境科学重点实验室 山东青岛 266071; 2. 青岛海洋科学与技术试点国家实验室海洋生态与环境科学功能实验室 山东青岛 266071; 3. 中国科学院大学 北京 100049; 4. 中国科学院海洋大科学研究中心 山东青岛 266071; 5. 中国海洋大学海洋生命学院 山东青岛 266003)
麻痹性贝毒能够在贝类体内累积, 威胁海产品消费者健康。在以往调查中, 多次在毛蚶()体内发现高含量的麻痹性贝毒, 但对于毛蚶体内麻痹性贝毒的转化过程及其食品安全风险还缺乏认识。通过室内模拟实验, 选择太平洋亚历山大藻()和链状裸甲藻()作为产毒藻种, 研究了两种有毒藻种所产麻痹性贝毒在毛蚶体内的转化过程。结果表明, 毛蚶体内主要出现了三种麻痹性贝毒转化过程, 一是R1位羟基的还原反应, 二是-磺酰氨甲酰基类毒素R4位磺酸基团的水解反应, 三是含羟基苯甲酸(hydroxybenzoate)基团的链状裸甲藻毒素在R4位的水解反应。毛蚶体内麻痹性贝毒的生物转化过程复杂, 对毛蚶毒性的影响具有一定的不确定性, 未来仍需要进一步深化毛蚶体内毒素累积、代谢、转化过程的研究, 同时加强对毛蚶体内毒素含量的全面监测, 防范毛蚶可能导致的麻痹性贝毒中毒风险。
麻痹性贝毒; 毛蚶; 太平洋亚历山大藻; 链状裸甲藻; 链状裸甲藻毒素; 毒素转化
麻痹性贝毒中毒(paralytic shellfish poisoning, PSP)是沿海地区常见的一类中毒事件, 多因消费者误食含有麻痹性贝毒(paralytic shellfish toxins, PSTs)的贝类造成, 严重时可能导致死亡。麻痹性贝毒是一类神经毒素, 能够与神经细胞的钠离子通道结合, 阻断信号传导, 对人体产生毒害作用(Kao, 1965; Ritchie, 1977)。麻痹性贝毒中毒的典型症状包括肢体麻木、皮肤刺痛、恶心、呕吐、发烧、肌肉麻痹等, 严重时可能出现呼吸衰竭和休克等(于仁成等, 2016)156。在海洋环境中, 麻痹性贝毒主要由甲藻产生, 常见的产毒甲藻包括亚历山大藻属()中的部分藻种(如太平洋亚历山大藻.、链状亚历山大藻.、微小亚历山大藻.等)、裸甲藻属的链状裸甲藻()和梨甲藻属中的个别藻种(var.)。其中, 亚历山大藻属和裸甲藻属的产毒藻种在我国近海较为常见(于仁成等, 2016)159~160。麻痹性贝毒通常累积在贝类中, 我国沿海地区曾多次发生过因食用染毒贝类导致的麻痹性贝毒中毒事件, 对消费者身体健康构成严重威胁(林燕棠等, 1999; 于仁成等, 2016156~157, 陈火荣, 2018)。
麻痹性贝毒是一类具有四氢嘌呤环结构的化合物(图1), 已知毒素同系物近60种, 在不同位点取代基种类的差异会影响毒素成分的性质和毒性。在以往研究中, 通常根据R4位点取代基的差异, 将常见麻痹性贝毒分为3类:-磺酰氨甲酰基类毒素、氨基甲酸酯类毒素和脱氨甲酰基类毒素(表1)。其中氨基甲酸酯类毒素的毒性最高, 而-磺酰氨甲酰基毒素由于R4基团过大, 影响与钠离子通道的结合, 表现出最低的毒性(Leal, 2022)13。近年来, 在链状裸甲藻中发现了一类新的羟基苯甲酸酯石房蛤毒素, 并依据产毒藻名称将其命名为链状裸甲藻毒素(toxins), 简称GC毒素(Negri, 2003)。这类毒素R4位点上的取代基为羟基苯甲酸基团。大部分麻痹性贝毒为水溶性毒素, 而GC毒素因其羟基苯甲酸基团而具有一定的脂溶性特征。GC毒素与小鼠脑神经细胞的钠离子通道具有较强的结合能力, 说明其可能具有较高的毒性(Llewellyn, 2004)101。此外, 由于GC毒素具备一定的脂溶性, 研究者推测其在生物体内的保留时间会长于其他麻痹性贝毒, 可能会对消费者身体健康造成更大的危害(Llewellyn, 2004)103。

图1 麻痹性贝毒结构
表1 不同种类麻痹性贝毒的结构

Tab.1 Substituents of different paralytic shellfish toxins
贝类在摄食麻痹性贝毒产毒藻后, 体内的麻痹性贝毒具有明显的蓄积、转化和排出过程, 进而影响贝类的毒性状况。根据以往研究得到的认识, 贝体内麻痹性贝毒具有多类转化过程, 根据其转化条件可分为化学转化过程和酶促转化过程(Suzuki, 1998)。麻痹性贝毒R2与R3基团的差向异构化反应属于典型的化学转化过程, 由藻类中占据优势的异构体逐渐转化为贝类中占据优势的异构体(Jaime, 2007)。此外,-磺酰氨甲酰基类毒素水解产生氨基甲酸酯类毒素也是化学转化过程, 该反应倾向于在酸性条件下发生(田华, 2009)。贝类体内发生的毒素酶促转化过程主要是通过水解反应生成脱氨甲酰基类毒素, 包括氨甲酰基水解酶对氨基甲酸酯类毒素的水解以及磺氨甲酰基水解酶对-磺酰氨甲酰基类毒素的水解(Raposo, 2020)4。目前, 对于GC毒素在贝体内的转化过程仍缺乏足够的了解, 有研究认为GC毒素在贝体内也会通过酶促水解产生脱氨甲酰基类毒素(Vale, 2008)191。贝类对于麻痹性贝毒的转化具有明显的种间差异, 扇贝和蛤对麻痹性贝毒的转化过程较为强烈, 其体内的毒素组成与产毒藻存在较大差异; 牡蛎和贻贝对麻痹性贝毒的转化相对较弱, 更多表现为毒素比例的变化(Botelho, 2020; 包振民等, 20214)。还有研究表明, 贝类摄食产毒藻后能够将麻痹性贝毒快速代谢转化为新型的低毒性M类毒素(Dell’Aversano, 2008; Li, 2012), 并将其快速排出体外, 以达到脱毒的目的。因此, 深入探究贝体内麻痹性贝毒的转化过程, 解析不同贝类对毒素的转化特征, 有助于准确评估贝体内麻痹性贝毒的致毒风险, 更好地防控麻痹性贝毒中毒事件。
毛蚶()广泛分布于我国沿海地区, 是常见的海产经济贝类。主要产区位于渤海和黄海海域, 包括渤海湾、辽东半岛和黄海大陆架海域等(张福崇等, 2020)。到目前为止, 我国沿海尚未出现因食用毛蚶导致的麻痹性贝毒中毒事件。但是, 以往调查中发现毛蚶体内麻痹性贝毒含量可以达到较高水平, 在天津汉沽和河北秦皇岛海域的毛蚶样品中, 麻痹性贝毒毒性甚至超出农产品安全质量限量标准(柳阳, 2017)70, 极有可能导致中毒事件发生。目前对于毛蚶体内麻痹性贝毒的累积、转化和排出过程还缺乏科学认识, 有必要通过科学研究深入了解毛蚶暴露于有毒藻后体内麻痹性贝毒的动态变化过程, 进而阐明其对毛蚶毒性的影响。对此, 本研究通过模拟实验, 选择太平洋亚历山大藻(.)和链状裸甲藻(.)作为典型产毒藻种, 研究了毛蚶体内麻痹性贝毒的转化过程, 以期揭示毛蚶中麻痹性贝毒转化特征和规律, 为防控麻痹性贝毒中毒事件提供基础科学依据。
1 材料与方法
1.1 实验仪器与试剂
实验中用到的有机溶剂包括甲醇(色谱级, Merck, 德国)、乙腈(色谱级, Merck, 德国)、甲酸(色谱级,≥99%, 麦克林)、硝酸(工艺超纯, 66.6%~68.0%, 国药)、磷酸(优级纯, 国药)、盐酸(优级纯, ≥36%, 国药)、乙酸(色谱级, ≥99.0%, 科密欧)、氨水(优级纯, 25%~28%, 国药)、四丁基磷酸二氢铵(≥99.00%, Fulka, 美国)、庚基磺酸钠(Wako, 日本)、高碘酸H5IO6·2H2O(≥99.0%, Sigma, 美国)。实验中使用的超纯水由超纯水机(Millipore Simplicity, 美国)制备。毒素标准物质(GTX1&4、GTX2&3、STX、NEO、dcGTX2&3、dcSTX、dcNEO、C1&2、GTX5、GTX6)购自加拿大国家研究院海洋生物科学研究所, 在有效使用期内使用。
1.2 实验生物
实验所用藻株包括太平洋亚历山大藻(MEL2株)和链状裸甲藻(MEL11株)。太平洋亚历山大藻(以往通过形态学方法鉴定为塔玛亚历山大藻复合种.species complex, ATHK藻株)来自暨南大学, 分离自南海; 链状裸甲藻于2017年分离自福建莆田近海, 并经形态学和分子生物学鉴定(Lin, 2022)。实验用海水取自青岛市汇泉湾, 经0.45 μm滤膜过滤后, 煮沸灭菌, 冷却后加入到经过高温灭菌的锥形瓶中, 按照L1培养基配方(Guillard, 1993)加入营养盐、微量元素和维生素, 接入藻种后进行培养。太平洋亚历山大藻培养温度为18 °C, 光照强度为3 000 lx, 光暗循环为L: D=12 h: 12 h; 链状裸甲藻培养温度为20 °C, 光照条件同上。
实验用毛蚶(.)采自山东青岛近海, 壳长(4.50±0.27) cm, 壳宽(3.45±0.24) cm, 壳高(2.82±0.28) cm, 软组织净重(6.94±1.04) g。购入后先在实验室内驯化, 期间持续通气并每天更换培养海水。挑取驯化后健康活跃的毛蚶用于实验, 每6只毛蚶分为1组, 培养于装有3 L经0.22 μm滤膜过滤海水的烧杯中, 实验期间持续通气并定期更换海水。
1.3 毛蚶摄食太平洋亚历山大藻的室内培养实验
取一定量的太平洋亚历山大藻培养液, 用10 μm筛网浓缩藻液中的藻细胞并置于一定量海水中混匀。取1 mL混匀后的藻液, 加入20 μL鲁哥试剂(Lugol’s agent)固定, 在显微镜(Zeiss, Axio Vert A1, 德国)下计数藻细胞密度。量取一定体积的藻液, 在≤0.05 MPa压力下抽滤至1.2 μm玻璃纤维滤膜(GF/C, Whatman, 直径47 mm)上, 置于-20 °C冷冻保存, 用于麻痹性贝毒分析。将剩余藻液加入烧杯中, 通过加入灭菌海水调整亚历山大藻初始密度至2 000 cells/mL, 每只毛蚶投喂量约为1.0×106藻细胞。实验进行48 h, 分别于投喂毛蚶后的第2、4、6、8和10 h取烧杯中水样10 mL, 加鲁哥试剂固定后计数剩余亚历山大藻细胞密度, 用于计算毛蚶实际摄食的藻细胞数量。分别于投喂前和投喂后的第1、2、4、8、12、24和48 h取毛蚶样品, 解剖毛蚶并采集全部软组织, 于-20 °C下冷冻保存, 统一进行麻痹性贝毒分析。
1.4 毛蚶摄食链状裸甲藻的室内培养实验
链状裸甲藻的浓缩和取样方法与1.3部分中太平洋亚历山大藻的浓缩与取样方法相同。链状裸甲藻初始密度设置为400 cells/mL, 每只毛蚶投喂量约2.0×105藻细胞, 实验进行96 h。分别于投喂后第2、4、6、8、10和12 h取烧杯中水样10 mL, 鲁哥试剂固定后计数剩余藻细胞密度, 用于计算毛蚶摄食藻细胞数量。分别于投喂毛蚶后的第2、4、8、12、24、48、72和96 h取毛蚶样品, 解剖毛蚶并采集全部软组织, 于-20 °C下冷冻保存, 统一进行麻痹性贝毒分析。
1.5 麻痹性贝毒分析
亚历山大藻细胞及投喂亚历山大藻的毛蚶样品均采用高效液相色谱-柱后衍生-荧光检测法进行麻痹性贝毒分析, 毒素提取和分析过程参照柳阳(2017)37~42检测方法进行。链状裸甲藻及投喂链状裸甲藻的毛蚶样品, 因其中含有GC毒素成分, 均采用高效液相色谱-质谱联用方法进行麻痹性贝毒分析, 毒素提取和分析过程如下。
1.5.1 链状裸甲藻中毒素提取 将滤有藻细胞的玻璃纤维滤膜剪碎, 置于15 mL离心管中, 加入3 mL 0.05 mol/L醋酸溶液。使用涡旋振荡器(IKA, MS1 Minishaker, 美国)混合均匀后, 在冰浴条件下使用超声波细胞破碎仪(JY96-Ⅱ型超声波细胞粉碎机, 宁波新芝科器研究所, 国产)对藻类样品进行破碎(设置功率为100 W, 每次处理2 s后静置2 s, 持续处理5 min)。镜检确认藻细胞完全破碎后, 将离心管置于高速冷冻离心机(Sigma 3-16K, 德国)中, 8 000 r/min离心10 min, 取上清液待基质净化。
1.5.2 毛蚶中麻痹性贝毒提取 冷冻的贝类组织在室温下解冻后, 用组织匀浆机(IKA, T10BS25, 美国)匀浆, 取5 g混匀的贝组织, 置于15 mL聚丙烯离心管中, 加入5 mL 0.05 mol/L醋酸溶液, 使用涡旋振荡器震荡混合, 混匀样品置于水浴锅(DK-8D, 上海一恒, 国产)中煮沸约5 min, 自然冷却至室温后, 于高速离心机中8 000 r/min离心10 min, 取上清液待进行基质净化。
1.5.3 提取液基质净化 水溶性麻痹性贝毒提取: 使用甲醇-水交替活化固相萃取柱(Supelclean LC-18, 3 mL, Supelco, 美国)后, 将1 mL藻类或贝类提取液加入固相萃取柱中, 使用真空泵缓慢抽干(压力≤20 kPa), 并将洗脱液收集于5 mL离心管中。再加入1.5 mL超纯水洗脱柱上残留的水溶性麻痹性贝毒, 缓慢抽干后, 与上一步洗脱液合并收集于5 mL离心管中。加入少量超纯水将收集的洗脱液定容至2.5 mL。取1 mL洗脱液, 经0.22 μm滤膜过滤后上机分析。
GC毒素提取: 向上一步洗脱水溶性麻痹性贝毒后的固相萃取小柱, 加入0.5 mL 20%甲醇洗脱, 洗脱液收集于1.5 mL离心管中。再加入0.5 mL 80%甲醇洗脱, 洗脱液与上一步洗脱液合并收集于1.5 mL离心管中。加入少量超纯水将收集的洗脱液定容至1 mL, 震荡混匀后, 取1 mL洗脱液经0.22 μm有机相滤膜过滤后上机分析。
1.5.4 麻痹性贝毒的高效液相色谱-质谱联用分析 参照Costa等(2015)2055~2058建立的方法进行麻痹性贝毒的液-质联用分析。采用超高效液相色谱仪(UltiMate 3000, Thermo Fisher, 美国)配合三重四极杆线性离子阱质谱仪(Qtrap®-4500, AB Sciex, 美国)进行毒素分析, 所用色谱柱为酰胺键合硅胶色谱柱(TSK-gel Amide-80, 5 μm, 2.0 mm×250 mm, 日本)。流动相A为50 mmol/L甲酸水溶液(pH=2.6), 流动相B为含有50 mmol/L 甲酸的95%乙腈水溶液(pH=2.6), 采用梯度洗脱(表2), 流速 200 μL/min, 进样量 2 μL,柱温箱温度30 °C, 样品池温度4 °C。以标准毒素对质谱仪的响应进行调谐并优化检测参数。优化后的质谱参数如下: 电喷雾离子源进行离子化, 气帘气电压20 V, 雾化气电压设置为Medium, 电喷雾电压5 500(+) V, 离子源温度550 °C, 加热辅助电压1和2分别为45 Pa和55 Pa, 碰撞室入口电压为10 V, 碰撞室出口电压为9 V, 电子倍增管电压CEM为1 800 V。在此基础上对去簇电压和碰撞能参数进行调谐优化。由于GC毒素尚无标准品, 其去簇电压和碰撞能参照Costa等(2015)2058提出的方法进行设置。采用正离子扫描模式下的多反应监测模式(multiple reaction monitoring, MRM)对毒素进行检测, 优化后毒素离子对及去簇电压和碰撞能设置见表3。在对无标准品的麻痹性贝毒进行分析时, 假定其与结构相近的其他有标毒素具有相同的质谱响应, 即C3、C4、GC1、GC2、GC3、GC4、GC5与GC6分别参照C1、C2、GTX2、GTX3、STX、GTX1、GTX4和NEO的标准品进行定量分析。
表2 液-质联用法分析麻痹性贝毒的洗脱梯度

Tab.2 Elution gradient in paralytic shellfish toxin analysis by HPLC-MS
表3 麻痹性贝毒质谱检测参数
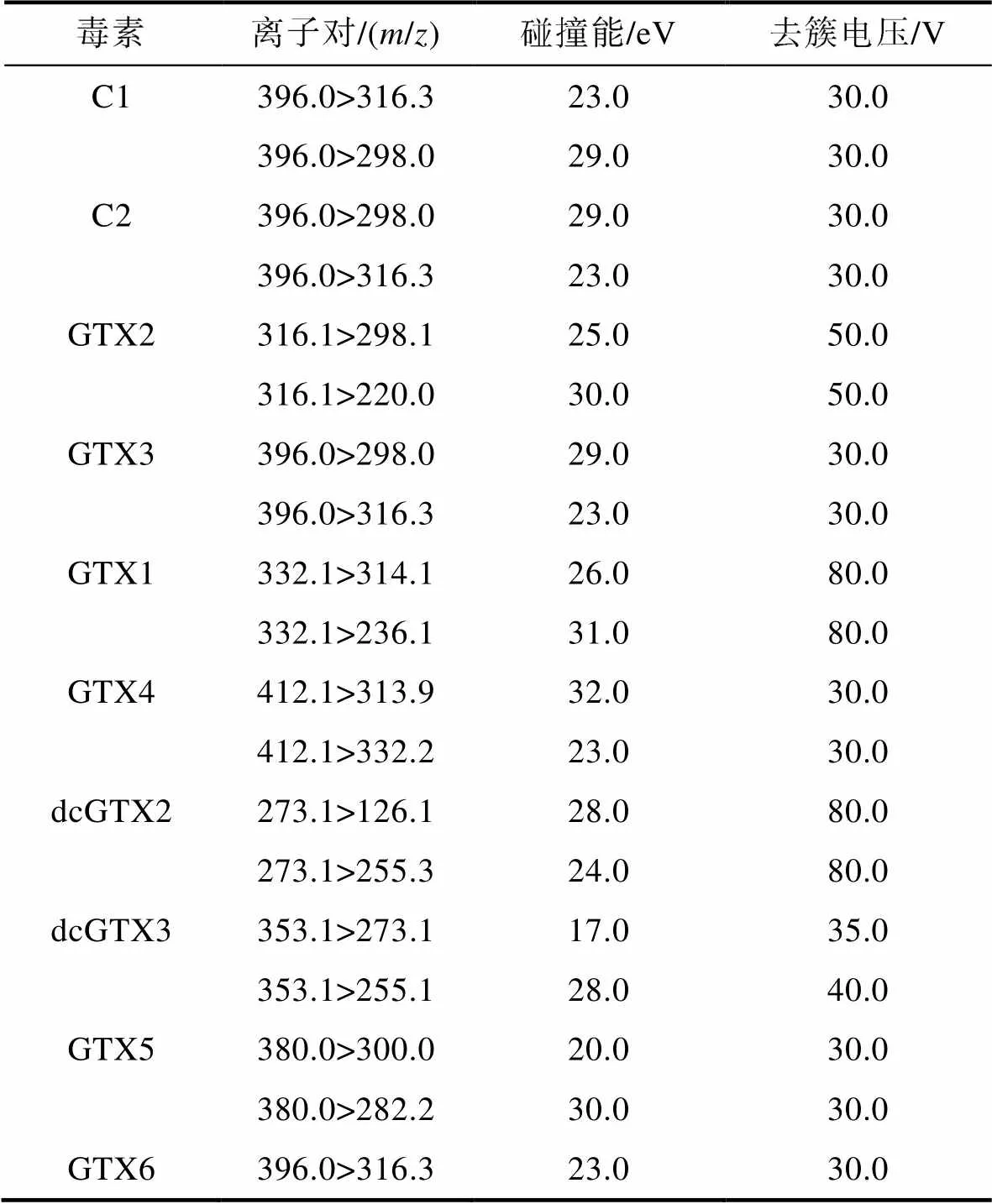
Tab.3 Mass spectrometry detection parameters of paralytic shellfish toxins

续表
2 结果
2.1 太平洋亚历山大藻与链状裸甲藻产毒情况
本研究中太平洋亚历山大藻产生的麻痹性贝毒主要包括GTX1&4、GTX5和C1&2等, 毒素比例从高到低依次为GTX4 (45.6%)、GTX1 (24.3%)、C1 (17.7%)、C2 (7.8%)和GTX5 (4.5%)(图2a)。毒素含量约8.38 fmol/cell。链状裸甲藻产生的水溶性毒素成分主要为GTX5、GTX6、C1、C2、C3、C4, 以及微量的dcSTX和dcGTX2&3, 约占毒素总量的59%; 脂溶性的GC毒素主要包括GC2、GC3、GC5和GC6以及微量的GC1(图2b), 约占毒素总量的41%。各种水溶性毒素的比例从高到低依次为GTX6 (37.58%)、C2 (12.63%)、C4 (5.90%)、GTX5 (1.66%)、C1 (0.82%)、C3 (0.16%)、dcSTX (0.08%)和dcGTX2&3 (0.02%); 而GC毒素比例由高到低依次为GC5 (27.38%)、GC6 (6.38%)、GC3 (5.24%)和GC2 (2.16%), GC1毒素含量低于定量限。经统计计算, 该株藻种麻痹性贝毒的含量约为456 fmol/cell。
2.2 毛蚶摄食太平洋亚历山大藻后体内麻痹性贝毒变化情况
投喂亚历山大藻前, 毛蚶体内未检出麻痹性贝毒。投喂8 h内毛蚶已几乎完全滤食藻细胞, 12 h后水体内无剩余藻细胞。在投喂后第1 h内毛蚶体内即检测到麻痹性贝毒, 含量为0.03 nmol/g。毒素含量在1~12 h内逐渐增加, 至12 h时达到峰值1.41 nmol/g (图3a)。在此期间, 毛蚶毒性也逐步上升, 并在12 h达到最高值111 μg STXeq/kg。计算结果表明, 毛蚶几乎将投喂的太平洋亚历山大藻中全部毒素都摄入体内。此后, 毛蚶开始排出毒素, 毒素含量逐渐下降, 毒性也相应下降, 至48 h毒性下降到44 μg STXeq/kg。实验过程中毛蚶的毒性变化与其体内毒素含量变化基本一致。

图2 太平洋亚历山大藻(a)与链状裸甲藻(b)产毒状况

图3 毛蚶摄食太平洋亚历山大藻(a)和链状裸甲藻(b)后体内毒素含量与毒性变化情况
实验期间毛蚶体内共检测到4种麻痹性贝毒, 分别是GTX2、GTX3、C1、C2。其中GTX2、GTX3在亚历山大藻中未检出, 而亚历山大藻中的GTX1、GTX4和GTX5在毛蚶中未检出。毛蚶中最主要的毒素成分是C1和GTX2, C2和GTX3占比较低。实验期间毛蚶体内C1占比逐渐下降, 而GTX2占比逐渐上升(图4a)。
2.3 毛蚶摄食链状裸甲藻后体内麻痹性贝毒变化情况
投喂链状裸甲藻前, 毛蚶体内未检出麻痹性贝毒。投喂链状裸甲藻12 h内, 毛蚶几乎完全滤食链状裸甲藻细胞。利用液-质联用法检测毛蚶体内麻痹性贝毒的谱图见图5。毛蚶暴露于链状裸甲藻中2 h后体内即可检出麻痹性贝毒, 暴露后前4 h毛蚶体内毒素保持快速增加, 达到2.91 nmol/g, 毛蚶毒性达到149 µg STXeq/kg(图3b)。此后毛蚶体内毒素总量虽然保持上升趋势, 但上升速率明显降低, 第24 h毒素含量达到最高水平3.18 nmol/g, 毒性也达到峰值207 µg STXeq/kg。据估算, 毛蚶未能将投喂的链状裸甲藻中全部毒素摄入体内, 累积毒素总量约占链状裸甲藻中毒素总量的24%。自24 h后, 毛蚶开始排出毒素, 体内毒素总量逐渐下降。
在摄入链状裸甲藻后, 毛蚶体内检出的水溶性麻痹性贝毒成分主要包括GTX5、GTX6、dcSTX、STX、C1&2、C3&4、GTX2&3和dcGTX2&3, 其中GTX2&3和STX在链状裸甲藻中未检出。毒素累积阶段, 毛蚶体内GTX6占比最高, 且逐渐增加; 其次是dcSTX和GTX5(图4b), dcSTX和dcGTX2&3占比也明显高于链状裸甲藻。在毒素排出阶段, dcSTX逐渐成为毛蚶体内主要的水溶性毒素组分, 最高占比达到34%, 而GTX6所占比例逐渐下降。在链状裸甲藻产生的麻痹性贝毒中, dcSTX所占比例极小, 但在毛蚶体内逐渐成为最主要的毒素成分。毛蚶体内的C1&2、C3&4、dcGTX2&3、GTX2&3和STX毒素含量较低, 占毒素总量的比例也较小。对脂溶性麻痹性贝毒的分析结果表明, 实验过程中毛蚶体内GC毒素占比略低于链状裸甲藻。实验开始后4 h内, 毛蚶体内GC毒素含量逐渐增加, GC2是主要的脂溶性麻痹性贝毒成分, GC3含量略低于GC2(图4b)。4 h后, GC毒素总量逐渐下降, GC3开始成为主要的毒素成分, 其次是GC2、GC5和GC6则含量较低。

图4 毛蚶摄食太平洋亚历山大藻(a)和链状裸甲藻(b)后体内麻痹性贝毒占比变化情况

图5 利用液-质联用法分析毛蚶体内麻痹性贝毒的色谱图
注: a: 水溶性麻痹性贝毒标准品色谱图; b: 毛蚶样品中水溶性麻痹性贝毒色谱图; c: 毛蚶样品中GC毒素色谱图
3 讨论
毛蚶是我国近海常见的贝类, 具有较高的经济价值(陈辰, 2015)。本研究发现, 毛蚶在暴露于产毒藻后, 会快速累积麻痹性贝毒, 具备一定的毒素累积能力。在产毒藻赤潮期间, 毛蚶有可能通过摄食产毒藻而蓄积高含量的麻痹性贝毒, 对消费者健康乃至生命安全造成威胁。因此, 对毛蚶体内麻痹性贝毒转化过程与规律的探究对于深入了解麻痹性贝毒风险、保护海产品消费者健康具有重要意义。目前, 针对贝类体内麻痹性贝毒的累积、转化和排出过程已开展了大量研究, 揭示了贻贝、扇贝、牡蛎等诸多贝类中麻痹性贝毒的转化过程和规律(Choi, 2003; Kwong, 2006; Wiese, 2010)。本研究选择了太平洋亚历山大藻和链状裸甲藻作为产毒藻种, 前者主要产生-磺酰氨甲酰基类毒素和氨基甲酸酯类毒素, 后者主要产生-磺酰氨甲酰基类毒素和脂溶性的GC毒素, 二者毒素组成存在一定的互补性, 通过对比分析毛蚶暴露于上述两种产毒藻后体内麻痹性贝毒含量和组成的变化, 对毛蚶转化麻痹性贝毒的过程进行了研究和分析。
3.1 R1位点羟基还原反应
毛蚶暴露于太平洋亚历山大藻后, 体内出现了较多的GTX2&3, 这在投喂的太平洋亚历山大藻中没有检测到; 而太平洋亚历山大藻产生的GTX1&4, 在毛蚶中却未被检出。说明在毛蚶体内发生了麻痹性贝毒的转化。毛蚶体内出现的GTX2&3可能是由GTX1&4通过R1位点的羟基还原反应产生, 这一反应目前也已在扇贝、贻贝等多种贝类中被确认(Shimizu, 1981; Andres, 2019)。本研究发现, 暴露于太平洋亚历山大藻后, 毛蚶体内未检测到GTX1&4, 这可能由于贝类对不同毒素的选择性排出(DeGrasse, 2014; Tobke, 2021)造成的。然而, 实验结果表明, 暴露于太平洋亚历山大藻的毛蚶体内毒素总量与投喂的亚历山大藻中毒素总量基本相当, 表明实验期间毛蚶对毒素的选择性排出过程可以忽略。由此推测, 毛蚶中的GTX1&4主要通过羟基还原过程生成了GTX2&3。在向毛蚶投喂太平洋亚历山大藻的实验中, 所有取样阶段均未在毛蚶体内检测到GTX1&4, 表明毛蚶中R1位点羟基的还原反应具有较高的反应速率。在部分贝类中, 当存在谷胱甘肽等还原剂时, R1位点羟基还原反应还可能伴有R2和R3位点磺酸基团的还原(Bricelj, 1998362; 朱明远等, 2003)。本研究发现, 毛蚶在暴露于太平洋亚历山大藻时, GTX2&3产生后并未出现STX, 推测毛蚶体内麻痹性贝毒的还原反应具有一定的位点特异性。
对比分析实验结果推测, R1位点的羟基还原反应与毛蚶摄入链状裸甲藻后STX的产生也有一定关系。STX的产生源自GTX5 R4位点的磺酸基水解过程。本实验中使用的太平洋亚历山大藻和链状裸甲藻均能产生少量GTX5, 但毛蚶在摄入链状裸甲藻后体内出现STX, 而摄入太平洋亚历山大藻后却未检测到STX, 推测链状裸甲藻中高含量的GTX6在毛蚶体内发生R1位点羟基的还原反应, 持续转化生成GTX5并进一步通过水解反应产生了可检测到的STX。而太平洋亚历山大藻中GTX5含量较少, 即便发生了转化, STX含量也不足以被检测。
3.2 R4位点磺酸基和羟基苯甲酸基团的水解反应
根据以往研究, 毛蚶体内出现的GTX2&3还可能源自C1&2 R4位磺酸基的水解过程, 这一过程也在多种贝类中被证实。Asakawa等(1995)研究认为, 紫贻贝和牡蛎中可能存在C1&2水解转化为GTX2&3的过程, Choi等(2003)933发现在翡翠贻贝消化腺中也存在类似过程, 邴晓菲等(2017)也证实了栉孔扇贝中同样存在此类毒素转化过程。将毛蚶摄食太平洋亚历山大藻和链状裸甲藻后体内毒素成分的变化情况进行对比发现, 在摄入同样产C1&2但不产生GTX1&4的链状裸甲藻后, 毛蚶体内也出现了GTX2&3, 而链状裸甲藻中的其他麻痹性贝毒都无法直接转化为GTX2&3, 这说明毛蚶中的GTX2&3可以来自C1&2的水解。
在暴露于链状裸甲藻的毛蚶体内检测到藻中含量极低的脱氨甲酰基类毒素dcGTX2&3与dcSTX, 表明链状裸甲藻产生的某些毒素在毛蚶体内发生了转化, 生成了脱氨甲酰基类毒素。毛蚶在摄入太平洋亚历山大藻后, 体内并未检测到任何脱氨甲酰基类毒素, 侧面反映了太平洋亚历山大藻产生中的C1&2, GTX1&4等毒素成分不会在毛蚶体内转化生成脱氨甲酰基类毒素。毛蚶摄入链状裸甲藻后体内出现的脱氨甲酰基类毒素只可能来自链状裸甲藻中的独特的GC毒素。Vale(2008)1已通过研究指出, GC毒素可以通过R4位羟基苯甲酸基团的水解反应, 生成相应的脱氨甲酰基类毒素。因此, 毛蚶体内的脱氨甲酰基类毒素最有可能来自GC毒素的水解反应, 如GC1&2转化生成dcGTX2&3, GC3转化生成dcSTX。毛蚶摄入太平洋亚历山大藻后未产生脱氨甲酰基类毒素, 说明此类水解反应具有一定的特异性, 仅对R4位点为羟基苯甲酸基团的GC毒素有作用。本研究中未在毛蚶体内检测到GC4&5和GC6的水解产物dcGTX1&4和dcNEO, 其中, dcGTX1&4并未被纳入本研究的检测范围, 无法证明GC4&5的水解反应是否发生; 而本研究对dcNEO的检测限相对较高, 对dcNEO的检测具有一定局限性。因此, 目前仍无法确证毛蚶体内是否存在GC4&5和GC6的水解转化过程。本研究中使用的链状裸甲藻GC5占比很高, 而毛蚶体内GC5占比明显下降, 说明GC5很可能在毛蚶体内发生了转化。毛蚶中GC2占比的明显增加, 说明GC5极有可能通过R1位点羟基还原反应生成了相应的GC2。这些转化过程仍有待于更深入的研究进行确证。
3.3 毛蚶体内毒素转化过程与其他贝类的差异
本研究发现, 毛蚶体内主要存在三类麻痹性贝毒的转化反应过程, 分别是R1位点羟基还原反应、R4位点磺酸基团的水解反应和R4位点羟基苯甲酸基团的水解反应(图6)。但是, 也有以往报道过的麻痹性贝毒转化过程在此次实验并未发现。首先是麻痹性贝毒空间异构体的差向异构化反应。在产毒藻种中, 通常型毒素占比更高, 而在贝类中麻痹性贝毒会通过差向异构化生成更为稳定的型毒素(Asakawa, 2006), 最后达到:=3:1的比例(Bricelj, 1998359; 柳阳, 201792)。本次实验中没有观察到明显的差向异构化反应, 可能与实验时间较短、差向异构化反应速率较慢有关。但研究中也发现, 链状裸甲藻中型的GC1的含量很低, 占比远低于其型同分异构体GC2; 而在毛蚶体内, 由GC1转化而来的dcGTX2占比却高于由GC2转化而来的dcGTX3。这说明在GC1&2发生羟基苯甲酸基团水解反应的同时, 也出现了差向异构化反应。但目前无法确定毒素的差向异构化反应与水解反应时间的先后, 仍有待于进一步研究。

图6 毛蚶体内可能发生的各类毒素转化过程
注: 虚线箭头表示该反应为理论上可能发生的过程
此外, 本研究也未在毛蚶体内发现-磺酰氨甲酰基类毒素或氨基甲酸酯类毒素水解生成脱氨甲酰基类毒素的酶促转化过程(Raposo, 2020)4。Samsur等(2006)在锦蛤()中发现C1&2可以被转化生成dcGTX2&3。在象拔蚌()中也发现C1&2转化为GTX5后水解生成dcSTX的转化反应(Medina-Elizalde, 2018)。毛蚶在摄入产C1&2的太平洋亚历山大藻后, 体内未检测到脱氨甲酰基类毒素, 说明毛蚶中可能缺乏磺氨甲酰基水解酶, 难以促成-磺酰氨甲酰基的水解反应。同样, 在多种贝类中发现的氨基甲酸酯类毒素转化生成相应的脱氨甲酰基类毒素的转化过程, 也是一种典型的酶促水解反应。在中国飞蛤()中分离出了能够转化氨基甲酸酯类毒素为脱氨甲酰基类毒素的氨甲酰基水解酶(Lin, 2004)。在本研究中, 毛蚶摄入太平洋亚历山大藻后体内并未检测到脱氨甲酰基类毒素, 说明了毛蚶中也可能缺乏氨甲酰基水解酶, 无法催化进行此类转化反应。综上, 毛蚶中可能缺少催化-磺酰氨甲酰基或氨甲酰基水解的酶类, 但是存在能够催化羟基苯甲酸基团水解反应的酶。
3.4 毒素转化过程对毛蚶毒性的影响
毛蚶体内发生的麻痹性贝毒转化过程可能会显著影响毛蚶的毒性。本研究发现毛蚶体内麻痹性贝毒转化过程主要包括R1位点羟基还原反应、R4位点磺酸基团水解反应和R4位点羟基苯甲酸基团水解反应。R1位点羟基还原反应对毛蚶的毒性可能有重要影响。一般来说, R1位点为羟基的麻痹性贝毒组分毒性高于对应的R1位点为氢的麻痹性贝毒组分(Leal, 2022)21, 因此, 毛蚶体内的R1位点羟基还原反应会导致毒性降低。同样, R4位点的水解反应也会显著改变毛蚶体内毒素组成, 从而影响其毒性。在麻痹性贝毒中,-磺酰氨甲酰基类毒素与钠离子通道的结合能力最差, 毒性也相对最低; 而氨基甲酸酯类毒素则是毒性最高的毒素, 脱氨甲酰基类毒素的毒性位于两者之间。-磺酰氨甲酰基类毒素通过水解反应生成相应的氨基甲酸酯类毒素, 会导致贝类毒性的显著上升。目前, 对于毛蚶中GC毒素的水解反应, 仍难以判断其对毛蚶毒性的影响。此外, M毒素是贝类摄食麻痹性贝毒产毒藻后的重要代谢物, 毒性水平较低, 有助于其快速脱毒(Vale, 2010; Ding, 2017)。本研究聚焦于各类型麻痹性贝毒的转化过程, 并未分析该类代谢物, 需要在后续研究中予以关注。总体而言, 毛蚶体内的麻痹性贝毒转化过程较为复杂, 对毒性的影响需要结合产毒藻的毒素种类进行具体分析。为防范毛蚶带来的麻痹性贝毒中毒风险, 仍需加强对毛蚶体内麻痹性贝毒的监测, 避免造成中毒事件。
4 结论
本研究通过选择典型产毒藻种开展模拟实验, 揭示了毛蚶体内麻痹性贝毒的三类主要转化过程, 包括R1位点羟基的还原反应、R4位点磺酸基团的水解反应, 以及R4位点羟基苯甲酸基团的水解反应, 推测毛蚶体内缺少可催化-磺酰氨甲酰基类毒素和氨基甲酸酯类毒素水解过程的酶。这些发现说明毛蚶对麻痹性贝毒的转化反应较为多样化, 且有一定的独特性, 可能导致毛蚶体内毒素组成与产毒藻种或其他贝类存在差异, 需要加强对毛蚶体内麻痹性贝毒的监测和研究。
于仁成, 罗璇, 2016. 我国近海有毒藻和藻毒素的研究现状与展望[J]. 海洋科学集刊(1): 155-166.
田华, 2009. 麻痹性贝毒的累积、转化、排出过程及预警诊断指标研究[D]. 青岛: 中国海洋大学: 18.
包振民, 孔令玲, 史姣霞, 等, 2021. 双壳贝类积累转化麻痹性贝毒的研究进展[J]. 中国海洋大学学报, 51(10): 1-11.
朱明远, 邹迎麟, 吴荣军, 等, 2003. 栉孔扇贝体内麻痹性贝毒的累积与排出过程研究[J]. 海洋学报, 25(2): 75-83.
邴晓菲, 吴海燕, 王群, 等, 2017. 麻痹性贝类毒素在栉孔扇贝体内的代谢轮廓[J]. 中国水产科学, 24(3): 623-632.
张福崇, 宋学章, 石延港, 等, 2020. 毛蚶池塘养殖技术研究[J]. 科学养鱼(12): 61-62.
陈火荣, 2018. 2017年福建海域链状裸甲藻赤潮事件应急处置与思考[J]. 渔业研究, 40(4): 308-314.
陈辰, 2015. 毛蚶群体遗传学研究[D]. 青岛: 中国海洋大学: 22-24.
林燕棠, 贾晓平, 杨美兰, 等, 1999. 中国沿岸染毒贝类的麻痹性毒素[J]. 热带海洋, 18(1): 90-96.
柳阳, 2017. 我国近海藻毒素污染状况研究与毒素标准物质制备[D]. 青岛: 中国科学院大学: 37-42, 70, 92.
ANDRES J K, YÑIGUEZ A T, MAISTER J M,, 2019. Paralytic shellfish toxin uptake, assimilation, depuration, and transformation in the southeast Asian green-lipped mussel () [J]. Toxins (Basel), 11(8): 468.
ASAKAWA M, BEPPU R, ITO K,, 2006. Accumulation of paralytic shellfish poison (PSP) and biotransformation of its components in oystersfed with the toxic dinoflagellate[J]. Food Hygiene and Safety Science (Shokuhin Eiseigaku Zasshi), 47(1): 28-32.
ASAKAWA M, MIYAZAWA K, TAKAYAMA H,, 1995. Dinoflagellateas the source of paralytic shellfish poison (PSP) contained in bivalves from Hiroshima Bay, Hiroshima Prefecture, Japan [J]. Toxicon, 33(5): 691-697.
BOTELHO M J, MARQUES F, FREITAS R,, 2020. Paralytic shellfish toxin profiles in mussel, cockle and razor shell under post-bloom natural conditions: evidence of higher biotransformation in razor shells and cockles [J]. Marine Environmental Research, 154: 104839.
BRICELJ V M, SHUMWAY S E, 1998. Paralytic shellfish toxins in bivalve molluscs: occurrence, transfer kinetics, and biotransformation [J]. Reviews in Fisheries Science, 6(4): 315-383.
CHOI M C, HSIEH D P H, LAM P K S,, 2003. Field depuration and biotransformation of paralytic shellfish toxins in scallopand green-lipped mussel[J]. Marine Biology, 143(5): 927-934.
COSTA P R, ROBERTSON A, QUILLIAM M A, 2015. Toxin profile of(Dinophyceae) from the Portuguese coast, as determined by liquid chromatography tandem mass spectrometry [J]. Marine Drugs, 13(4): 2046-2062.
DEGRASSE S, VANEGAS C, CONRAD S, 2014. Paralytic shellfish toxins in the sea scallopon Georges Bank: implications for an offshore roe-on and whole scallop fishery [J]. Deep Sea Research Part II: Topical Studies in Oceanography, 103: 301-307.
DELL’AVERSANO C, WALTER J A, BURTON I W,, 2008. Isolation and structure elucidation of new and unusual saxitoxin analogues from mussels [J]. Journal of Natural Products, 71(9): 1518-1523.
DING L, QIU J B, LI A F,, 2017. Proposed biotransformation pathways for new metabolites of paralytic shellfish toxins based on field and experimental mussel samples [J]. Journal of Agricultural and Food Chemistry, 65(27): 5494-5502.
GUILLARD R R L, HARGRAVES P E, 1993.is a diatom, not a chrysophyte [J]. Phycologia, 32(3): 234-236.
JAIME E, GERDTS G, LUCKAS B, 2007. In vitro transformation of PSP toxins by different shellfish tissues [J]. Harmful Algae, 6(3): 308-316.
KAO C Y, NISHIYAMA A, 1965. Actions of saxitoxin on peripheral neuromuscular systems [J]. The Journal of Physiology, 180(1): 50-66.
KWONG R W M, WANG W X, LAM P K S,, 2006. The uptake, distribution and elimination of paralytic shellfish toxins in mussels and fish exposed to toxic dinoflagellates [J]. Aquatic Toxicology, 80(1): 82-91.
LEAL J F, CRISTIANO M L S, 2022. Marine paralytic shellfish toxins: chemical properties, mode of action, newer analogues, and structure-toxicity relationship [J]. Natural Product Reports, 39(1): 33-57.
LI A, MA J, CAO J,, 2012. Analysis of paralytic shellfish toxins and their metabolites in shellfish from the North Yellow Sea of China [J]. Food Additives & Contaminants: Part A, 29(9): 1455-1464.
LIN H P, CHO Y, YASHIRO H,, 2004. Purification and characterization of paralytic shellfish toxin transforming enzyme from[J]. Toxicon, 44(6): 657-668.
LIN Z R, GENG H X, ZHANG Q C,, 2022. Toxin production of dinoflagellateisolated from the East China Sea [J]. Harmful Algae, 113: 102188.
LLEWELLYN L, NEGRI A, QUILLIAM M, 2004. High affinity for the rat brain sodium channel of newly discovered hydroxybenzoate saxitoxin analogues from the dinoflagellate[J]. Toxicon, 43(1): 101-104.
MEDINA-ELIZALDE J, GARCÍA-MENDOZA E, TURNER A D,, 2018. Transformation and depuration of paralytic shellfish toxins in the geoduck clamfrom the Northern Gulf of California [J]. Frontiers in Marine Science, 5: 335.
NEGRI A, STIRLING D, QUILLIAM M,, 2003. Three novel hydroxybenzoate saxitoxin analogues isolated from the dinoflagellate[J]. Chemical Research in Toxicology, 16(8): 1029-1033.
RAPOSO M I C, GOMES M T S R, BOTELHO M J,, 2020. Paralytic shellfish toxins (PST)-transforming enzymes: a review [J]. Toxins (Basel), 12(5): 344.
RITCHIE J M, ROGART R B, 1977. The binding of saxitoxin and tetrodotoxin to excitable tissue [J]. Reviews of Physiology, Biochemistry and Pharmacology, 79: 1-50.
SAMSUR M, YAMAGUCHI Y, SAGARA T,, 2006. Accumulation and depuration profiles of PSP toxins in the short-necked clamfed with the toxic dinoflagellate[J]. Toxicon, 48(3): 323-330.
SHIMIZU Y, YOSHIOKA M, 1981. Transformation of paralytic shellfish toxins as demonstrated in scallop homogenates [J]. Science, 212(4494): 547-549.
SUZUKI T, YAMASAKI M, OTA H, 1998. Comparison of paralytic shellfish toxin profiles between the scallopand the mussel[J]. Fisheries Science, 64(5): 850-851.
TOBKE J, GIARRATANO E, ORTIZ A,, 2021. Chitosan performance during Paralytic Shellfish Toxins (PST) depuration ofexposed to[J]. Toxicon, 195: 48-57.
VALE P, 2008. Fate of benzoate paralytic shellfish poisoning toxins fromin shellfish and fish detected by pre-column oxidation and liquid chromatography with fluorescence detection [J]. Journal of Chromatography A, 1190(1/2): 191-197.
VALE P, 2010. Metabolites of saxitoxin analogues in bivalves contaminated by[J]. Toxicon, 55(1): 162-165.
WIESE M, D’AGOSTINO P M, MIHALI T K,, 2010. Neurotoxic alkaloids: saxitoxin and its analogs [J]. Marine Drugs, 8(7): 2185-2211.
BIOTRANSFORMATION OF PARALYTIC SHELLFISH TOXINS IN BLOOD CLAM
LIN Zhuo-Ru1, 3, GENG Hui-Xia1, TANG Wen-Jiao1, 5, YU Ren-Cheng1, 2, 3, 4
(1. CAS Key Laboratory of Marine Ecology and Environmental Sciences, Institute of Oceanology, Chinese Academy of Sciences, Qingdao 266071, China; 2. Laboratory for Marine Ecology and Environmental Science, Pilot National Laboratory for Marine Science and Technology (Qingdao), Qingdao 266071, China; 3. University of Chinese Academy of Sciences, Beijing 100049, China; 4. Center for Ocean Mega-Science, Chinese Academy of Sciences, Qingdao 266071, China; 5. College of Marine Life Science, Ocean University of China, Qingdao 266003, China)
The accumulation of paralytic shellfish toxins in marine bivalves pose severe threats to human health.may contain high concentrations of paralytic shellfish toxins, yet toxin biotransformation in.and its effect on the toxicity of the bivalve remain largely unknown. Therefore, biotransformation of paralytic shellfish toxins in.were investigated by feeding.with two toxin-producing dinoflagellates,and. Reduction of hydroxyl at R1, hydrolysis of sulfocarbamoyl group at R4 in-sulfocarbamoyl toxins, and hydrolysis of hydroxybenzoate group at R4 intoxins are the main biotransformation processes in.. The complex biotransformation of paralytic shellfish toxins in.contributes to the uncertainty of toxicity. To reduce risks associated with paralytic shellfish poisoning, further investigations on accumulation, transformation, and elimination of paralytic shellfish toxins in.should be carried out, and more efforts are needed to monitor toxins in..
paralytic shellfish toxins;;;;toxins; toxin biotransformation
X174
10.11693/hyhz20220100024
*国家重点研发计划, 2017YFC1600701号; 科技基础资源调查专项, 2018FY100202号; 国家自然科学基金委员会联合基金项目, U20A20104号。林卓如, 博士研究生, E-mail: linzhuoru@qdio.ac.cn
于仁成, 博士生导师, 研究员, E-mail: rcyu@qdio.ac.cn
2022-01-26,
2022-03-21
