Nrf2调控小胶质细胞功能转化在脑出血后血肿清除中的作用机制*
2022-09-21包霜谨刘丽荣要振佳柏琴琴梁春甜符鹏程刘祥玉王改青
包霜谨,刘丽荣,要振佳,柏琴琴,梁春甜,符鹏程,刘祥玉,王改青
[1.山西医科大学基础医学院,山西太原 030001;2.山西医科大学第二临床医学院神经内科,山西太原 030001;3.深圳龙华区中心医院神经内科,广东深圳 518110;4.海南医学院附属三亚中心医院神经内科,海南三亚572000]
脑出血的发病率和病死率高,血肿及其降解产物是导致脑出血预后不良的主要原因[1]。研究[2]表明,小胶质细胞可通过调节炎症反应参与脑出血后的血肿清除。脑出血后激活的小胶质细胞分为促炎和抗炎两种状态[3]。促炎表型以产生肿瘤坏死因子(tumor necrosis factor-α, TNF-α)、白细胞介素-1β(Interleukin-1β,IL-1β)、CD80、CD86 等为特征,诱导神经细胞死亡,促进神经炎症。而白细胞介素-4(Interleukin-4, IL-4)、白细胞介素-10(Interleukin-10, IL-10)、脑源性神经营养因子(brain-derived neurotrophic factor, BDNF)和CD206 等抗炎分子的分泌代表小胶质细胞的吞噬功能,可减轻炎症,促进神经功能的修复[4]。除此之外,髓样细胞上表达的I型受体(recombinant human triggering receptor expressed on myeloid cells 1, Trem1)是小胶质细胞重要的炎症放大因子[5-6],而髓样细胞上表达的Ⅱ型受体(recombinant human triggering receptor expressed on myeloid cells 2, Trem2)具有吞噬、抗炎和神经保护作用[7-8]。 核因子红系相关因子2(nuclear factor erythroid-2-related factor 2, Nrf2)和过氧化物酶体增殖物激活受体γ(peroxisome proliferator-activated receptor γ, PPARγ)作为调节因子在清除内源性血肿中的作用引起了广泛的关注[1]。本团队前期研究证实了Nrf2 激动剂红曲素能促进脑出血后血肿的清除并发挥神经保护作用[9-10],并且发现通过抑制Trem1可改善蛛网膜下腔出血患者的神经功能缺损和脑水肿[11]。Nrf2 是否通过影响小胶质细胞的功能转化发挥血肿清除的作用目前尚不明确。本研究通过探讨Nrf2 对小胶质细胞功能的影响,进一步从细胞水平探究脑出血后Nrf2 在血肿清除中的作用机制。
1 材料与方法
1.1 实验动物
动物实验严格遵守山西医科大学伦理委员会的各项规定。雄性C57BL/6 小鼠34 只,4~5 周龄,体重(20±2)g,购自山西医科大学动物中心[实验动物生产许可证号:SCXK(晋)2019-004,实验动物使用许可证号:SYXK(晋)2019-007]。雄性Nrf2 基因敲除小鼠(Nrf2 knockout mice, Nrf2-/-)C57BL/6 小鼠8 只,4~5 周龄,体重(20±1)g,购自Cyagen模型生物学研究中心(太仓)有限公司(中国苏州)[实验动物生产许可证号:SCXK(苏)2018-003,实验动物使用许可证号:SYXK(苏)2018-005]。均在适宜的湿度及温度条件下饲养,保证自由饮水及摄食。
1.2 药物、试剂及仪器
赛拉嗪(上海麦克林生化科技有限公司,规格:1 g),氯胺酮(福建古田药业有限公司,规格:1 g),Ⅳ型胶原酶(上海索莱宝生物科技有限公司),红曲素(上海子起生物科技有限公司,产品批号:55WXQ-XC60,规格:1 g),血脂康(北大维信公司,国药准字:Z10950029,规格:1 g)。生理盐水(江西科达卫生用品有限公司),磷酸盐缓冲液(PBS)、RIPA 缓冲液、牛血清白蛋白、BCA 试剂盒、SDS 聚丙烯酰胺凝胶(武汉博士德生物工程有限公司),文齐式液(上海信帆生物科技有限公司),4%多聚甲醛(上海源叶生物有限公司),蔗糖缓冲液(PBS配置,天津科密欧化学试剂有限公司),仓鼠抗CD80、兔抗CD206、山羊抗小胶质细胞/巨噬细胞特异性蛋白(ionized calcium binding adaptor molecule 1,Iba1)、兔抗Nrf2、大鼠抗Trem2、兔抗Trem1、兔抗TNF-α、兔抗BDNF、β-actin(美国Abcam 公司),异硫氰酸荧光素(fluorescein isothiocyanate, FITC)标记兔抗山羊免疫球蛋白G(Immunoglobulin G, IgG)、CY3-兔抗大鼠IgG(H+L)(武汉博士德生物工程有限公司),山羊抗兔IgG(Alexa Fluor 647)、山羊抗仓鼠IgG H&L(FITC)(美国Abcam 公司),含4,6-二氨基-2-苯基吲哚(4,6-diamino-2-phenyl indole, DAPI)的防淬灭封片剂、ECL 发光液(上海索莱宝生物科技有限公司),聚偏氟乙烯膜(美国Millipore 公司)。立体定位仪、颅骨钻(北京众实迪创科技发展有限责任公司),微量注射器(上海高鸽工贸有限公司),骨蜡(上海强生医疗器材有限公司),分光光度计(上海美谱达仪器有限公司),冷冻切片机(德国Leica 公司),烘箱(上海合恒仪器设备有限公司),TS2R 荧光显微镜(日本尼康公司),摇床(上海赫田科学仪器有限公司)。
1.3 模型复制
腹腔注射赛拉嗪10 mg/kg 和氯胺酮100 mg/kg麻醉小鼠,以俯卧位固定于立体定位仪,对实验区域的皮肤进行消毒、备皮后,沿头皮正中做一纵行切口,剔除骨膜,暴露前囟,通过坐标(前囟后0.9 mm,中线外侧1.5 mm,深度3.5 mm)定位小鼠右侧基底节区,用颅骨钻做一孔径约1 mm 的小孔,采用微量注射器抽取0.3 u Ⅳ型胶原酶注射至小鼠的右侧基底节区,然后固定于立体定位仪上,调节定位仪使其针头经小孔进针3.5 mm,针头在此位置保持15 min 不动,然后退针,用骨蜡封闭小孔,最后缝皮。
1.4 神经功能评估
待模型小鼠清醒后,采用改良Garcia 评分评估神经功能[12-13]。修改后的量表包含6 项独立测试,分别是自主运动、体态对称性、前肢伸展运动、抓持和攀爬铁笼的能力、两侧身体触觉反射及两侧胡须碰触反应。每项测试0~3 分,总分18 分,分数越高,神经功能缺损的程度越重。
1.5 分组
随机将C57BL/6 小鼠分为对照组(n=8)、脑出血组(n=9)、脑出血+红曲素组(n=8)、脑出血+血脂康组(n=9);Nrf2-/-C57BL/6 小鼠为脑出血+Nrf2-/-组(n=8)。对照组以生理盐水代替Ⅳ型胶原酶完成手术,术后给予生理盐水灌胃,1 次/d;脑出血组术后给予生理盐水灌胃1 次/d;脑出血+红曲素组术后给予红曲素10 mg/(kg·d),2 次/d;脑出血+血脂康组术后给予血脂康0.2 g/(kg·d),2 次/d;脑出血+Nrf2-/-组术后给予生理盐水灌胃,1 次/d。脑出血+血脂康组和脑出血+红曲素组小鼠在术后6 h 灌胃给药,直至实验设定的时间点。本实验中采用的给药途径、方法及取脑的时间点选择均基于本课题组的前期研究;前期本课题组观察Nrf2 的时间点,已表明在脑出血后的72 h,血肿周围的血红蛋白含量、脑水含量及水肿体积均达到峰值,神经功能缺损严重,10 mg/(kg·d)红曲素组的Nrf2 阳性细胞最多[10,12-13]。本研究在前期研究基础上,选择脑出血后的72 h 作为时间点,探究Nrf2 在脑出血后血肿清除中的作用机制。
1.6 血红蛋白水平测定
腹腔麻醉后打开小鼠的胸腔,用预冷的PBS 进行心脏灌注,待流出的液体清亮时停止灌注。断头取脑,于-80℃储存脑组织。取血肿周围的脑组织于1 100 μL PBS 中匀浆,4℃15 000 r/min 离心30 min 并收集上清液。按上清液∶文齐式液为1∶4比例混匀,室温反应5 min 后,在分光光度计上测定540 nm 波长处的吸光度值。根据吸光度计算血红蛋白水平,各组测定值的均值/手术对照组测定值的均值代表各组的平均血肿量。
1.7 免疫荧光检测
小鼠深度麻醉后,经心脏灌注PBS 和4%多聚甲醛。断头取脑组织,标本浸泡在4%多聚甲醛中4℃过夜,隔日分别用20%、30%的蔗糖缓冲液4°C下脱水,直至组织完全渗透。采用冷冻切片机冠状切片标本,厚度4 μm。将冷冻切片放至50°C 烘箱1 h 固定后,PBS 漂洗3 次,每次5 min,以1%的牛血清白蛋白封闭。封闭结束后分别按照以下比例进行一抗的过夜孵育:仓鼠抗CD80(1:200)/兔抗CD206(1∶200)、山羊抗Iba1(1∶200)/兔抗Nrf2(1∶100)、大鼠抗Trem2(1∶200)/ 山羊抗Iba1(1∶200)和兔抗Trem1(1∶100)/山羊抗Iba1(Iba1 1∶200),PBS 漂洗后,避光条件下进行荧光二抗的孵育:FITC 标记兔抗山羊IgG(1∶500),山羊抗兔IgG(Alexa Fluor 647)(1∶300),山羊抗仓鼠IgG H&L(FITC)(1∶600),CY3-兔抗大鼠IgG(H+L)(1∶500)。孵育结束后,PBS 漂洗,稍晾干后在组织中央滴加含DAPI 的防淬灭封片剂封片,在TS2R 荧光显微镜下观察。
1.8 Western blotting检测蛋白表达
取小鼠脑血肿周围的新鲜脑组织,在RIPA缓冲液中匀浆(含蛋白酶抑制剂),4℃下静置并12 000 r/min 离心10 min,收集上清液后采用BCA 试剂盒进行蛋白浓度的测定。将等量的待测蛋白溶液加到SDS 聚丙烯酰胺凝胶上,待电泳后目标蛋白转移到聚偏氟乙烯膜上,5%脱脂奶粉封闭后加入兔抗TNF-α(1∶2 000)、兔抗BDNF(1∶1 000)、兔抗Nrf2(1∶1 000)、仓鼠抗CD80(1∶1 000)、兔抗CD206(1∶1 000)、兔抗Trem1(1∶1 000)、大鼠抗Trem2(1∶1 000)4°C 下过夜孵育,β-actin(1∶1 000)作为参照。第2 天,用PBS 清洗后孵育相应的二抗:山羊抗兔IgG 抗体(1∶5 000),山羊抗仓鼠IgG 抗体(1∶5 000),兔抗大鼠IgG(1∶5 000),室温摇床孵育2 h,采用ECL 发光液曝光。采用Image J 软件计算灰度值,目标蛋白的相对表达量=目标蛋白的灰度值/β-actin的灰度值。
1.9 统计学方法
数据分析采用SPSS 22.0 统计软件和GraphPad Prism 7.0 图形分析软件。计量资料以均数±标准差(±s)表示,比较采用方差分析,进一步两两比较行SNK-q检验;计数资料以构成比表示,比较用Fisher 精确概率法;相关分析用Pearson 法。P<0.05为差异有统计学意义。
2 结果
2.1 模型复制结果
对照组、脑出血+红曲素组、脑出血+Nrf2-/-组均存活。脑出血组因蛛网膜下腔出血死亡1 只,脑出血+血脂康组药物干预后死亡1 只。小鼠的手术总死亡率为4.7%(2/42)。
2.2 各组小鼠改良Garcia评分及血红蛋白水平比较
5 组小鼠的改良Garcia 评分和血红蛋白水平比较,差异有统计学意义(P<0.05)。进一步两两比较,与对照组比较,脑出血组改良Garcia 评分降低(P=0.004),血红蛋白水平升高(P<0.05);与脑出血组比较,脑出血+红曲素组的改良Garcia 评分升高(P=0.038)、血红蛋白水平降低(P<0.05),脑出血+血脂康组的改良Garcia 评分升高(P=0.021)、血红蛋白水平降低(P<0.05),脑出血+Nrf2-/-组的改良Garcia 评分降低(P<0.05)、血红蛋白水平升高(P=0.007)。见表1。
表1 各组小鼠改良Garcia评分及血红蛋白水平比较(n=8,±s)
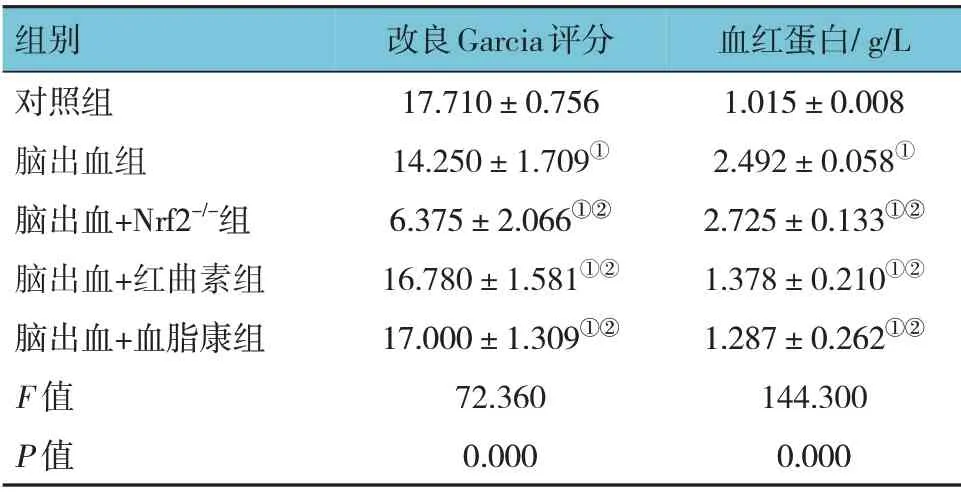
表1 各组小鼠改良Garcia评分及血红蛋白水平比较(n=8,±s)
注:①与对照组比较,P <0.05;②与脑出血组比较,P <0.05。
组别对照组脑出血组脑出血+Nrf2-/-组脑出血+红曲素组脑出血+血脂康组F 值P 值血红蛋白/g/L 1.015±0.008 2.492±0.058①2.725±0.133①②1.378±0.210①②1.287±0.262①②144.300 0.000改良Garcia评分17.710±0.756 14.250±1.709①6.375±2.066①②16.780±1.581①②17.000±1.309①②72.360 0.000
2.3 各组小鼠小胶质细胞Nrf2蛋白的表达
5 组小鼠Nrf2 蛋白相对表达量比较,差异有统计学意义(P<0.05)。进一步两两比较,与对照组比较,脑出血组Nrf2 蛋白相对表达量升高(P=0.022);与脑出血组比较,脑出血+红曲素组(P= 0.007)和脑出血+血脂康组(P=0.000)的Nrf2 蛋白相对表达量升高,脑出血+Nrf2-/-组的Nrf2 蛋白相对表达量降低(P=0.000)(见图1和表2)。免疫荧光检测证实Nrf2表达的相似模式(见图2)。
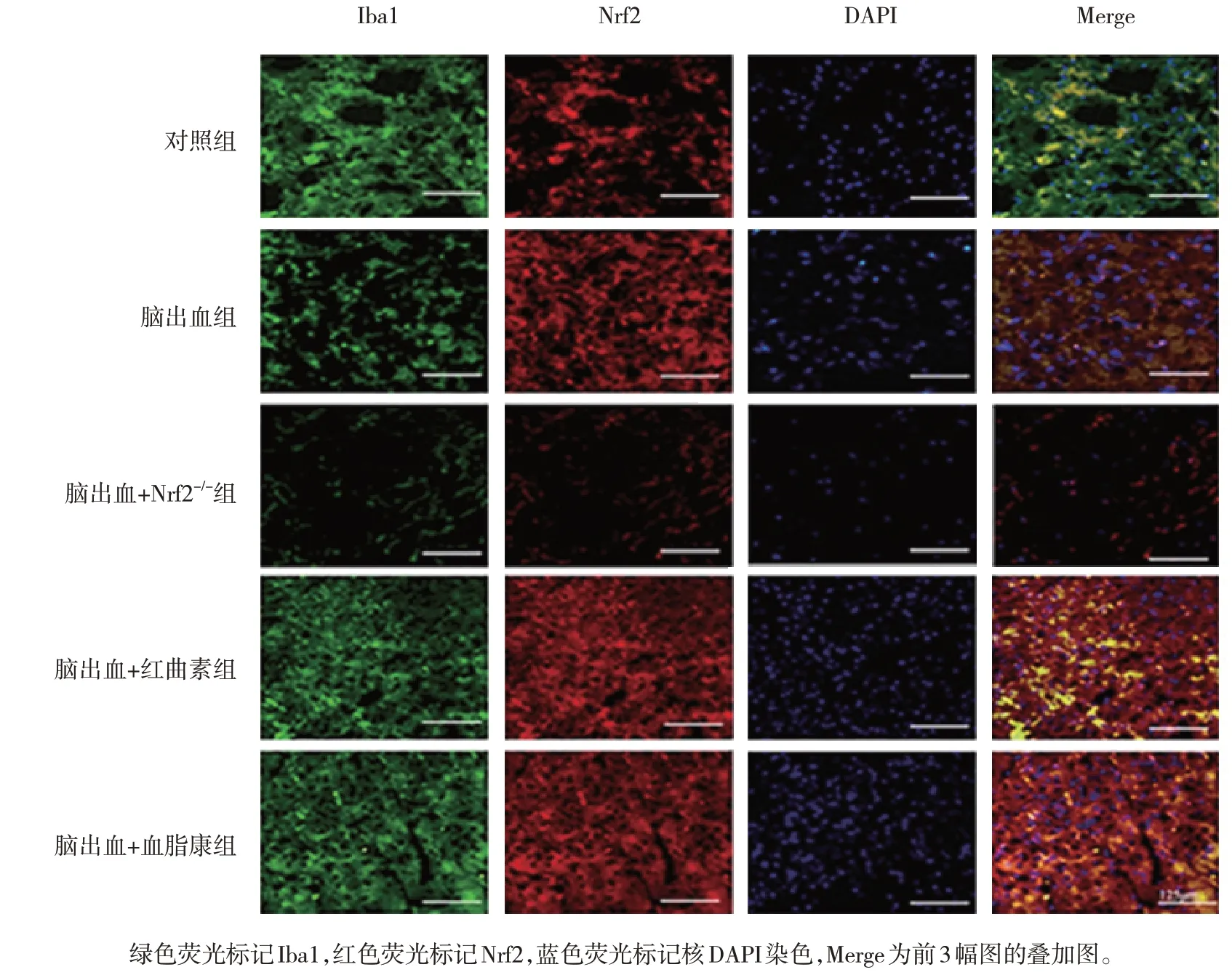
图2 各组小鼠Nrf2蛋白表达的免疫荧光图 (×400)
表2 各组小鼠Nrf2蛋白相对表达量比较 (n=8,±s)
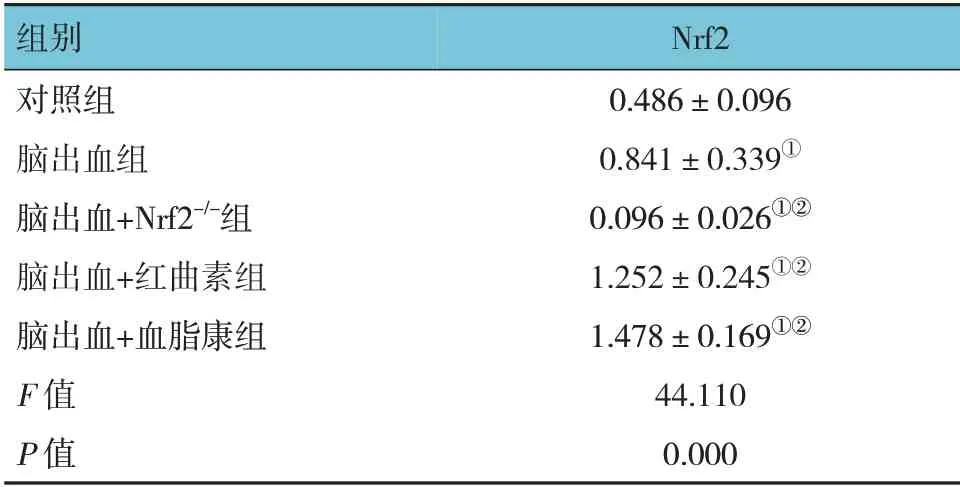
表2 各组小鼠Nrf2蛋白相对表达量比较 (n=8,±s)
注:①与对照组比较,P <0.05;②与脑出血组比较,P <0.05。
组别对照组脑出血组脑出血+Nrf2-/-组脑出血+红曲素组脑出血+血脂康组F 值P 值Nrf2 0.486±0.096 0.841±0.339①0.096±0.026①②1.252±0.245①②1.478±0.169①②44.110 0.000
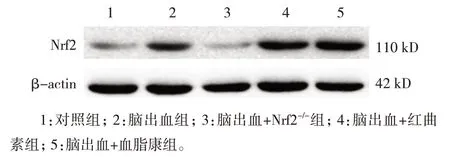
图1 各组小鼠Nrf2蛋白的表达
2.4 各组小鼠小胶质细胞Trem1、Trem2蛋白的表达
5 组小鼠Trem1、Trem2 蛋白相对表达量比较,差异有统计学意义(P<0.05)。进一步两两比较,与对照组比较,脑出血组Trem1(P=0.000)、Trem2(P=0.001)蛋白相对表达量升高;与脑出血组比较,脑出血+红曲素组的Trem1 蛋白相对表达量降低(P=0.046)、Trem2 蛋白相对表达量增加(P=0.002),脑出血+血脂康组的Trem1 蛋白相对表达量降低(P=0.046)、Trem2 蛋白相对表达量增加(P=0.000),脑出血+Nrf2-/-组的Trem1 蛋白相对表达量升高(P=0.025)、Trem2 蛋白相对表达量降低(P=0.000)(见图3和表3)。免疫荧光检测证实了Trem1、Trem2 表达的相似模式(见图4)。
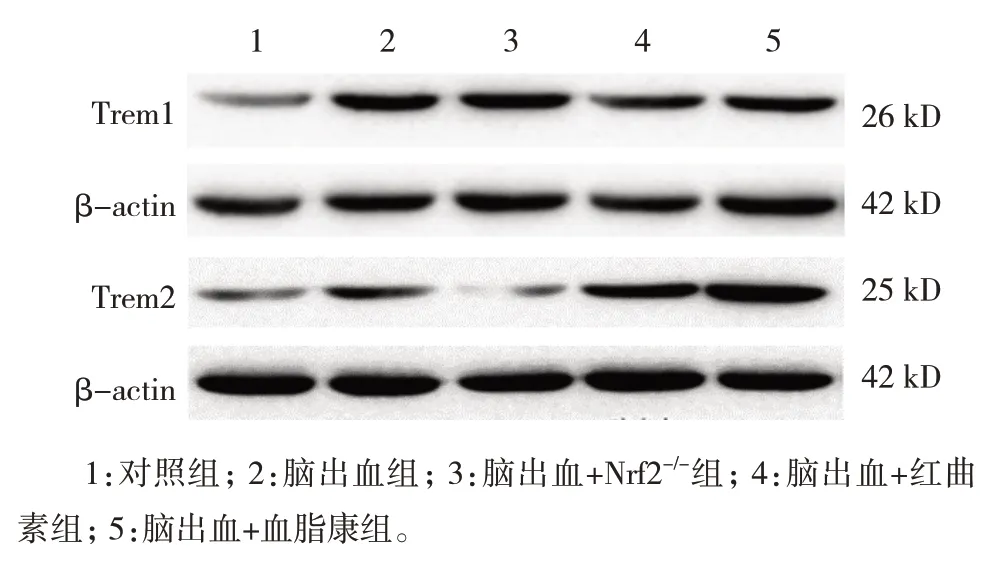
图3 各组小鼠Trem1、Trem2蛋白的表达
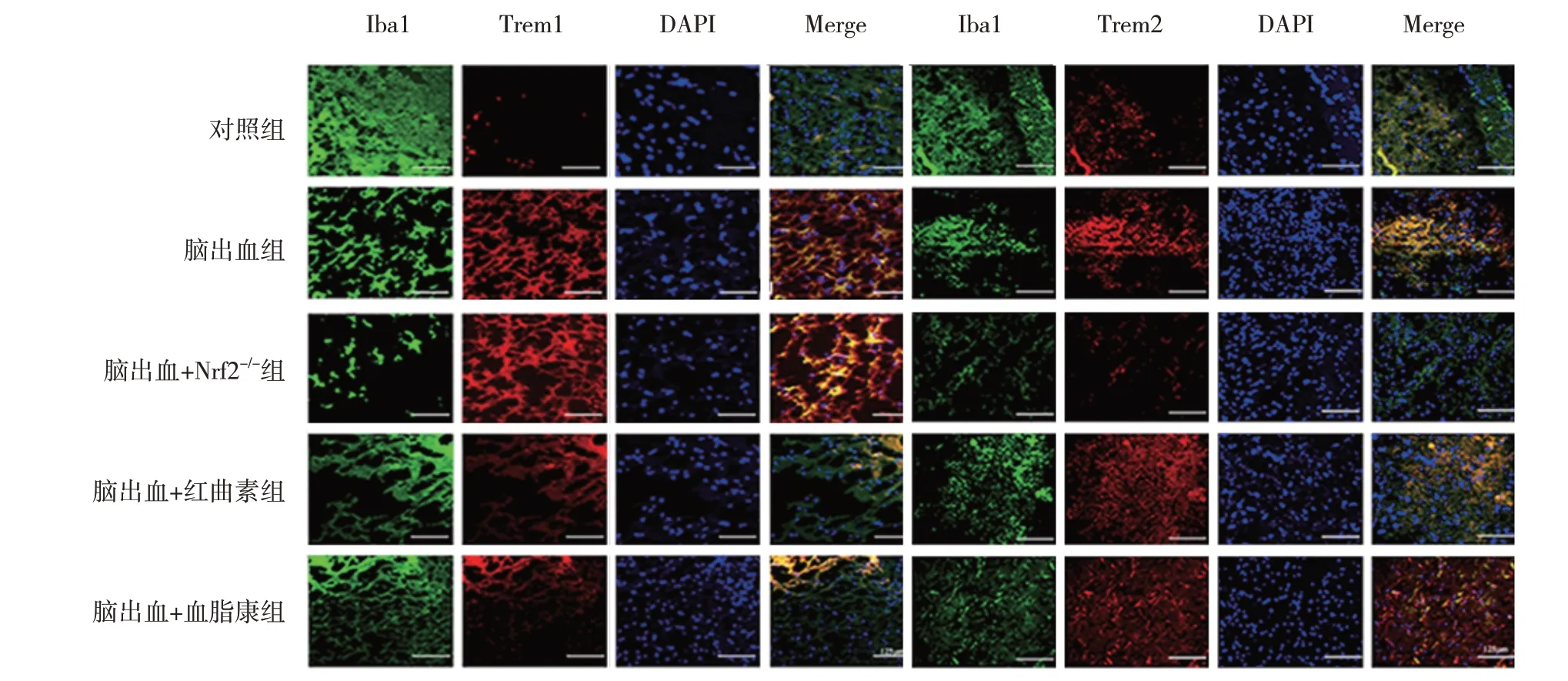
图4 各组小鼠Trem1、Trem2蛋白表达的免疫荧光图 (×400)
表3 各组小鼠Trem1、Trem2蛋白相对表达量比较(n=8,±s)
注:①与对照组比较,P <0.05;②与脑出血组比较,P <0.05。
组别对照组脑出血组脑出血+Nrf2-/-组脑出血+红曲素组脑出血+血脂康组F 值P 值Trem2 0.292±0.076 0.518±0.114①0.152±0.067①②0.722±0.092①②0.976±0.079①②86.940 0.000 Trem1 0.253±0.114 0.931±0.203①1.259±0.248①②0.634±0.155①②0.633±0.224①②22.310 0.000
2.5 各组小鼠小胶质细胞CD80、CD206蛋白的表达
5 组小鼠CD80、CD206 蛋白相对表达量比较,差异有统计学意义(P<0.05)。进一步两两比较,脑出血组CD80 和CD206 蛋白相对表达量较对照组增加(均P=0.000);与脑出血组比较,脑出血+红曲素组的CD80 蛋白相对表达量降低(P=0.000)、CD206 蛋白相对表达量升高(P=0.026),脑出血+血脂康组的CD80 蛋白相对表达量降低(P=0.000)、CD206 蛋白相对表达量升高(P=0.000),脑出血+Nrf2-/-组的CD80 蛋白相对表达量升高(P=0.029)、CD206 蛋白相对表达量降低(P=0.020)(见图5和表4)。免疫荧光检测证实了CD80 和CD206 表达的相似模式(见图6)。
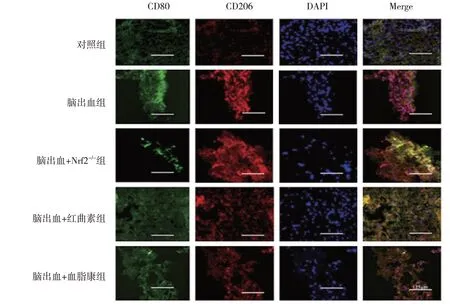
图6 各组小鼠CD80、CD206蛋白表达的免疫荧光图 (×400)
表4 各组小鼠CD80、CD206蛋白相对表达量比较(n=8,±s)
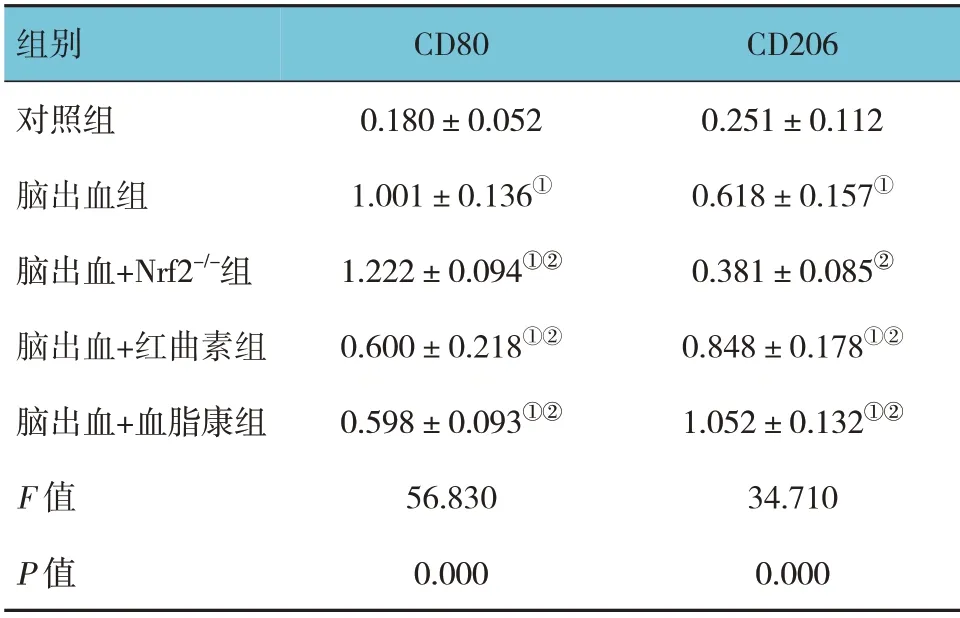
表4 各组小鼠CD80、CD206蛋白相对表达量比较(n=8,±s)
注:①与对照组比较,P <0.05;②与脑出血组比较,P <0.05。
组别对照组脑出血组脑出血+Nrf2-/-组脑出血+红曲素组脑出血+血脂康组F 值P 值CD206 0.251±0.112 0.618±0.157①0.381±0.085②0.848±0.178①②1.052±0.132①②34.710 0.000 CD80 0.180±0.052 1.001±0.136①1.222±0.094①②0.600±0.218①②0.598±0.093①②56.830 0.000
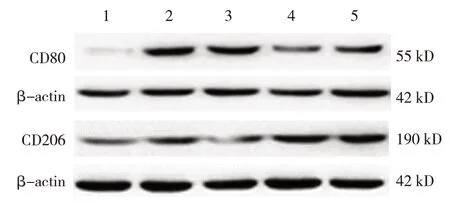
图5 各组小鼠CD80、CD206蛋白的表达
2.6 各组小鼠TNF-α、BDNF蛋白相对表达量比较
5 组小鼠TNF-α、BDNF 蛋白相对表达量比较,经方差分析,差异有统计学意义(P<0.05)。进一步两两比较,与对照组比较,脑出血组TNF-α(P=0.000)和BDNF(P=0.024)蛋白相对表达量均升高;与脑出血组比较,脑出血+红曲素组的TNF-α蛋白相对表达量降低(P=0.009)、BDNF 蛋白相对表达量升高(P=0.021),脑出血+血脂康组的TNF-α蛋白相对表达量降低(P=0.010)、BDNF 蛋白相对表达量升高(P=0.003),脑出血+Nrf2-/-组的TNF-α蛋白相对表达量升高(P=0.014)、BDNF 蛋白相对表达量降低(P=0.000)。见图7和表5。
表5 各组小鼠TNF-α、BDNF蛋白相对表达量比较(n=8,±s)
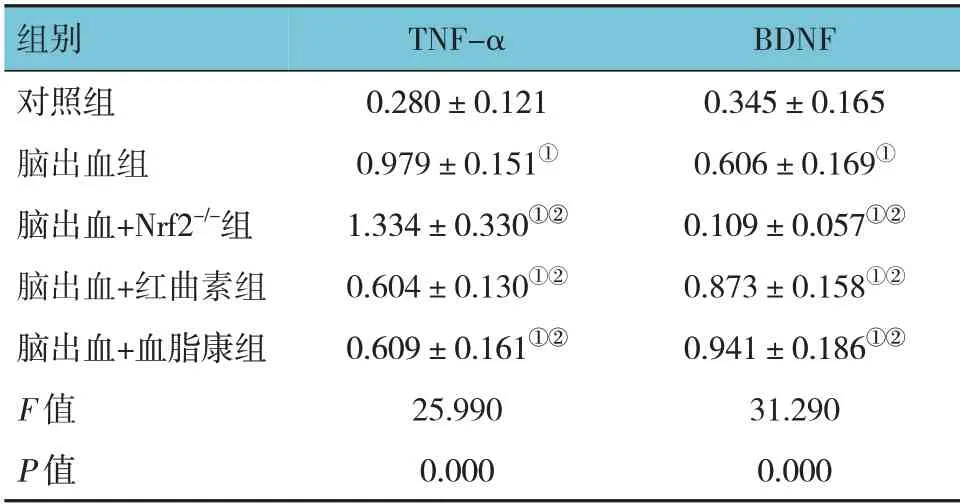
表5 各组小鼠TNF-α、BDNF蛋白相对表达量比较(n=8,±s)
注:①与对照组比较,P <0.05;②与脑出血组比较,P <0.05。
组别对照组脑出血组脑出血+Nrf2-/-组脑出血+红曲素组脑出血+血脂康组F 值P 值BDNF 0.345±0.165 0.606±0.169①0.109±0.057①②0.873±0.158①②0.941±0.186①②31.290 0.000 TNF-α 0.280±0.121 0.979±0.151①1.334±0.330①②0.604±0.130①②0.609±0.161①②25.990 0.000
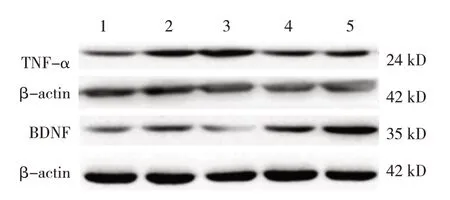
图7 各组小鼠TNF-α、BDNF蛋白表达
2.7 Trem1与改良Garcia评分的相关性
小鼠脑出血后,小胶质细胞Trem1 蛋白表达与改良Garcia 评分呈负相关(r=-0.956,P=0.000),即小胶质细胞Trem1 蛋白表达越多,神经功能恢复越差。见图8。
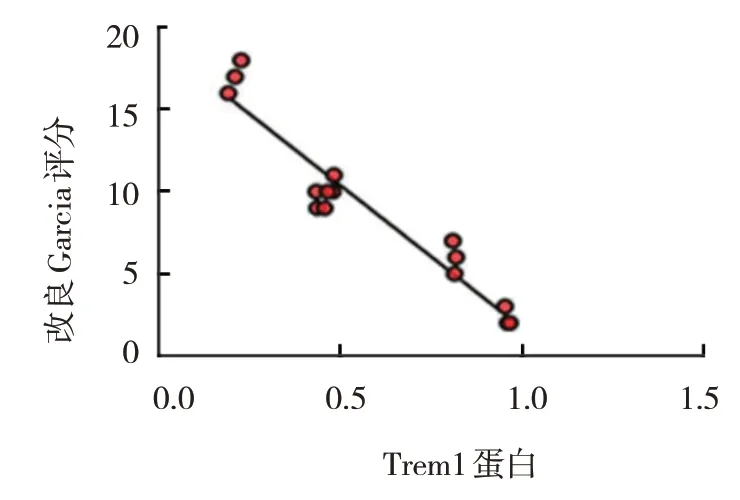
图8 小胶质细胞Trem1蛋白表达与改良Garcia评分的相关性
2.8 Trem2与改良Garcia评分、血红蛋白的相关性
小鼠脑出血后,小胶质细胞Trem2 蛋白表达与改良Garcia 评分呈正相关(r=0.936,P=0.000),与血红蛋白呈负相关(r=-0.473,P=0.009)。即小胶质细胞Trem2 蛋白表达越多,血红蛋白水平越低,神经功能恢复越好。见图9、10。
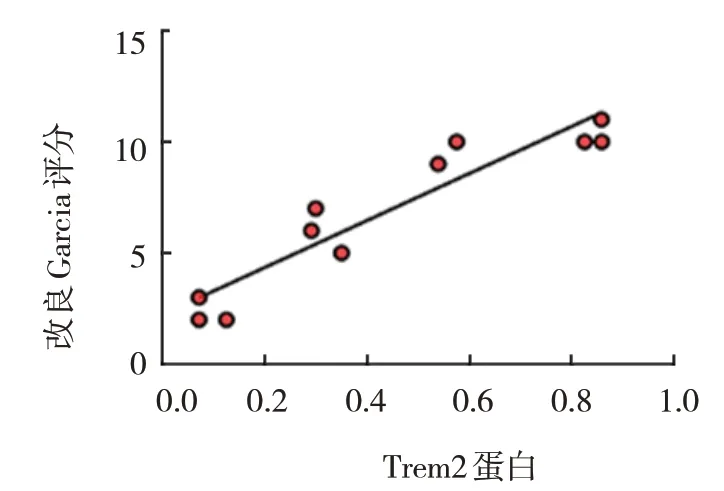
图9 小胶质细胞Trem2蛋白表达与改良Garcia评分的相关性
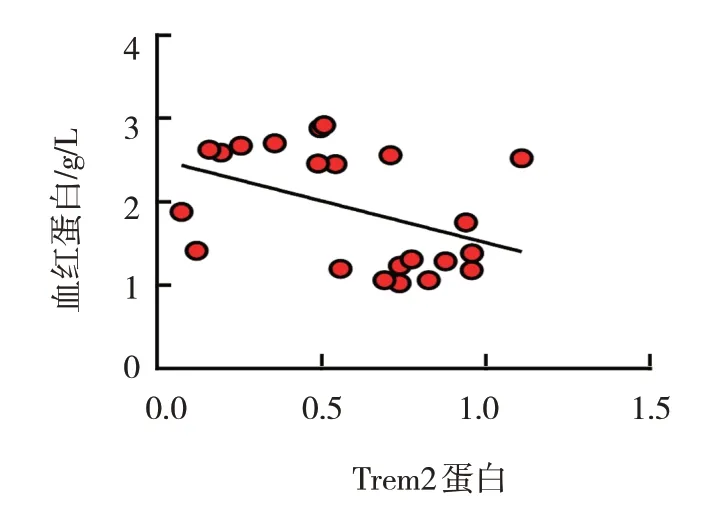
图10 小胶质细胞Trem2蛋白表达与血红蛋白的相关性
3 讨论
本研究结果显示,脑出血+红曲素组和脑出血+血脂康组C57BL/6 小鼠的Nrf2 表达升高,脑出血+Nrf2-/-组Nrf2 的表达降低,这表明激动剂和基因敲除小鼠对Nrf2 的调控作用。红曲素和血脂康作为Nrf2 的激动剂,可上调CD206、Trem2 及BDNF 的表达,下调CD80、Trem1 及TNF-α 的表达,而脑出血+Nrf2-/-组的结果相反,这表明Nrf2 可能促进小胶质细胞向抗炎及吞噬功能转化。脑出血+红曲素组和脑出血+血脂康组血红蛋白水平降低,提示药物能改善脑出血后小鼠神经功能缺损;而脑出血+Nrf2-/-组的结果相反,提示Nrf2 参与了脑出血后血肿的清除和神经功能的改善。Trem1 蛋白表达与改良Garcia 评分呈负相关,Trem2 蛋白表达与改良Garcia 评分呈正相关,与血红蛋白呈负相关,提示Trem2 可能促进血肿产物的清除及改善神经功能,Trem1 加重神经功能的缺损。
小胶质细胞是中枢神经系统的巨噬细胞,被激活后会发生形态和功能上的改变。激活后的小胶质细胞启动免疫反应,释放的炎症介质是神经炎症级联反应的重要调节因子,并且可通过改变各种表面受体来发挥抗炎或者促炎作用[14];在小胶质细胞激活过程中存在一个自反馈级联环路,这些炎症信号被小胶质细胞激活的自我反馈回路放大,构建了一个免疫级联炎症网络[11]。Nrf2 是广泛存在于小胶质细胞中的多效转录因子。它是细胞氧化应激的稳态调节因子,具有很强的抗氧化能力,产生的抗氧化剂包括血红素加氧酶、超氧化物歧化酶、过氧化氢酶、谷胱甘肽巯基转移酶,最后可激活触珠蛋白[15]。此外,Nrf2 是近年来发现的脑卒中和神经退行性疾病中调节小胶质细胞的重要靶点。Nrf2 可通过下调NF-κB 促进小胶质细胞向抗炎表型转化[16]。
红曲素的主要成分为红曲霉菌在水稻中发酵而成的黄色天然色素,是一种新型的Nrf2 激动剂[16],笔者之前的研究表明可抑制病理条件下的氧化应激,促进血肿吸收,减少脑水肿[9]。血脂康是以红曲素为成分的中药,以莫那霉素为主要成分的胆甾素提取物,主要用于抗动脉粥样硬化,并通过抑制TLR4/NF-κB 发挥抗炎作用[17]。本研究结果显示,两者均促进了Nrf2 的表达,且差异无统计学意义。
Trem1 和Trem2 是在骨髓细胞家族上表达的触发受体的成员,主要通过识别外来抗原和有毒物质,从而调节炎症反应;大多数研究表明Trem1 可促进炎症反应,而Trem2 可抑制炎症反应[18];在中枢神经系统中主要表达于小胶质细胞,是脑出血后炎症的关键调控因子。研究表明,抑制Trem1 的表达可以减少脑出血介导的神经炎症及减轻神经功能缺陷[19];而激活Trem2 的表达可清除或内吞凋亡细胞及细胞碎片,减轻小鼠脑出血后的神经炎症和神经元凋亡[20],对神经可塑性和髓鞘形成至关重要[21]。本结果显示脑出血组的Trem1 上调,提示Trem1 与脑出血的神经炎症高度相关。在脑出血+Nrf2-/-组中,Trem1 表达上调,Trem2 表达下降,而Nrf2 激动剂——红曲素和血脂康可抑制Trem1、强化Trem2 的表达,提示红曲素和血脂康通过上调Nrf2抑制Trem1 的神经炎症级联反应,同时强化Trem2的表达;Trem2 作为抗炎因子可降低脑内促炎因子的表达及由Trem1 引起的神经炎症反应,Trem2 的蛋白表达与改良Garcia 评分呈正相关,与血红蛋白呈负相关,说明Trem2 起到神经保护作用,可能通过吞噬参与脑出血后血肿成分的清除。Trem2、BDNF 被认为是神经修复的必需物质。研究结果表明Nrf2 可直接影响Trem1/Trem2 的表达变化发挥神经保护作用。此外红曲素和血脂康可强化小胶质细胞CD206 的表达;表面特异表达CD206 分子可吞噬损伤的神经细胞碎片、促进组织修复和神经元再生,起抗炎和神经修复作用。同时随着小胶质细胞向CD206 表型转化,促炎因子TNF-α 降低,而神经修复因子BDNF 增高。在脑出血+Nrf2-/-组中,小胶质细胞CD206 表达下调,CD80 表达上调,提示Nrf2 可调控小胶质细胞的功能转化。
综上所述,Nrf2 可调控小胶质细胞的功能转化,影响脑出血后血肿清除、水肿形成及神经功能缺损;红曲素、血脂康作为Nrf2 的激动剂,通过上调Trem2、CD206、BDNF 的表达强化小胶质细胞的吞噬功能,促进血肿产物的清除并促进神经修复;同时下调Trem1 及CD80、TNF-α 的表达,抑制小胶质细胞的炎症反应,减轻出血后血红蛋白含量及神经毒性而发挥神经保护作用。该研究从机制水平探索Nrf2 在脑出血后血肿清除中的作用,为未来脑出血后血肿清除的临床干预提供了全新的研究方向及思路。
