黄芪介导PGC-1α/Nrf2通路对年龄相关听力损失保护作用的研究❋
2022-09-21赵小君张玉箫邓新星
谢 慧,赵小君,张玉箫,邓新星
(1.成都中医药大学附属医院,成都 610075 ,2.四川省建筑医院,成都 610081,3.四川青白江区中医院,成都 610300)
在我国,大约有45%以上的60岁人群患有不同程度的听力障碍,老年人的听力健康日益引起全社会的关注[1],探索老年性耳聋发病机制和防治措施的研究亦显得尤为重要。氧化应激是由自由基在体内产生的一种负面作用,并被认为是导致衰老以及年龄相关听力损失的一个重要因素[2,3]。随着年龄的增长,体内的氧化应激水平增加,而内耳组织过氧化会促进耳蜗组成细胞DNA损伤,继而引发耳内耳细胞如外毛细胞凋亡,导致听力衰退[4,5]。中医对抗衰老早有认识,《黄帝内经》中就有抗衰老的精辟论述:“上古之人,其知道者,法于阴阳,和于术数,食饮有节,起居有常,不妄作劳,故能形与神俱,而尽终其天年,度百岁乃去。[6]”经过长期的实践,中医发现多种有抗衰老作用的中药。黄芪作为一种常见的中药材,具有扩张冠状动脉、改善心肌供血、提高免疫功能、延缓细胞衰老进程的功效,其分子机制与抑制体内氧化应激有关[7,8]。但是黄芪与年龄相关听力损失之间的关系尚不得知。本研究在快速衰老小鼠模型上探究黄芪对年龄相关的听力损失的影响及其分子机制。本研究通过成都中医药大学附属医院伦理委员会批准(批号201912001)。
1 材料与方法
1.1 动物与分组
SPF级6周龄雄性SAMP8小鼠48只,购于北京华阜康生物科技股份有限公司,实验动物许可证号SCXK(京)2019-0004。小鼠饲养于温度22±2 ℃、相对湿度40%~60%的环境中,适应2周后随机分为对照组和治疗组各24只。对照组小鼠给予正常饮用水,治疗组小鼠全程给予含有黄芪(40 mg/mL)的饮用水,每只鼠每天摄入黄芪剂量约10 mg/kg(黄芪抗衰老实验研究常用剂量10 mg/kg~40 mg/kg,因本实验为长期给药,故选择小剂量),连续饮用6个月,小鼠饲养在相同环境中。
1.2 主要试剂与仪器
黄芪注射液(神威药业集团有限公司,国药准字Z13020999);Alex Fluor-594标记的鬼笔环肽、SYBR Green qPCR预混液(赛默飞世尔科技(中国)有限公司,货号A12381、K0251);8-OhdG荧光染色试剂盒(中国艾美捷科技有限公司,货号P-6004-96);TUNEL细胞凋亡检测试剂盒(中国凯基生物科技有限公司,货号KGA105);活性氧(reactive oxygen species,ROS)、丙二醛(malondiadehyde,MDA)、超氧化物歧化酶(superoxide dismutase,SOD)酶联免疫吸附实验(enzyme-linked immunosorbent assay,ELISA)检测试剂盒(中国碧云天生物技术研究所,货号S0033 S、S0131 S、S0086);活化的多聚腺苷二磷酸核糖聚合酶(poly-ADP-ribose polymerase,cleaved PARP)-1、活化的半胱氨酸蛋白酶(cleaved cysteine protease,cleaved caspase)-3、过氧化物酶体增殖物活化受体协同刺激因子1α(peroxisome proliferator activated receptor costimulator factor 1α,PGC-1α)、核因子E2相关因子2(Nuclear factor E2 related factor 2,Nrf2)、GAPDH、细胞核内参Lamin b1抗体(英国Abcam公司,货号ab32064、ab214430、ab191838、ab8245、ab31163、ab133741)。
MB11型小动物听觉脑干反应(auditory brainstem response,ABR)测试系统,德国MAICO公司;Axiolab 5型荧光显微镜,德国ZEISS公司;CFX96 Touch型荧光定量PCR仪,美国Bio-Rad公司;ChemiDocTMMP型全能型成像系统,美国Bio-Rad公司。
1.3 ABR阈值测量
分别于治疗前,与治疗1、2、4、6个月取2组小鼠,每组24只,使用戊巴比妥(80 mg/kg)麻醉小鼠,置于恒温垫上维持体温37℃,将电极插入头顶皮下、耳廓后方乳突皮下及尾部皮下,利用小动物ABR测试系统对小鼠进行click及4、8、16及32 Hz短纯音刺激获取ABR,在每个刺激水平收集512个响应。最后一次ABR阈值测量之后断颈处死小鼠,取小鼠耳蜗组织,对耳蜗组织中细胞损伤、氧化应激及炎症相关指标进行检测。
1.4 外毛细胞染色、8-羟基脱氧鸟苷(8-hydroxy deoxy guanosine,8-OHdG)染色及TUNEL染色
治疗6个月后取2组小鼠耳蜗每组各8只,依次使用20%、30%浓度蔗糖对耳蜗组织进行脱水,OCT包埋,使用冰冻切片机制备8 μm厚度的冰冻切片,95%乙醇固定20 min,山羊血清室温封闭1 h,进行外毛细胞染色、8-OHdG染色及TUNEL染色。外毛细胞染色:将PBS稀释的Alex Fluor-594标记的鬼笔环肽(1∶1000)滴注在切片组织上,室温孵育1 h,PBST洗涤后使用荧光显微镜观察外毛细胞形态并任选5个视野拍照,计算耳蜗外毛细胞个数和有完整“V”字形的毛细胞个数。8-OhdG染色:使用8-OhdG荧光染色试剂盒对组织中8-OhdG含量进行染色,具体方法参照说明书。外毛细胞TUNEL染色:使用TUNEL细胞凋亡检测试剂盒对小鼠耳蜗组织中细胞凋亡情况进行检测,具体方法参照试剂盒说明书。8-OhdG染色和TUNAL染色结束后使用上述荧光显微镜并任选5个视野拍照,统计每个视野中阳性细胞面积。
1.5 ROS、MDA、SOD的ELISA检测
治疗6个月后取2组小鼠耳蜗每组各8只,使用RIPA裂解液对组织进行裂解,取上清液使用ROS、MDA、SOD ELISA检测试剂盒对耳蜗组织中ROS、MDA含量以及SOD活性进行检测,具体方法参照说明书。
1.6 荧光定量PCR
治疗6个月后取2组小鼠耳蜗各8只,采用Trizol法提取耳蜗组织中RNA,保存于-80 ℃备用。荧光定量PCR仪检测耳蜗组织中抗氧化分子G6pdh、GCL-c、Gpx-1、Sod2 mRNA表达,以GAPDH为内参,2-ΔΔCt法计算各样本mRNA 的表达水平。G6pdh引物:上游5′-CAGGCAGAGACTTTACGATG-3′,下游5′-CCAACTGGAGCTTGGAAATG-3′;GCL-c引物:上游5′-CGTCAGTGGAGGCTTCATAG-3′,下游5′-CTGAGGCTGAATGGTTCACA-3′;Gpx-1引物:上游5′-AGACGACTGAGCTTTAAGGC-3′,下游5′-GAA CTTCACCTGGATGAGGA-3′;Sod2引物:上游5′-CTCAGGGGCAGAGTTAGTTC-3′,下游5′-GATGAG CTGATTCACTGGCA-3′;GAPDH引物:上游5′-ACTC GGAGGGCAGTTCGTTA-3′,下游5′-GAGATTTGT CAAGCCGCATG-3′;白细胞介素(interleukin,IL)1β引物:上游5′-CGAGAGGATGTTCCAATGCA-3′,下游5′-GTTCTGCAAACTGGCAGGAA-3′;IL-6引物:上游5′-GACGAGAGCCAGTTTAGCAT-3′,下游5′-TGGAGCTTCACTGGAAGACA-3′;肿瘤坏死因子(tumor necrosis factor,TNF)-α引物:上游5′-GGAGGCGCTAATTCGTTAGC-3′,下游5′-CCTTG GGGATGATACACATG-3′。其中健康ICR小鼠作为空白对照;PCR引物由生工生物工程(上海)股份有限公司合成。
1.7 Western blotting检测
治疗6个月后取2组小鼠耳蜗每组各8只,使用RIPA裂解液进行裂解,离心后取上清液保存于-20 ℃备用。SDS-PAGE跑胶、转膜、5%脱脂奶粉封闭,cleaved PARP-1(1∶1000)、cleaved caspase-3(1∶1000)、PGC-1α(1∶1000)、Nrf2(1∶1000)、GAPDH(1∶1000)、Lamin b1(1∶1000)一抗4 ℃孵育12 h,HRP标记的二抗37 ℃孵育1 h,加入ECL发光液曝光检测,其中GAPDH是胞浆蛋白内参蛋白,Lamin b1是核蛋白内参。
1.8 统计学方法
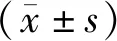
2 结果
2.1 黄芪治疗对小鼠年龄相关听力损失的影响
治疗6个月后当ABR测试使用click刺激时,治疗组小鼠的ABR阈值与对照组比较显著降低,且在8、16、32 kHz短纯音的刺激下,治疗组ABR阈值与对照组比较均显著降低(P<0.01)(见图1)。
注:A.各组小鼠对click刺激的ABR的原始痕迹;B.各组小鼠对click刺激的ABR阈值;C.各组小鼠在不同频率短纯音刺激下的ABR阈值;与对照组比较:**P<0.01图1 黄芪治疗对小鼠年龄相关听力损失的影响
2.2 黄芪治疗对小鼠耳蜗外毛细胞的影响
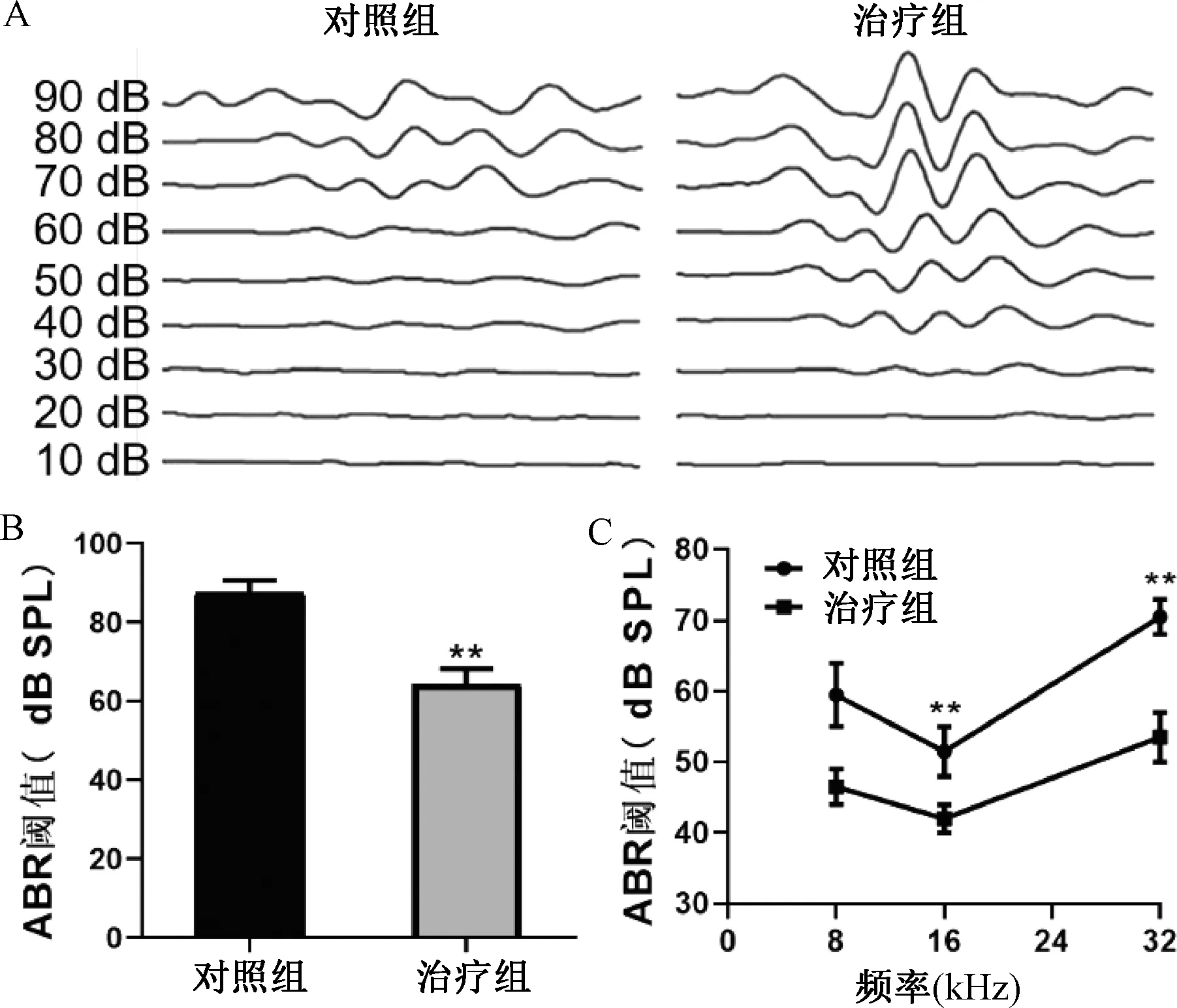
治疗组外毛细胞损失数量、凋亡细胞数量及耳蜗组织中cleaved PARP-1和cleaved caspase 3水平与对照组比较显著减少(P<0.01)(见图2)。
注:A.鬼笔环肽染色结果;B.损伤外毛细胞占的比例;C.外毛细胞TUNEL染色结果;D.凋亡的外毛细胞所占面积;E-F.耳蜗组织cleaved PARP-1和cleaved caspase 3的蛋白表达水平;与对照组比较:**P<0.01图2 黄芪治疗对增龄引发外毛细胞损伤的影响
2.3 黄芪治疗对小鼠外毛细胞DNA损伤的影响
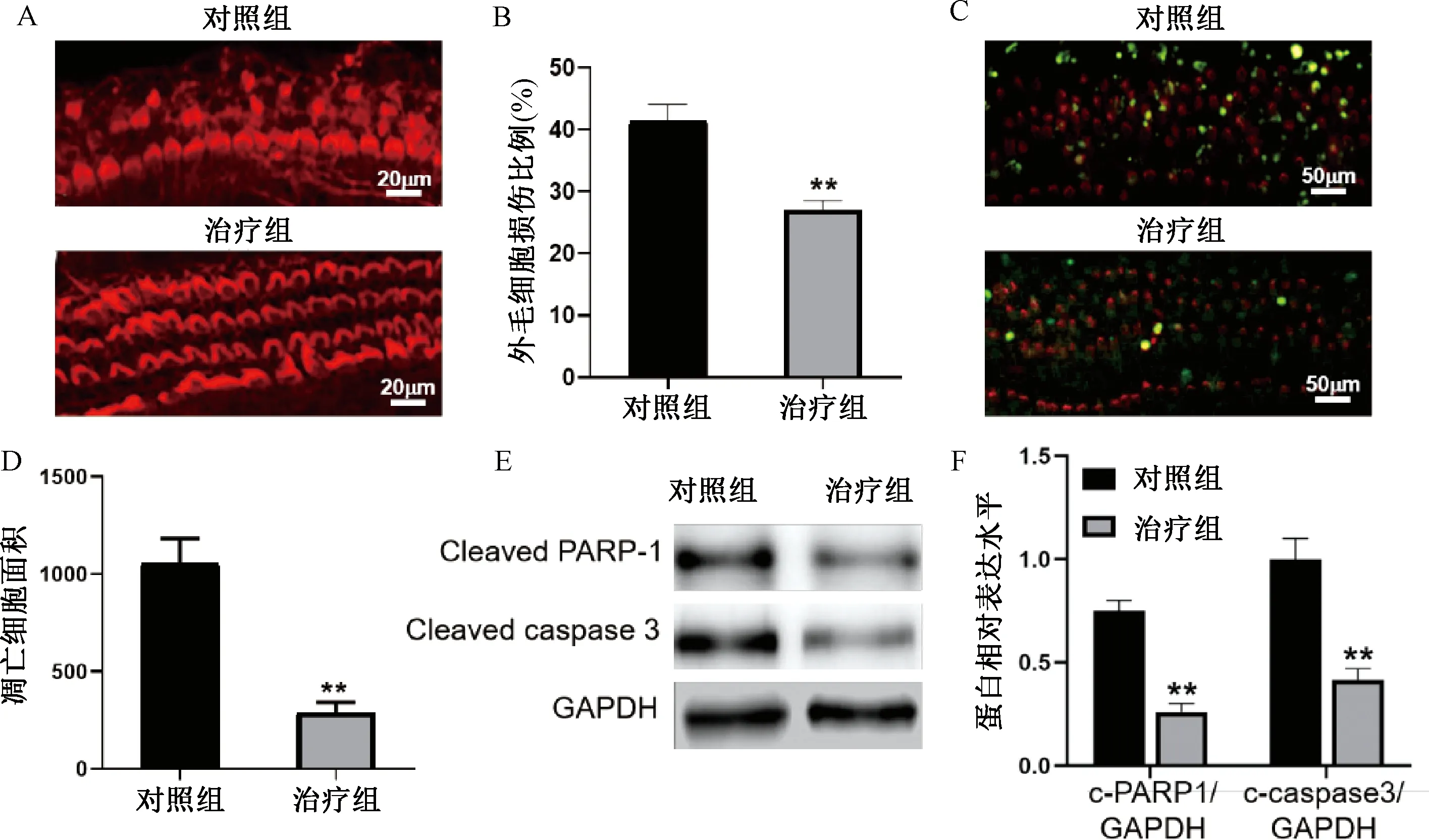
治疗组8-OhdG的含量与对照组比较显著降低(P<0.01)(见图3)。
注:A.8-OhdG染色结果;B.8-OhdG阳性区域面积;与对照组比较:**P<0.01图3 黄芪治疗对增龄引发外毛细胞DNA损伤影响比较
2.4 黄芪治疗对小鼠外耳蜗组织中氧化应激水平的影响
治疗组耳蜗组织中ROS、MDA水平与对照组比较显著降低,而SOD活性与对照组比较显著升高(P<0.01)(见表1)。
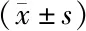
表1 各组小鼠耳蜗组织中ROS、MDA及SOD活性比较
2.5 黄芪治疗对小鼠外耳蜗组织中抗氧化基因表达的影响
治疗组耳蜗组织中G6pdh、GCL-c、Gpx-1、Sod2 mRNA表达水平与对照组比较显著升高(P<0.05,P<0.01)(见表2)。
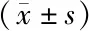
表2 各组小鼠耳蜗组织G6pdh、GCL-c、Gpx-1、Sod2 mRNA表达水平比较
2.6 黄芪治疗对小鼠外耳蜗组织中细胞因子表达的影响
荧光定量PCR结果显示,治疗组耳蜗组织中IL-1β、IL-6、TNF-αmRNA表达水平较对照组显著降低(P<0.05)(见表3)。
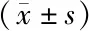
表3 各组小鼠耳蜗组织白细胞介素IL-1β、IL-6、TNF-αmRNA水平比较
2.7 黄芪治疗对小鼠外耳蜗组织中PGC-1α/Nrf2通路的影响
治疗组耳蜗组织中PGC-1α表达水平以及Nrf2的核积累量相比于对照组显著升高(P<0.01)(见图4)。
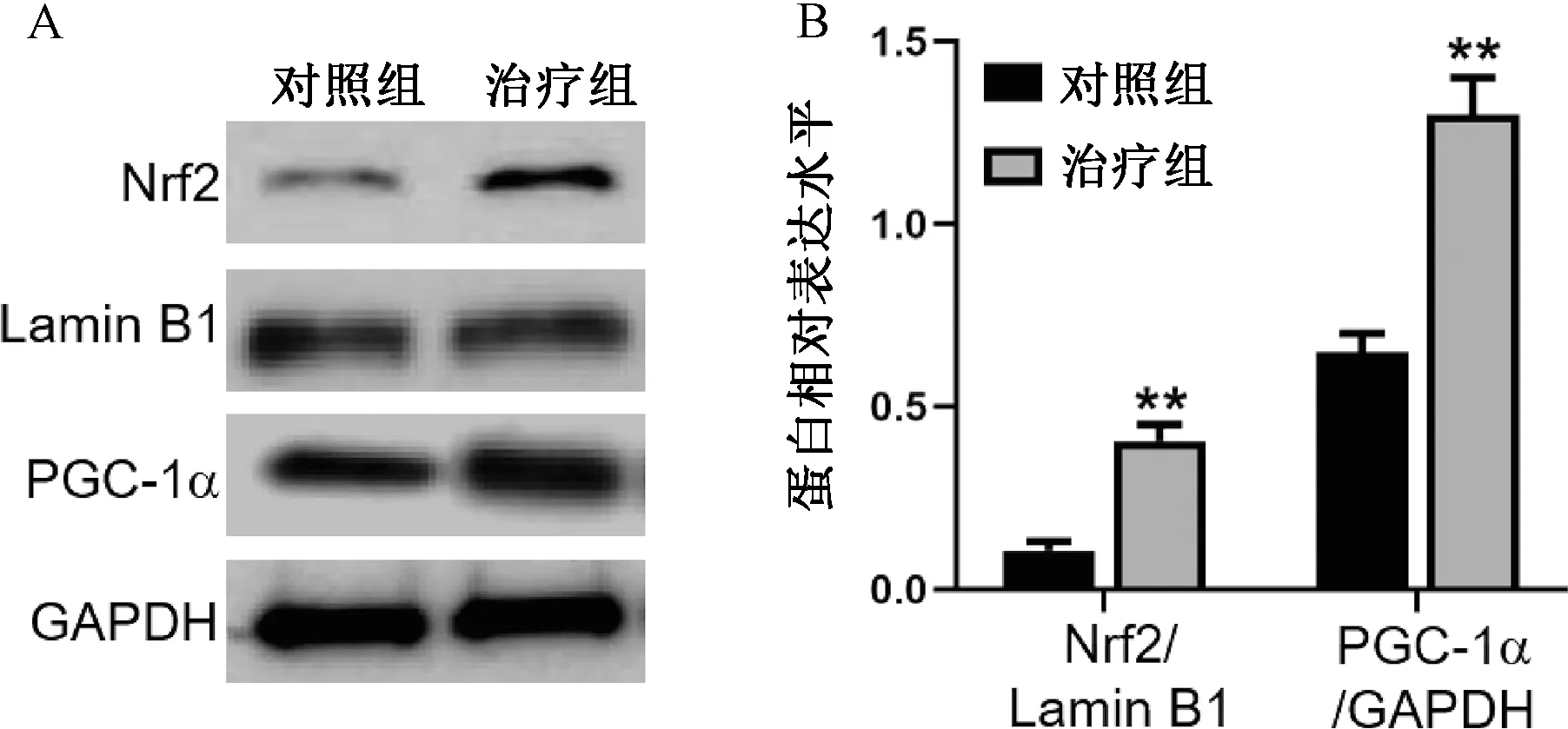
注:A.耳蜗组织中PGC-1α表达以及Nrf2核积累的western blotting检测;B.PGC-1α表达以及Nrf2核积累量灰度分析结果;与对照组比较:**P<0.01图4 黄芪治疗对耳蜗组织中过氧化物酶体增殖物活化受体协同刺激因子(peroxisome proliferator activated receptor costimulator factor,PGC)1α表达以及核因子E2相关因子(nuclear factor E2 related factor,Nrf)2核积累的影响
3 讨论
随着老龄化社会的来临,年龄相关性听力损失的防治与治疗已成为当今社会研究的热点。衰老氧化应激被认为是促进衰老以及年龄相关性听力损失的重要因素。一方面当机体发生衰老时,内耳骨膜会增厚,继而压迫内耳道底部神经血管通道,导致通道变小,使耳蜗内耳血流量减少,导致耳蜗缺氧和听力损失[9]。另一方面,人体耳蜗是氧代谢的活跃组织,随着组织器官的老化,耳蜗毛细胞的抗氧化能力逐渐下降,耳蜗整体趋向过氧化状态,然后每当耳蜗发生大量的过量氧化反应时,耳蜗组织会产生大量的氧自由基,过量氧自由基最终导致耳蜗组织细胞的氧化性衰老,衰老细胞中的色素C氧化酶活性下降,继而线粒体功能受损,导致耳蜗能力供给不足,最终导致听力损失[9]。因此,改善机体氧化应激水平是缓解年龄相关性听力损失的重要途径。黄芪是传统中药材中最重要的益气适生药材之一,其主要成分是多糖、黄酮类化合物和皂苷。研究表明,黄芪在抗衰老以及衰老相关疾病方面具有显著效果[8,10]。
SAMP8小鼠是一种快速衰老模型,研究表明SAMP8小鼠衰老过程会伴随显著的听力下降[11]。因此,本研究采用快速衰老模型SAMP8小鼠观察黄芪对年龄相关性听力损失的作用,结果发现黄芪干预能明显降低小鼠的ABR阈值。耳蜗外毛细胞顶端的纤毛是机械信号的接受器,含有重要的离子通道,在耳朵行使听力功能时具有重要作用。外毛细胞上含大量肌动蛋白,本研究通过使用鬼笔环肽染色发现,黄芪干预能够显著降低外毛细胞损失比例。近年研究发现,耳蜗毛细胞和螺旋神经节细胞退变是衰老的主要表现,而退变的主要形式是毛细胞和螺旋神经节细胞的凋亡,凋亡信号通路涉及许多分子和蛋白[12]。本研究发现,黄芪干预能够显著减少凋亡外毛细胞数目,且能抑制耳蜗组织中caspase 3凋亡通路的激活。这些结果表明,黄芪能够通过抑制耳蜗外毛细胞凋亡缓解年龄相关性听力损失,
氧化应激是细胞凋亡的重要分子机制,当机体的氧化应激平衡被打破,机体处于过氧化状态,机体的氧自由基ROS等会通过损伤线粒体[13]、激活细胞死亡受体以及内质网应激等途径介导细胞凋亡。8-OHdG是活性氧自由基如羟自由基、单线态氧等攻击DNA分子中的鸟嘌呤碱基第8位碳原子而产生的一种氧化性加合物,能够作为内源性及外源性因素对DNA氧化损伤作用的生物标志物,通过8-OHdG的检测可以评估体内氧化损伤和修复的程度,及氧化应激与DNA损伤的相互关系。本研究发现,黄芪治疗显著降低外毛细胞中8-OHDG含量,表明黄芪干预能够显著抑制外毛细胞氧化应激引发的DNA损伤。ROS、MDA是机体氧化应激及损伤的标记物,SOD活性及G6pdh、GCL-c、Gpx-1、Sod2分子表达量反映机体的抗氧化水平[14]。本研究发现,黄芪干预显著改善耳蜗组织炎症反应,表现为降低IL-1β、IL-6、TNF-α的表达水平。PGC-1α是维持线粒体生物合成的关键转录因子,主要存在于线粒体丰富的组织或器官中,可促进线粒体生物合成,增强不同组织细胞有氧呼吸功能,且在能量平衡、线粒体氧化代谢等方面发挥重要作用[15]。Nrf2是一种重要的氧化还原敏感性转录因子,其通过诱导调控细胞内抗氧化分子的表达,有利于改善机体氧化应激状态,促进细胞存活以及维持细胞的氧化还原稳态[16]。
综上所述,黄芪能够抑制耳蜗毛细胞的凋亡,进而改善年龄相关的听力损失,其分子机制与激活PGC-1α/Nrf2通路抑制耳蜗组织中氧化应激水平有关,本研究为临床应用黄芪预防和治疗年龄相关听力损失提供了实验依据。
