生脉饮对阿霉素损伤心肌细胞的保护作用研究❋
2022-09-21崔海峰冯淑怡石晓路孙明杰孙丽华
崔海峰,彭 博,冯淑怡,黄 颖,石晓路,武 乾,孙明杰,孙丽华△
(1.北京市中医药防治重大疾病基础研究重点实验室,北京 100700;2.中国中医科学院医学实验中心,北京 100700;3.中国中医科学院中药研究所,北京 100700)
阿霉素(adriamycin,ADM)为蒽环类抗生素,因抗瘤谱广、疗效确切,广泛用于肿瘤的化学治疗。但ADM与心肌组织有高亲和性,体内累积剂量达到500~550 mg/m2时,充血性心力衰竭、扩张型心肌病甚至死亡的发生风险都显著提高[1]。因此,预防和减轻阿霉素心肌毒性一直是临床应用首要考虑的问题,也是近年来业界关注的热点问题之一。生脉饮是传统经典方剂生脉散的不同剂型,由红参、麦冬、五味子组成,能够改善心肌供血,缓解心衰症状,增加化疗药物的抗肿瘤作用[2],但其是否能够在体外保护阿霉素引起的心肌细胞损伤至今鲜有报道。基于此,本研究通过ADM损伤心肌细胞的体外模型,评价生脉饮对心肌细胞的保护作用,为生脉饮减轻ADM心肌毒性提供实验依据。
1 材料
1.1 药物
生脉饮由钓鱼台医药集团吉林天强制药股份有限公司提供,国药准字Z22022398,规格10 mL/支。
1.2 细胞株
H9c2大鼠胚胎心肌细胞为本室传代保存细胞株。
1.3 主要试剂及仪器
Hyclone DMEM高糖培养基(美国Thermo Fisher公司,货号SH30243.01);Gibco胎牛血清(美国Invitrogen公司,货号2094468CP);细胞计数试剂(日本东仁化学品公司,cell counting kit-8,CCK-8,货号PL702);超氧化物歧化酶(superoxide dismutase,SOD)测定试剂盒(货号20191127)、丙二醛(malondialdehyde,MDA)测定试剂盒(南京建成生物工程研究所,货号20191127);Bio Tek Synergy1型多功能酶标仪,美国Bio-tek公司。
2 方法
2.1 细胞复苏与培养
按照常规细胞培养方法进行[3,4],配置含10%胎牛血清,100 U/mL青霉素,100 U/mL链霉素,DMEM完全培养基。将H9c2细胞从液氮中取出,迅速放入37 ℃水浴锅中,轻轻摇动冻存管使细胞悬液尽快融解并吸取细胞悬液,加入10倍培养基稀释,离心后去上清,重悬细胞沉淀于新鲜DMEM培养基中,置于37 ℃5%CO2培养箱中培养,2~3 d换液1次,细胞融合达80%以上时应用0.25%胰酶常规消化传代。
2.2 CCK-8检测生脉饮对H9c2细胞活性的作用
取对数生长期的H9c2细胞,按照8×103个/孔细胞密度接种于96孔培养板中,接种体积100 μL,24 h细胞贴壁后加入不同浓度生脉饮含药培养液(0.39~1600 μg/mL),继续培养24 h、48 h、72 h,每孔加入10 μL CCK-8,培养2 h后酶标仪测定450 nm处的光密度(optical density,OD)值,以空白孔OD值调0,对照组平均吸光值为100%,其余各组均与之比较。细胞存活率(%)=(实验组OD值-空白孔OD值)/(对照组OD值-空白孔OD值)×100%。
2.3 CCK-8筛选阿霉素损伤最适浓度
取对数生长期细胞接种于96孔板,设对照组、不同浓度ADM组,24 h贴壁后加入不同浓度ADM(1.5625~100 μmol/L),继续培养24 h、48 h、72 h后,每孔加入10 μL CCK-8,孵育2 h后酶标仪测定450 nm处的OD值,细胞存活率计算方法同2.2,确定H9C2损伤模型最适ADM浓度。
2.4 CCK-8检测生脉饮对ADM损伤H9c2细胞保护作用
细胞接种于96孔板,设对照组、ADM组及ADM +生脉饮各剂量组,24 h细胞贴壁后,根据分组情况加入ADM和不同浓度生脉饮,继续培养24 h、48 h、72 h后加入CCK-8,孵育2 h后酶标仪检测,方法同前。
2.5 试剂盒检测损伤后H9c2细胞内SOD,MDA变化
2.5.1 细胞培养及传代 方法同前,取对数生长期细胞接种于25 cm2培养瓶内,孵育24 h后根据分组情况加入1 μmol/L ADM和不同浓度生脉饮,继续培养24 h、48 h、72 h。
2.5.2 细胞裂解及SOD、MDA检测 造模结束后将各培养瓶内细胞消化离心后,PBS洗1遍离心后弃上清,每组加入200 μL RIPA裂解液,冰上裂解20 min,离心后取上清测定蛋白浓度。按照文献及SOD试剂盒说明书采用WST-1法进行后续操作,酶标仪450 nm检测各组SOD活性[5]。应用TBA法按照MDA试剂盒说明进行后续操作,酶标仪532 nm检测各组MDA含量。
2.6 统计学方法
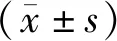
3 结果
3.1 生脉饮对心肌H9c2细胞增殖的影响
图1示,生脉饮(0.39~1600 μg/mL)对H9c2细胞未呈现明显的毒性作用;生脉饮(25、200、1600 μg/mL)与H9c2细胞共培养72 h,能够促进细胞增殖,增加细胞存活率,与对照组比较差异有统计学意义(P<0.05),表明生脉饮毒性低,在一定剂量范围内作用时间延长且能够促进心肌细胞增殖。

注:A.生脉饮作用H9c2细胞24 h;B.生脉饮作用H9c2细胞48 h;C.生脉饮作用H9c2细胞72 h;与对照组比较:*P<0.05图1 生脉饮(0.39~1600 μg/mL)对H9c2细胞增殖的影响
3.2 ADM损伤心肌H9c2细胞浓度筛选
图2示,ADM(1.5625~100 μmol/L)作用H9c2细胞24 h、48 h、72 h均能够明显抑制细胞增殖。作用72 h时随着ADM剂量增加,细胞存活率逐渐降低并呈现剂量依赖关系。
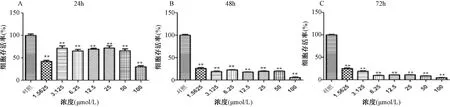
注:A.ADM损伤H9c2细胞24 h;B.ADM损伤H9c2细胞48 h;C.ADM损伤H9c2细胞72 h;与对照组比较:**P<0.01;阿霉素(adriamycin,ADM)图2 ADM(1.5625~100 μmol/L)对H9c2细胞的毒性作用
3.3 生脉饮对ADM损伤H9c2细胞的影响
根据3.2结果,以ADM 1 μmol/L作为H9c2损伤模型,图3A示,ADM (1 μmol/L)作用H9c2细胞24 h,细胞存活率降低,与对照组比较差异有统计学意义(P<0.01);生脉饮400 μg/mL组细胞存活率高于ADM组,差异有统计学意义(P<0.05)。随着ADM作用时间延长,细胞存活率降低,作用48 h、72 h,ADM组与对照组比较差异有统计学意义(P<0.01),而生脉饮各剂量组与ADM组比较差异均无统计学意义(图3B,C),表明生脉饮400 μg/mL对ADM损伤H9c2细胞24 h有一定的保护作用,随着ADM作用时间延长对细胞损伤加重,生脉饮不能改善ADM对细胞的严重损伤。

注:A.ADM损伤H9c2细胞24 h;B.ADM损伤H9c2细胞48 h;C.ADM损伤H9c2细胞72 h;与对照组比较:**P<0.01;与ADM组比较#P<0.05;阿霉素(adriamycin,ADM)图3 生脉饮对ADM(1μmol/L )损伤H9c2细胞的影响
3.4 生脉饮对ADM诱导H9c2心肌细胞损伤SOD的影响
图4A示,ADM(1 μmol/L )损伤H9c2细胞24 h,各组组间比较差异均无统计学意义。图4B示,ADM(1 μmol/L )损伤48 h,生脉饮100、200 μg/mL组细胞内SOD活力高于ADM组(P<0.05);图4C示,ADM(1 μmol/L )损伤72 h,ADM组细胞内SOD活力较对照组明显降低(P<0.01);与ADM组比较,生脉饮50、200 μg/mL组细胞内SOD活力增加(P<0.01)。以上结果表明,ADM能够降低细胞内SOD活力,生脉饮保护心肌细胞作用可能与增加SOD活力相关。

注:A.ADM损伤H9c2细胞24 h;B.ADM损伤H9c2细胞48 h;C.ADM损伤H9c2细胞72 h;与对照组比较:**P<0.01;与ADM组比较:#P<0.05,##P<0.01;阿霉素(adriamycin,ADM),超氧化物歧化酶(superoxide dismutase,SOD)图4 生脉饮对ADM诱导H9c2心肌细胞损伤SOD的影响
3.5 生脉饮对ADM诱导H9c2心肌细胞损伤MDA的影响
图5示,ADM(1 μmol/L )损伤H9c2细胞24 h、48 h、72 h,ADM组MDA含量较对照组均显著升高(P<0.01),生脉饮各剂量组MDA含量较ADM组均显著降低(P<0.01)。以上结果提示,ADM能够增加胞内MAD含量,生脉饮能够降低ADM损伤引起的MDA含量增加。

注:A.ADM损伤H9c2细胞24 h;B.ADM损伤H9c2细胞48 h;C.ADM损伤H9c2细胞72 h;与对照组比较:**P<0.01;与ADM组比较:##P<0.01;阿霉素(adriamycin,ADM),丙二醛(malondialdehyde,MDA)图5 生脉饮对ADM诱导H9c2心肌细胞损伤MDA的影响
4 讨论
ADM是肿瘤化疗方案中最常应用的抗肿瘤药物之一,但其浓度依赖性的心脏毒性呈现进展性和不可逆性,是临床应用前必须考虑的因素。目前,右丙亚胺是唯一批准用于临床预防ADM致心脏毒性的药物,因价格较高应用受到限制。中医药在预防肿瘤发生、抗耐药、防止复发、转移等方面具有明显优势,从中医药中寻找降低ADM心肌毒性的辅助药物一直受到广大科研工作者的关注,是肿瘤研究的热点问题之一。生脉饮由红参、麦冬、五味子组成,三药合用一补一清一敛,共同发挥益气生津、敛阴止汗的作用,是治疗气阴两虚的常用方剂。生脉注射液联合5氟尿嘧啶能够提高机体对肿瘤细胞的免疫应答,增加化疗药物的抗肿瘤作用[6]。加味生脉饮能够改善HER-2阳性乳腺癌术后患者赫赛汀靶向治疗的临床症状,抑制左心射血分数下降,保护心肌,提高患者对赫赛汀所致心脏毒性的耐受力,预防心脏毒性事件发生[7]。谢有鑫等[8]研究发现,左心射血分数降低性心力衰竭采用生脉注射液和丹参川芎嗪注射液联合治疗,能明显改善患者心脏功能,降低脑尿钠肽和红细胞分布宽度水平。生脉注射液联合米力农注射液,可显著改善慢性心力衰竭患者的心肾功能,提高心功能分级[9]。另有报道,ADM可诱导活性氧(reactive oxygen species,ROS)过度累积,促凋亡蛋白B淋巴细胞瘤-2相关蛋白X(B-cell lymphoma-2-Associated X,Bax)表达量显著上升,抗凋亡蛋白B淋巴细胞瘤-2(B-cell lymphoma-2,Bcl-2)显著下降,心肌凋亡指数显著升高,心肌病理学及超微结构损伤导致心功能显著下降。生脉饮可部分逆转ADM引起的上述变化,对ADM引起的心肌损伤具有保护作用,其可能机制在于降低ADM诱导的心肌过度氧化和凋亡[10]。
基于此,本课题以心肌H9c2细胞为研究对象,建立ADM损伤心肌细胞模型,体外观察生脉饮对ADM致H9c2细胞损伤的保护作用。研究发现,生脉饮(0.39~1600 μg/mL)对H9c2细胞未呈现明显的毒性作用;一定的剂量生脉饮(25,200,1600 μg/mL)作用一定时间(72 h),能够促进H9c2细胞增殖,说明生脉饮自身对心肌H9c2细胞几乎无毒性,呈现时间-剂量依赖性的促增殖作用。ADM毒性强,1.5625~100 μmol/L ADM作用H9c2细胞均呈现明显的毒性,并存在时间依赖关系。王皓等[11]报道,与对照组比较ADM组心肌细胞活力减弱,本研究与此报道一致。孙彬栩等[12]报道新加生脉饮能改善心肌细胞凋亡大鼠心功能情况,抑制心肌细胞凋亡。本研究发现,生脉饮400 μg/mL对ADM(1 μmol/L)损伤H9c2细胞24 h有一定的保护作用。随着ADM作用时间延长,对细胞损伤加重,生脉饮不能改善ADM对细胞的严重损伤。ADM心脏毒性的特点在于线粒体氧化磷酸化导致的剂量依存性下降,ADM和铁相互作用产生的活性氧可以破坏心肌,造成肌原纤维的损失和细胞质的液泡化,从而限制了其在临床中的应用。此外,ADM可引起心肌肾素、血管紧张素Ⅱ、醛固酮以及ROS 生成增高,导致心肌细胞凋亡,纤维化以及心功能减退[13]。由此,本研究探讨了生脉饮对ADM的损伤作用是否与氧化损伤有关,以SOD、MDA变化作为氧化损伤评价指标,结果显示生脉饮对ADM损伤的保护作用与增加SOD活力、降低MDA含量相关。
综上,ADM损伤H9c2心肌模型制备简单快捷、条件可控、稳定性高、重复性好,可推广用于心肌保护药物的体外筛选。生脉饮对心肌细胞几乎无毒性,生脉饮对ADM损伤的心肌细胞具有一定的保护作用,与增加SOD活力、降低MDA含量相关,其损伤作用的具体机制有待进一步研究。
