氢醌对L-02肝细胞自噬的影响
2022-09-21郑作兵刘婷婷吴杨娜杨嘉辉胡恭华
郑作兵,张 伟,熊 亮,刘婷婷,吴杨娜,杨嘉辉,胡恭华,
氢醌(hydroquinone,HQ)是一种常见的环境化学物质,广泛应用于工业和医疗等领域,人类可通过饮食、职业和环境的暴露接触到HQ。HQ可经消化道、呼吸道、皮肤等途径进入人体,主要在肝肾代谢,可对肝、肾、造血系统等造成损害。自噬是维持机体内环境稳态的自身消化代谢过程,可以将胞质中的细胞器、蛋白和大分子等物质分解后再利用[1]。已有研究阐明了HQ对人正常L-02肝细胞的细胞周期、增殖、凋亡的影响,并发现其对L-02细胞的DNA损伤作用[2],而HQ对L-02细胞自噬的影响尚未见报道。为此,该研究以L-02细胞为研究对象,HQ为受试物,观察不同剂量HQ对人正常肝L-02细胞自噬的影响,为扩展HQ介导的毒理学特征及深入研究自噬在HQ致肝细胞损伤中的作用奠定基础。
1 材料与方法
1.1 细胞与受试物人正常肝细胞(L-02细胞)由深圳市疾病预防控制中心惠赠。HQ购自美国Sigma公司,色谱纯,纯度≥99.0%。
1.2 仪器与试剂倒置荧光显微镜(德国Laica公司),CO2恒温培养箱和多功能酶标仪(美国Thermo Fisher公司),AI600超灵敏多功能成像仪(美国GE公司), Zeiss LSM 880共聚焦显微镜(德国Carl Zeiss公司),透射电子显微镜(日本Hitachi公司),电泳仪、垂直电泳槽和电转槽(美国Bio-rad公司),胎牛血清、RPMI-1640培养基和胰蛋白酶(美国Gibco公司);双抗(青霉素、链霉素混合液)(美国Sigma公司);LC3A/B抗体、LC3B抗体、Beclin-1抗体、P62抗体、GAPDH抗体、抗兔二抗和抗鼠二抗(美国Abcam公司);AdPlus-mCherry-GFP-LC3B(上海碧云天生物技术有限公司);RIPA蛋白裂解液、BCA蛋白测定试剂盒(北京索莱宝科技有限公司);TGX FastCast Kit 12%(美国Bio-Rad公司);PVDF膜、ECL化学发光液(美国Millipore公司);电镜固定液、丙酮、无水乙醇、牛血清白蛋白[生工生物工程(上海)股份有限公司]。
1.3 方法
1.3.1细胞培养与分组 L-02细胞用含体积分数为10%胎牛血清的RPMI-1640培养基在37 ℃,5% CO2恒温培养箱中培养,2 ~ 3 d换新培养基。90%融合度后用胰酶消化,取对数生长期的细胞进行实验。根据课题组前期实验获得的DNA损伤、细胞活力、细胞凋亡和细胞周期的检测结果[2],实验分组设置HQ浓度分别为0(阴性对照组)、10、20、40和80 μmol/L,共5个实验组,处理时间为24 h。
1.3.2透射电镜检测自噬体形成 用胰酶消化收集细胞,移至1.5 ml离心管中,加1 ml PBS离心2次,弃上清液,加入电镜固定液,室温固定细胞4 h。PBS洗涤2次,用4 ℃预冷的体积分数为0.01锇酸固定2 h,PBS洗涤3次,体积分数为0.5、0.7、0.8、0.9、1.0的乙醇和体积分数为1.0的丙酮梯度脱水,环氧树脂浸透、包埋,切片,醋酸双氧铀-柠檬酸铅双重染色,使用透射电镜观察拍照。
1.3.3mCherry-GFP-LC3B融合蛋白来示踪自噬形成 根据说明书,通过查阅文献[3]及预实验确定腺病毒最佳感染浓度及时间,确定腺病毒感染浓度为40感染复数(multiplicity of infection,MOI),感染时间为24 h。在24孔板中接种5×104个细胞,24 h后每孔加入50 μl的AdPlus-mCherry-GFP-LC3B试剂,转染24 h。腺病毒成功转染后,用不同剂量HQ处理细胞,至处理时间终点,用Laica倒置荧光显微镜观察拍照[4]。用Image J软件计数荧光颗粒数,每个处理组至少随机计数10个转染成功的细胞。
1.3.4Western blot检测LC3、Beclin-1、P62表达 细胞处理时间终点时,用含1 mmol/L PMSF 和1 mmol/L蛋白酶抑制剂的RIPA裂解液提取细胞总蛋白,用BCA法测定总蛋白浓度。按照SDS-PAGE凝胶配方表制备12%分离胶和5%浓缩胶。以每泳道15 μg总蛋白上样,随后凝胶电泳,并转移到PVDF膜上。用5%的脱脂奶粉将膜封闭1 h,加入LC3A/B (1 ∶500)、Beclin-1(1 ∶1 000)、P62 (1 ∶1 000)、GAPDH(1 ∶2 000)一抗,在4 ℃下孵育过夜。至第2天,室温下用二抗(1 ∶10 000)孵育1 h,随后进行化学发光拍照。分析条带光密度值,利用目的蛋白的光密度值与内参光密度值的比值作为分析结果。
1.3.5免疫荧光检测LC3、Beclin-1、P62亚细胞定位及表达 在24孔板中接种5×104个细胞做细胞爬片,到处理时间终点,用4%多聚甲醛固定细胞,用含体积分数0.3% Trion X的5% BSA通透及封闭1 h。分别加入LC3B(1 μg/ml)、Beclin-1(1 ∶200)、P62(1 ∶50)一抗在4 ℃下孵育过夜,至第2天,加入抗兔荧光二抗,湿盒中孵育1 h,DAPI复染5 min。在载玻片上滴加抗荧光淬灭剂,取出细胞爬片,有细胞的一面与载玻片接触,并用指甲油固定爬片。用共聚焦显微镜观察拍照。

2 结果
2.1 HQ对L-02细胞自噬形成的影响低倍镜下(×1 500),对照组细胞中较少观察到自噬相关结构或细胞器。而在HQ处理组中,胞质出现大量空泡,细胞呈蜂窝状,伴有自噬样改变。高倍镜下(×15 000)可以观察到HQ处理组细胞中存在大量双膜结构,内含待降解的细胞器成分的自噬体,未和自噬体融合的溶酶体以及自噬末期出现的单层膜的自噬溶酶体,其中包裹的细胞器成分已降解,见图1。
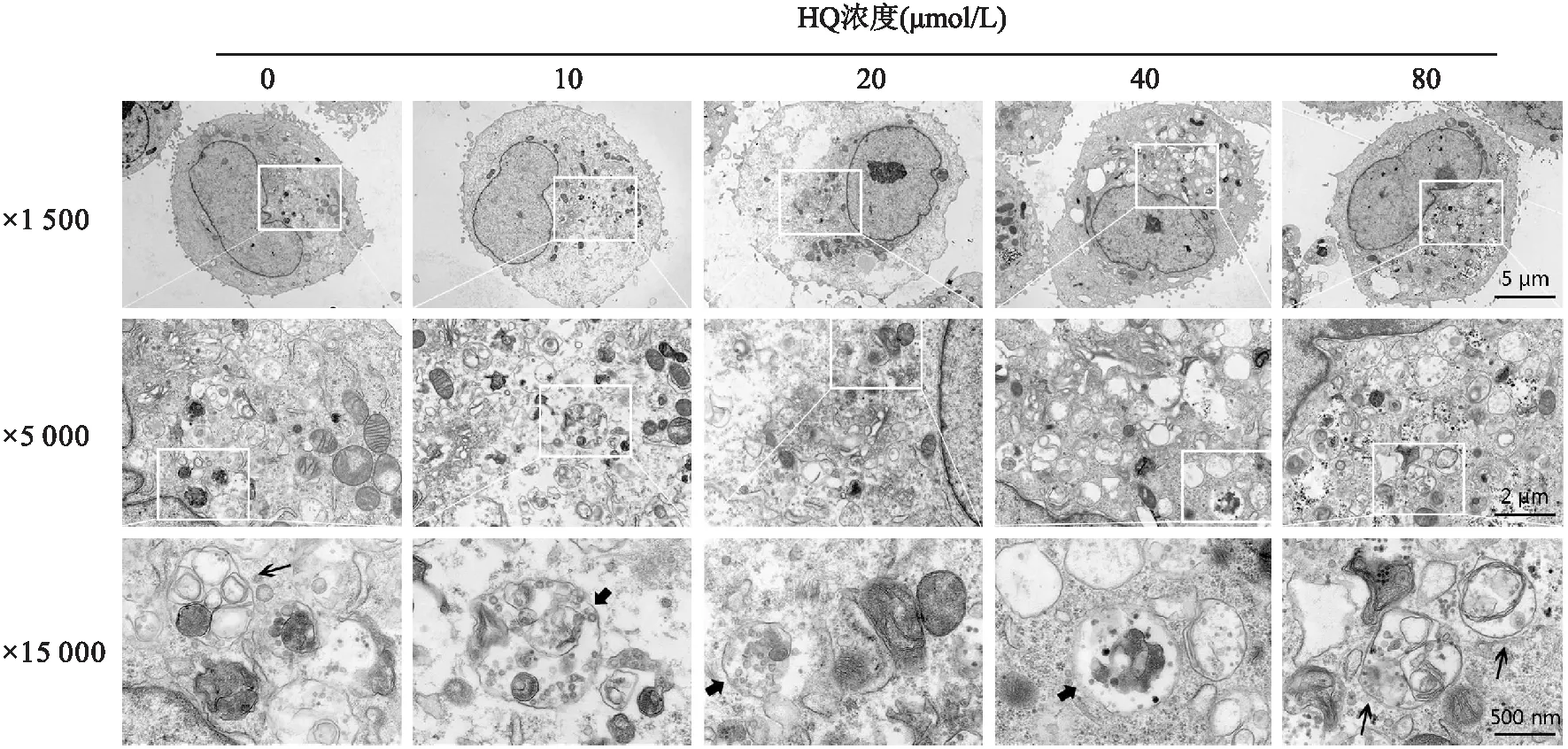
图1 透射电镜检测不同剂量HQ诱导L-02细胞自噬体形成
2.2 HQ对L-02细胞GFP-LC3B融合蛋白形成的影响AdPlus-mCherry-GFP-LC3B是一种重组腺病毒,用于感染细胞后的自噬检测。GFP信号对溶酶体腔内的酸性和/或蛋白水解条件敏感,而mCherry则更稳定。因此,GFP和mCherry荧光的共定位表明自噬体未与溶酶体融合。在非自噬的情况下,mCherry-GFP-LC3B以弥散的黄色荧光形式存在于细胞质中,而在自噬的情况下,GFP-LC3B则聚集在自噬体膜上,以黄色的斑点的形式表现出来,当自噬体与溶酶体融合后,因GFP荧光的部分淬灭而以红色斑点的形式表现出来。实验结果显示,黄色斑点荧光的数量随着HQ作用剂量的升高而增多,而红色的片状斑点有明显减少的趋势,见图2。
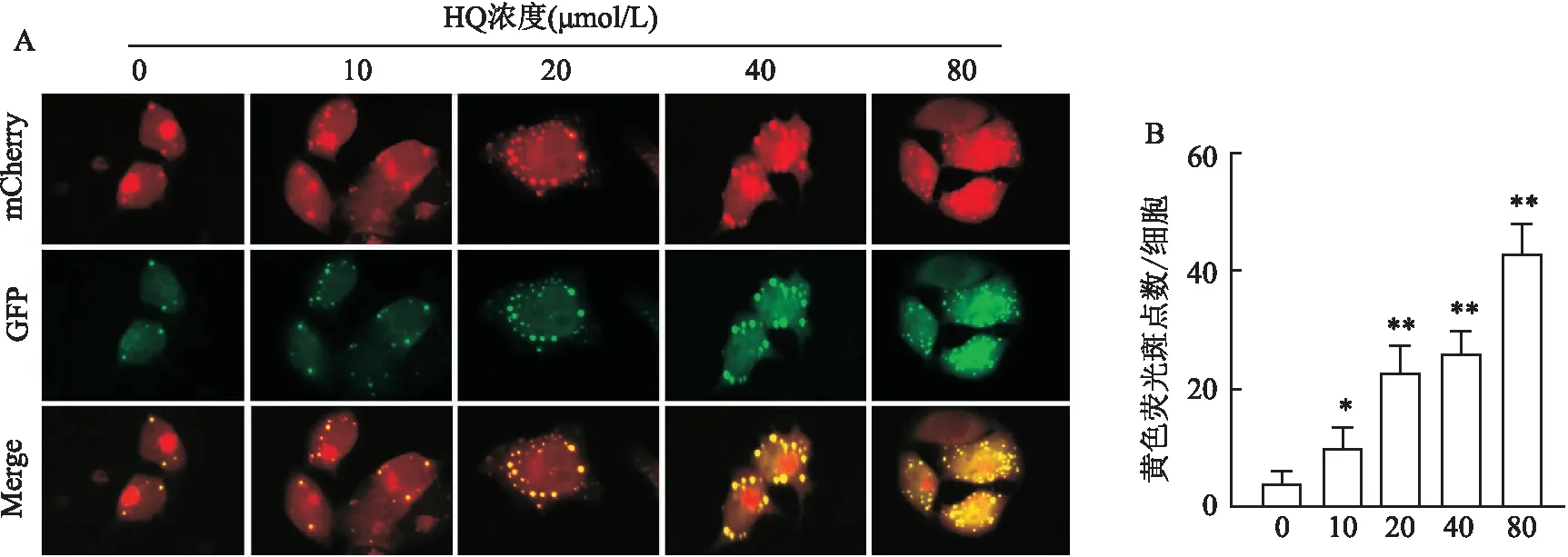
图2 不同剂量HQ对L-02细胞瞬时转染GFP-LC3B表达的影响
2.3 HQ对L-02细胞自噬蛋白表达的影响与对照组比较,HQ处理提高了LC3Ⅱ/LC3Ⅰ(F=6.10,P<0.01)的蛋白质表达水平;但对Beclin-1(F=0.20,P>0.05)和P62(F=1.70,P>0.05)蛋白表达无明显影响,见图3。
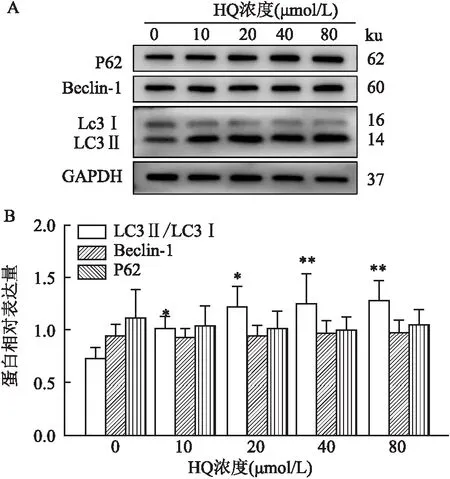
图3 HQ对L-02细胞自噬蛋白表达的影响
2.4 HQ对L-02细胞自噬相关蛋白亚细胞定位的影响免疫荧光结果显示,LC3蛋白在细胞核和细胞质中均有表达,主要分布于细胞核中,HQ处理后LC3在细胞核周围聚集,荧光强度均明显高于对照组;Beclin-1在细胞核和细胞质均有表达,HQ处理组Beclin-1的亚细胞定位及荧光强度与对照组差异无统计学意义;在对照组和低剂量HQ处理组(10、20 μmol/L)中,P62蛋白只在细胞质中表达,而在高剂量HQ处理组中,观察到P62蛋白在细胞质与细胞核中均有表达,见图4。
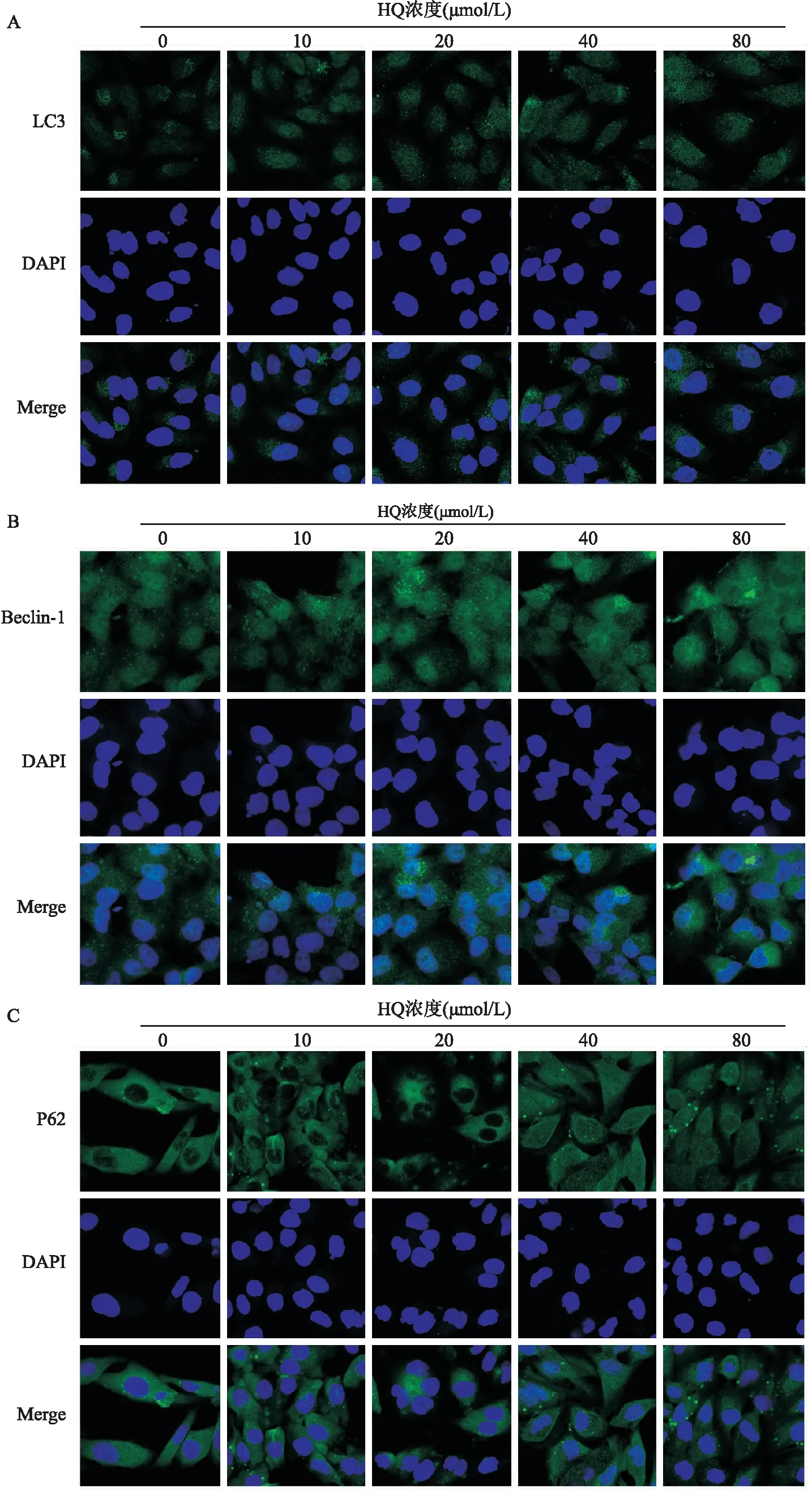
图4 HQ对L-02细胞自噬相关蛋白亚细胞定位的影响 ×630
3 讨论
研究[5]表明,自噬与许多化学物引起的细胞毒性机制如线粒体功能障碍、DNA损伤、氧化应激、内质网改变、溶酶体功能受损和炎症等密切相关。不受调控的自噬严重影响重要的细胞过程,如程序性细胞死亡,从而在许多疾病的发病机制中发挥关键作用。然而,其根本机制目前仍不清楚。HQ已被其他体外实验证明可以在一些细胞中诱导自噬[6-7],而目前HQ对肝细胞的自噬影响及机制尚不明确。在透射电镜下通过测量自噬体的形成研究自噬活性,是最广泛被接受的监测自噬的方法之一[8]。本研究中,电镜下观察到HQ作用L-02细胞后出现自噬样改变,自噬体和自噬溶酶体结构显著增多,证实HQ可以诱导L-02细胞自噬体的生成。mCherry-GFP-LC3B实验结果表明HQ诱导自噬体增多但自噬溶酶体减少,这说明HQ处理可能导致L-02细胞自噬体和溶酶体融合受阻。
自噬过程是动态变化的,而自噬体仅是整个自噬通路过程中的一个中间结构,因此自噬通量检测较单纯自噬体检测更能反映自噬活性。目前,用于监测自噬通量的常用标志物主要有LC3、Beclin-1和P62蛋白。LC3是自噬体膜上的标志性蛋白,在自噬过程中,胞浆型LC3Ⅰ会被泛素化修饰加工成膜型LC3Ⅱ,LC3Ⅱ/LC3Ⅰ的比值变化可以评价自噬体的形成;Beclin-1是自噬启动的核心蛋白之一;而P62则是一种多功能癌基因蛋白,参与了靶向底物进入自噬体的降解过程[9]。本研究结果显示,HQ作用可以显著提高L-02细胞LC3Ⅱ/LC3Ⅰ蛋白的比值,这表明HQ的作用促进了L-02细胞的自噬体生成;而Beclin-1表达未受HQ影响,提示HQ可能通过非Beclin-1依赖途径影响自噬[10]。P62的表达在HQ处理前后都没有明显变化,提示HQ可能没有改变肝细胞的自噬流或自噬状态,但结合本研究的其他结果,P62变化不明显的更可能的解释是HQ作用可能诱使P62的转录活性降低,使其翻译产生的P62蛋白减少,虽然自噬流阻滞减少了P62蛋白的消耗,但表现出细胞内P62蛋白水平没有明显变化,这需要进一步检测P62的转录活性加以证明[11];此外,还可能由于P62参与Ras、Raf、MAPK和NF-κB等信号通路的调节,P62参与的其他细胞过程消耗了因自噬流阻滞所带来的升高部分[12]。免疫荧光实验发现了LC3在细胞核和细胞质均有表达,LC3能够在细胞质和细胞核之间循环,当细胞营养缺乏时,细胞核内的LC3能够被去乙酰化酶SIRT1去乙酰化,促进其回到细胞质中[13]。LC3的核功能可能与其促进自噬降解细胞核纤层元件,诱发细胞衰老,从而防止自身癌变有关[14]。Beclin-1存在于胞浆和核定位,Beclin-1的核定位一般与其非自噬功能相关。此外,本研究还发现高剂量HQ可以诱导L-02细胞内的P62由胞质向胞核转位现象。结果表明,P62可能参与了细胞核内DNA损伤的应答过程[15]。
