石斛多糖DOP-1-1的制备及其体外促进骨形成的机制
2022-09-21申雄成蔡小军董革辉黄家恺张晗祥
申雄成,蔡小军,董革辉,黄家恺,张晗祥,何 斌
骨质疏松症是一种慢性代谢性骨病,主要发生于绝经后妇女和老年人,严重威胁公众健康[1]。目前,预防和治疗骨质疏松的临床药物大部分副作用严重[2]。因此,有必要开发出有效且副作用较小的治疗骨质疏松症药物。近年来,多糖作为一种具有巨大结构多样性和广泛药理活性的生物大分子,在医药界引起了极大的关注[3]。最近研究显示铁皮石斛多糖(dendrobium officinale polysaccharides,DOP)抑制破骨细胞相关基因的表达,并抑制RANKL诱导的破骨细胞分化,表明其可能有助于成骨[4]。然而,DOP中确切的生物活性成分仍不清楚。因此,有必要对DOP进行系统研究,包括活性成分提取、纯化、结构表征和生物活性分析。该研究通过分离纯化DOP得到一种水溶性多糖(DOP-1-1),并对其结构进行表征,然后体外研究其对小鼠前成骨细胞MC3T3-E1细胞的增殖、分化和矿化作用。
1 材料与方法
1.1 材料与化学试剂铁皮石斛购自北京同仁堂(集团)有限责任公司;纤维素DEAE-52和Sephadex G-75购自美国GE Healthcare公司;17β-雌二醇(E2)购自上海阿拉丁生化科技股份有限公司;胰蛋白酶、Ⅱ型胶原酶、FBS和α-MEM购自美国Gibco BRL公司。使用的所有其他试剂均为分析级。
1.2 石斛粗多糖的提取铁皮石斛原球茎 (15.0 kg) 用去离子水以1 ∶10的质量比浸泡6 h,并在90 ℃下提取3次,3 h/次。真空过滤后,合并所有提取物,浓缩,加入95%乙醇至终浓度70%沉淀,静置48 h。以2 000 r/min离心15 min后,获得沉淀并表示为石斛粗多糖。石斛粗多糖的多糖含量通过苯酚-硫酸法测定。
1.3 DOP-1-1的纯化、均一性和分子量测定将石斛粗多糖(1.2 kg)重新溶解在2 L去离子水中,然后移入分液漏斗中,将400 ml Sevag试剂[1-丁醇 ∶三氯甲烷(v/v)=1 ∶4]加入到分液漏斗中并剧烈摇晃。分离和浓缩混合物的上清液,透析(截止相对分子量1 000)并冻干以获得DOP。将10 ml DOP水溶液(25 mg/ml)加载到DEAE-52-纤维素层析柱(ø 2.5×40 cm)上,用去离子水洗脱得到DOP-1。用苯酚-硫酸法得到洗脱曲线。浓缩后,将主要部分进一步加载到Sephadex G-75凝胶柱(ø 1.6×100 cm)上,用蒸馏水洗脱得到DOP-1-1,得率为17.2%,多糖含量为81.4%。
在配备Waters 2414示差折光检测器(美国Waters公司)的Agilent 1260 HPLC系统(美国Agilent公司)上通过高效凝胶渗透色谱法 (HPGPC) 测量DOP-1-1的均匀性和分子量。使用TSK-GEL G-5000PWXL凝胶柱(日本Tosoh Biosep公司),双蒸水作为流动相,流速为0.4 ml/min。使用葡聚糖T系列标准品(葡聚糖T400、T300、T200、T125、T45、T20、T10和T5)绘制标准曲线,用于计算DOP-1-1的相对分子量。
1.4 DOP-1-1的化学结构分析将干燥的KBr(140 mg)和DOP-1-1 (2 mg) 的混合物研磨并压成颗粒。使用FT-IR光谱仪记录DOP-1-1在4 000~400 cm-1波数范围内红外光谱图。
DOP-1-1(5 mg)在2 ml三氟乙酸(3 mol/L)中120 ℃水解6 h,释放单糖成分,减压蒸发。然后,将水解样品用1-苯基-3-甲基-5-吡唑啉酮(PMP)衍生化,并在配备ZORBAX Eclipse XDB C18色谱柱(4.6 mm×250 mm,5 μm)的Agilent 1260 HPLC系统进行分析。此外,标准单糖的混合物也进行了类似的处理。
对DOP-1-1进行多次甲基化,直至通过红外光谱仪检测到反应产物的羟基伸缩带消失。将DOP-1-1(8 mg)溶于5 ml二甲基亚砜(DMSO),然后与DMSO-NaOH溶液(600 mg NaOH溶于5 ml DMSO)混合。随后,样品在冰浴中冷却,缓慢滴加500 μl CH3I,超声处理0.5 h(3次)。DOP-1-1的甲基化产物在2 ml、3 mol TFA 中于120 ℃水解6 h,在40 ℃下用20 mg硼氢化钠还原30 min,最后用2 ml吡啶和2 ml乙酸酐在95 ℃下反应1 h,得到部分甲基化的糖醇乙酸酯,最后在GC-MS系统(GCMSQP 2010,日本Shimadzu公司)上分析以确定糖苷键的类型。
1.5 核磁共振波谱分析DOP-1-1(60 mg)溶解在750 μl D2O中,并以9 000 r/min离心5 min。在Bruker AV-500光谱仪(德国Bremen公司)上进行核磁共振(NMR)光谱分析,1H NMR和13C NMR频率分别为500 MHz和125 MHz。此外,使用Bruker软件提供的标准脉冲序列和参数记录二维(2D)NMR光谱(HSQC和HMBC)。
1.6 DOP-1-1对MC3T3-E1细胞增殖的影响MC3T3-E1细胞接种在常规生长培养基(α-MEM培养基,含有10% FBS、100 U/ml青霉素和100 μg/ml链霉素),并置于37 ℃、5% CO2加湿培养箱中培养。使用CCK-8试剂盒评估DOP-1-1对MC3T3-E1细胞增殖的影响。将MC3T3-E1细胞稀释至1×104个/ml,接种到96孔板上并培养24 h,然后加入不同浓度DOP-1-1(0.5、1.0、2.0、4.0和8.0 μmol/L),再培养48 h。此外,孔中分别加入或不加入0.1 μmol/L E2作为阳性或空白对照。加入CCK-8(日本Dojindo Kumamoto公司)溶液(10 μl/孔)后,将细胞培养板进一步孵育1 h。最后,用微孔板分光光度计在450 nm处读取每个孔的吸光度。根据以下公式计算增殖率(W):W=(Asample-Ablank)/Ablank×100%,其中A是5次重复实验的平均吸光度。
辅助系统是船舶轮机内部重要构成部分,在进行船舶轮机检查时,要将该系统作为重点检查对象,以便在辅助系统正常工作下,为轮机功能发挥提供保障。辅助系统以供给系统为主,能起到储存和供应油料的作用。待使用的船舶油料可储存在系统内。在船舶航行过程中,油料经过燃油管道传输到船舶,是保证船舶航行任务有效完成的关键。这一系统的缺陷,体现在滑油舱缺陷、燃油舱缺陷以及运输管道缺陷等方面,在检验时应加大这方面的检查,确定缺陷产生原因并提出具体应对措施。例如,当燃油舱和滑油舱之间缺少有效的隔离措施时,这两种油会混合在一起,从而出现船舶轮机运行故障,不能支持船舶良好航行。
1.7 DOP-1-1对MC3T3-E1细胞分化的影响将MC3T3-E1细胞(1.5×105个/ml)接种在24孔培养板上并培养48 h。然后,将培养基改变为含有常规生长培养基的骨质发生分化培养基(osteogenic differentiation medium,ODM),其含有10 mmol/L β-甘油磷酸盐和50 μg/ml抗坏血酸。将细胞分为以下几组:对照组(仅加入ODM),阳性对照组(加入含有0.1 μmol/L E2的ODM),以及不同浓度DOP-1-1处理组(加入含有不同浓度DOP-1-1的ODM)。在第8天,分别使用碱性磷酸酶检测试剂盒(上海Beyotime公司)和BCA蛋白质定量试剂盒(美国Sigma公司)测定ALP活性和总蛋白质含量,然后将ALP含量标准化。
1.8 DOP-1-1对MC3T3-E1细胞矿化的影响参考文献方法[5],监测DOP-1-1对MC3T3-E1细胞钙化沉积物的影响。将细胞(1.5×105个/ml)接种到12孔培养板上并培养72 h。将细胞分为以下几组:对照组(仅加入ODM),阳性对照组(加入含有0.1 μmol/L E2的ODM),以及不同浓度DOP-1-1处理组(加入含有不同浓度DOP-1-1的ODM)。培养20 d后,用10%福尔马林固定细胞30 min,并用1.0%茜素红S染色30 min。将细胞冲洗后,获得MC3T3-E1细胞的钙化沉积物的图像。最后,每个孔加入10%(v/v)氯化十六烷基吡啶鎓,通过微孔板分光光度计在562 nm下检测吸光度值,以定量钙化沉积物。
1.9 Western blot测定将MC3T3-E1细胞接种到6孔培养板上(6×104个/ ml)并培养48 h,将培养基替换为ODM。然后用4.0 μmol/L DOP-1-1处理细胞6 d。收集细胞,加入RIPA缓冲液(美国Thermo公司)裂解,并使用BCA蛋白质测定试剂盒测定蛋白质浓度。将相等量的蛋白质裂解物加载到10%SDS-PAGE凝胶上进行分离,然后转移到聚偏二氟乙烯(PVDF)膜(美国Millipore公司)中。将膜在3% BSA中封闭2 h,用含有0.1%吐温20的PBS洗涤,并在4 ℃下与Pin1(1 ∶1 000)、BMP2 (1 ∶1 000)、RUNX2 (1 ∶1 000)和GAPDH(1 ∶2 000)一抗孵育过夜,均购自英国Abcam公司。12 h后,将膜与HRP缀合的二抗孵育60 min,并通过增强化学发光检测条带,使用Image J 软件对蛋白质水平进行光密度测定。

2 结果
2.1 DOP-1-1的分离纯化、均一性、分子量和化学结构分析图1A显示了DOP-1-1的HPGPC谱图,显示了一个单一且对称的峰,表明DOP-1-1是均一的多糖。根据标准曲线,DOP-1-1的平均相对分子量计算值为3 611。图1B中显示了FT-IR光谱分析鉴定DOP-1-1的特征官能团。DOP-1-1的-OH和C-H拉伸振动引起3 390 cm-1和2 930 cm-1的吸收带,-OH变形振动引起1 628 cm-1和1 384 cm-1的吸收带,1 200~1 000 cm-1范围内的所有吸收带表明存在吡喃糖环。在DOP-1-1的IR光谱中存在933 cm-1和761 cm-1的吸收带均归化吡喃糖的不对称拉伸振动。图2显示了DOP-1-1的单糖组成分析的HPLC光谱。与标准单糖的保留时间比较,DOP-1-1由甘露糖、葡萄糖和半乳糖组成。通过水解DOP-1-1的甲基化产物并乙酰化,得到部分甲基化阿尔迪醇乙酸酯(partially methylated alditol acetates,PMAA)。GCMS是一种分析PMAA的强大工具,可以提供有关DOP-1-1的糖苷酰基信息,见表1。
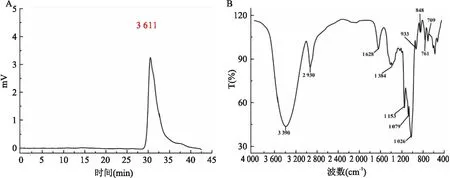
图1 DOP-1-1的分离纯化、均一性、分子量和化学结构分析
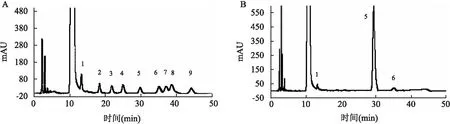
图2 DOP-1-1的单糖组分分析
2.2 DOP-1-1的核磁共振波谱分析在DOP-1-1的HSQC光谱中,在5.32/99.7、5.14/91.8、4.89/98.5、5.26/100.0和4.59/95.7 ppm处观察到5个相关峰异谱区(图3A)。上述分析结果表明,DOP-1-1中有5个糖残基,分别命名为A、B、D、E和F,与甲基化和GC-MS分析结果一致。因此,通过GC-MS分析和NMR分析相结合,获得了残基A、B、D、E和F的质子和碳化学位移,见表2。最后,对DOP-1-1的HMBC谱进行了分析,以获得糖残基间的连锁位点和序列信息。A残基在HSQC谱的异谱区显示出最强的相关信号,两个强相关峰位于HMBC光谱中5.32/76.9和3.58/99.7 ppm处,见图3B。同时,GC-MS分析表明(1→4)键合葡萄糖占总糖残量的63.6%。因此,根据所有证据,确认A残基为(1→4)-连接葡萄糖。此外,交叉峰在4.89/67.1(DH1/EC6)、5.32/70.2(AH1/DC6)、4.89/70.2(DH1/DC6)、3.58/95.7(AH4/FC1)、3.77/99.7(FH3/AC1)、3.74/76.9(FH6/AC4)、5.14/99.7(BH1/AC1)和3.58/100.0(AH4/EC1)ppm,表明E残基的C-6与D残基的O-1相连,D残基的C-6与A残基的O-1相连,D残基的C-6与D残基的O-1相连,F残基的C-1与A残基的O-4相连,A残基的C-1与F残基的O-3相连,A残基的C-4与F残基的O-6相连,残基A的C-1与残基B的O-1相连,残基E的C-1与残基A的O-4相连。最后,通过相对分子量、单糖分析、甲基化分析和NMR数据的组合,得到DOP-1-1的推测结构,见图4。

图3 DOP-1-1的核磁共振波谱分析

图4 DOP-1-1的预测结构
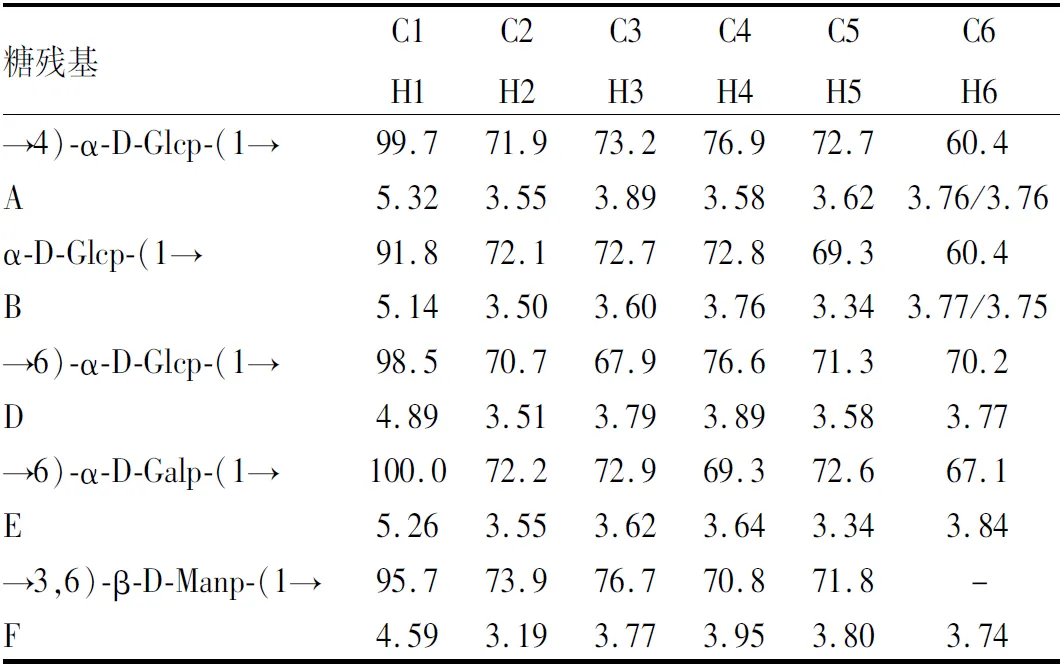
表2 DOP-1-1在D2O中记录的1H和13C NMR化学位移
ALP活性被广泛认为是成骨细胞分化的重要早期标志物。如图5B所示,与正常组比较,对照组的ALP活性增加(t=11.678,P<0.001),表明成骨培养基可以成功诱导MC3T3-E1细胞的分化。与对照组比较,E2和DOP-1-1(4.0、8.0 μmol/L)均显著提高ALP活性(t=7.480、4.583、9.417,P<0.01)。特别是,DOP-1-1(8.0 μmol/L)的ALP活性高于阳性对照E2(t=3.542,P=0.025)。

图5 DOP-1-1对MC3T3-E1细胞增殖和分化的影响(n=3)
2.4 DOP-1-1对MC3T3-E1细胞矿化的影响矿化结节的形成是成骨细胞的主要功能。如图6A所示,与正常组比较,对照组中矿化结节的存在表明成骨培养基可以成功诱导MC3T3-E1细胞的矿化。与对照组比较,E2和DOP-1-1(2.0、4.0和8.0 μmol/L)提高了矿化率(t=7.144、6.920、14.315、7.367,P<0.001 );并且DOP-1-1(4.0、8.0 μmol/L)的矿化率高于阳性对照E2组(6.532、3.477,P<0.05),见图6B。因此,DOP-1-1表现出成骨矿化作用,甚至优于阳性对照E2。因此,选择4.0 μmol/L的DOP-1-1用于以下研究。
为了探索DOP-1-1对MC3T3-E1细胞的成骨分化作用,通过蛋Western blot分析成骨相关蛋白质的表达。如图6C、D所示,与正常组比较,对照组Pin1、BMP2、RUNX2蛋白表达增加(t=3.312、3.015、2.742,P=0.025、0.030、0.037),而DOP-1-1组Pin1、BMP2、RUNX2蛋白表达高于对照组(t=2.904、4.612、4.831,P=0.032、0.007、0.004)。
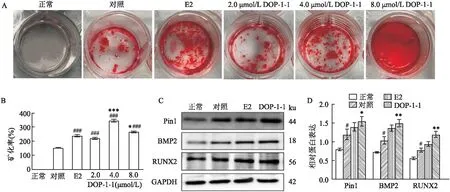
图6 DOP-1-1对MC3T3-E1细胞矿化的影响(n=3)
3 讨论
先前研究[4]证实,DOP抑制破骨细胞相关基因的表达和相关通路蛋白的合成,抑制RANKL诱导的BMMs的破骨细胞分化,表明DOP可能有助于成骨。因此,为了进一步确认DOP的生物活性成分,本研究从DOP中系统分离纯化获得了一种均质多糖(DOP-1-1),其相对分子量为3 611。由于结构与活性密切相关,因此研究进一步通过单糖分析、红外光谱、甲基化分析、GC-MS和核磁共振光谱的组合研究了DOP-1-1的结构。首先,单糖组成是多糖最基本的信息,PMP柱前高效液相色谱法是测定单糖组成的经典方法之一[6]。先前的研究[7]表明,成骨活性多糖通常含有甘露糖和半乳糖成分。本研究表明,DOP-1-1也含有甘露糖和葡萄糖。甲基化/GC-MS分析可以得到糖残基的组成和相应的百分比。基于单糖组成分析和甲基化分析,核磁共振谱分析可以进一步提供质子和糖残基的碳化学位移、连接位点和序列[8]。因此,本研究首次确定了DOP-1-1的结构特征。
MC3T3-E1细胞是与成骨细胞分化和矿化相关的研究模型,因为它可以分化并形成含有骨标志物的矿化良好的基质,如I型胶原蛋白、ALP和骨唾液蛋白[5]。本研究分析显示,DOP-1-1在低浓度下促进MC3T3-E1细胞增殖、分化,其促进作用甚至优于E2。此外,DOP-1-1处理的细胞的矿化率增加,甚至比阳性对照E2更好。因此,DOP-1-1可以促进体外成骨细胞的分化和矿化。
Pin1/ BMP2信号通路在激活骨形成基因转录中起重要作用[9]。Pin1作为骨细胞分化的主协调器,是一种专门识别磷酸化丝氨酸或苏氨酸与脯氨酸之间肽键的酶。最近研究发现,Pin1-/-小鼠出现发育性骨缺损和矿化减少[10]。BMP2是TGF-β超家族的成员,在成骨细胞中高度表达并在体外和体内调节成骨细胞分化[11]。BMP-2可通过激活SMAD1/5/8触发多能间充质细胞分化为成骨细胞谱系[12]。RUNX2对成骨细胞分化和骨形成至关重要,RUNX2通过激活包括骨唾液蛋白、骨桥蛋白和骨钙素在内的末端成骨标记基因,触发前成骨细胞分化为成骨细胞[13]。本研究中,DOP-1-1组Pin1、BMP2、RUNX2蛋白表达增加,甚至比阳性对照E2更好,表明DOP-1-1可能通过激活Pin1增加BMP2的表达和转录活性,BMP2的表达增加随后刺激了下游骨标记基因RUNX2激活,促进了骨形成。
多糖的结构特征如分子量、单糖组成、糖残基类型等,对其生物活性具有重要影响和特殊意义。研究表明,低分子量(分子量<5 000) 多糖通常表现出相当大的成骨活性[14]。这项研究表明DOP-1-1具有低分子量(3 611),并且还表现出更强的成骨活性。低分子量分子在体内应用中具有更多优势,因为它们更容易被吸收。此外,从牛膝和仙茅中分离的多糖的成骨活性显示出主要存在葡萄糖、甘露糖、阿拉伯糖和半乳糖[15]。因此,葡萄糖、甘露糖、阿拉伯糖和半乳糖被确定为与成骨活性相关的单糖。本研究发现这些单糖都出现DOP-1-1中,这可能是DOP-1-1具有更强成骨活性的原因。然而,DOP-1-1更精确的构效关系仍有待进一步研究。
综上所述,本研究首次确定了DOP-1-1的初步结构,并发现其体外能促进MC3T3-E1细胞的增殖、分化和矿化,作用机制与激活Pin1/BMP2信号通路相关。所有上述研究都表明DOP-1-1是一种潜在的天然抗骨质疏松药物,可用于药物治疗。
