基于增材制造技术的GelMA/HA水凝胶支架的制备及其研究
2022-09-21刘重远邹多宏
刘重远,蒋 勇,邹多宏
骨移植修复手术是临床上治疗骨缺损常用的方法,但仍受诸多限制,如取材困难、操作要求高、排斥反应大等[1]。近年来,增材制造,又称3D打印,为制备拟填充支架提供了新方法,它可根据骨缺损的形状打印出尺寸匹配的修复支架,同时调控支架内部结构,满足个体化修复的需求[2]。甲基丙烯酸酯化明胶(gelatin methacryloyl,GelMA)是明胶经改性而得的一种生物源性材料,具有出色的生物相容性、温敏性和可降解性,作为打印墨水广泛应用于3D打印领域[3]。羟基磷灰石(hydroxyapatite, HA)是临床医学上常用的合成骨替代物,常与有机聚合物形成复合支架,应用于骨组织工程的研究[4]。该研究以GelMA和HA为结构单元,通过增材制造技术构建有机/无机复合支架,对其理化性能及生物相容性进行表征和测试,旨在探索其作为填充支架应用于个体化骨缺损修复的可行性。
1 材料与方法
1.1 复合水凝胶支架的合成材料壳聚糖(高粘度,脱乙酰度≥95%,上海阿拉丁生化科技股份有限公司);明胶(美国Sigma-Aldrich公司);甲基丙烯酸酐(上海麦克林生化科技有限公司);羟基磷灰石(生物医药级,纯度≥98%,上海阿拉丁生化科技股份有限公司);光引发剂——苯基-2,4,6-三甲基苯甲酰基磷酸锂盐(lithium phenyl-2,4,6-trimethylbenzoylphosphinate,LAP,苏州永沁泉智能设备有限公司)。
1.2 主要的试剂与仪器MEM-α培养基(以色列BI公司);磷酸盐缓冲液(phosphate buffered saline,PBS,以色列BI公司);胎牛血清(美国Gibco公司);CCK-8试剂盒(日本同仁化学研究所);Calcein-AM/PI活/死细胞双染试剂盒(日本同仁化学研究所);BCIP/NBT碱性磷酸酯酶显色试剂盒(上海碧云天生物技术有限公司);生物3D打印机(Bio-Architect®WS,杭州捷诺飞生物科技股份有限公司);扫描电镜(Supra 40,德国Zeiss公司);透射电镜(HT7700,日本Hitachi公司);酶标仪(美国Biotek公司);倒置荧光显微镜(Axio Observer 3,德国Zeiss公司)。
1.3 原料合成GelMA前体合成称10 g明胶放入圆底烧瓶中,再加入90 ml PBS溶液,置入磁力搅拌器,烧瓶外用铝箔纸包裹严密,在50 ℃ 下的水浴中搅拌1~2 h。待溶液澄清透明后,增大转速,用玻璃滴管逐滴加入6 g甲基丙烯酸酐,反应8 h。反应结束,将溶液倒入离心管,配平,离心取上清液(3 500 r/min,3 min),弃除杂质。将上清液倒入透析分子量12 ku的透析袋内,于40 ℃ 的超净水内进行透析,每天换水2次,避光,直至气味完全消失。将上述透析完成的溶液的pH(1 mol/L NaHCO3)调节至7.4,分装,冷冻(-20 ℃),转移冷冻样至冻干机中,使凝胶完全干燥(7 d),-20 ℃ 下避光储存。
1.4 复合水凝胶支架的制备将12%的GelMA溶液与2%的HA按1 ∶1的比例混匀,形成生物墨水加入打印料筒内,在温度为0 ℃ 的收集平台上打印复合支架。打印速率为50 mm/s,针嘴内径为0.34 mm,每层Z轴上升高度为250 μm,打印间距为1 mm。打印完成后进行光固化 (紫外光405 nm,3 min),获得GelMA/HA复合水凝胶支架。见图1。
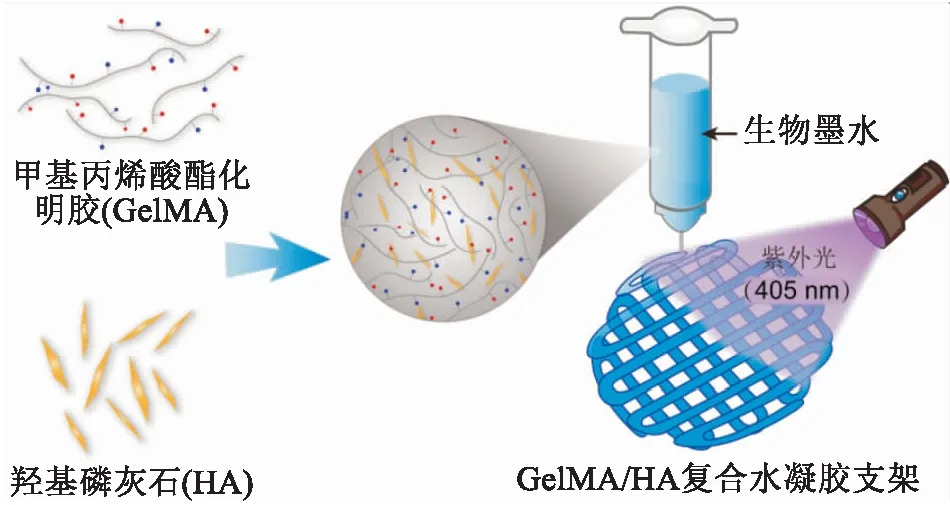
图1 GelMA/HA复合水凝胶支架制备过程示意图
1.5 微观表征将复合支架放入真空冻干机冷冻干燥24 h,于液氮中脆断得到样品。选择断面整齐的样品,导电胶将其固定于样品台侧面,于低真空度的蒸金室中蒸金30 s,通过扫描电镜(scanning electron microscope,SEM)观察其结构特征。取HA/乙醇稀释溶液分散至透射铜网表面,完全干燥后,通过透射电镜 (transmission electron microscope,TEM)观察HA形态。
1.6 力学性能测试制备尺寸为10 mm×10 mm×5 mm 的纯GelMA水凝胶支架和GelMA/HA复合水凝胶支架,通过万能力学试验机进行单向压缩试验,负载为10 N,压缩速率为1 mm/min,测试样品的弹性模量。
1.7 大鼠骨髓间充质干细胞 (bone marrow stem cells, BMSCs)的分离与培养选取2~4周龄、体质量20~25 g的SD大鼠,颈椎脱臼法处死,浸泡于75%乙醇中15 min。无菌条件下取股骨及胫骨内的骨髓,使用含双抗 (105U/L青霉素、100 mg/L链霉素) 及20%胎牛血清的MEM-α培养基放置到温度为37 ℃ 并含5%CO2的培养箱中进行培养,每3 d换液一次;待细胞数量达80%左右后,用0.25%胰酶消化液进行消化,按1 ∶2或1 ∶3比例传代,用含10%胎牛血清的MEM-α培养基进行培养,每2 d更换培养基。重复以上操作,待细胞传至2~4代后待用。
1.8 细胞相容性检测通过Live/Dead荧光染色评估细胞活力:制备直径为10 mm,厚度为1.5 mm的圆柱形GelMA/HA复合支架,浸泡于75%乙醇中30 min,紫外365 nm灭菌30 min。灭菌后加入到48孔板中,每孔加入 5×104个BMSCs,37 ℃ 分别培养1、3、7 d。PBS洗涤,加入配置好的Calcein-AM/PI染色试剂,在37 ℃和5%CO2的培养箱中孵育30 min后,PBS冲洗5次,每次5 min。倒置荧光显微镜下观察,活细胞呈绿色,死细胞呈红色。通过CCK-8试剂盒测定细胞增殖:将纯GelMA、GelMA/HA复合支架制备成直径为6 mm,厚度为1 mm的圆柱形样品,每组12个。灭菌后4个每组分别置于3个96孔板中,BMSCs铺板,每个时间点设3个复孔,空白组仅接种BMSCs,纯GelMA水凝胶支架组接种纯GelMA支架,GelMA/HA复合水凝胶支架组接种GelMA/HA复合支架。37 ℃ 分别培养1、3、7 d。将CCK-8试剂与MEM-α以1 ∶10的比例混合,每孔加入110 μl混合试剂,放入37 ℃ 培养箱继续培养2 h,随后取出用酶标仪测量其在450 nm处的吸光度值。
1.9 细胞SEM表征将细胞与复合支架共培养3 d后取出样品,PBS洗涤,用 4%多聚甲醛固定30 min,并在去离子水中充分漂洗。吸净水分,加入叔丁醇浸没样品2 h,使其脱水。最后,换新的叔丁醇,置于真空冷冻干燥器干燥。SEM下观察复合支架上细胞的形态。
1.10 水凝胶支架的促成骨性向MEM-α培养基加入10%胎牛血清、10-4mol/L维生素C、10-8mol/L地塞米松和0.01 mol/L β-甘油磷酸钠制备得到成骨诱导培养基。将纯GelMA支架和GelMA/HA复合水凝胶支架在37 ℃ 下浸没于成骨诱导培养基中24 h,制备浸提液。6孔板中每孔铺入8×104个BMSCs,在生长培养基中培养1 d后,换浸提液继续培养。培养基每3 d更换一次,空白组细胞在生长培养基中培养。经过7 d的成骨诱导,4%多聚甲醛固定细胞,PBS洗涤,采用BCIP/NBT碱性磷酸酯酶显色试剂盒进行ALP染色并通过光学显微镜进行观察。采用Image J软件对染色面积进行数据分析。
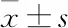
2 结果
2.1 GelMA/HA复合水凝胶支架表征复合水凝胶支架是通过在低温平台上以层层叠加的方式沉积生物墨水,经过紫外光照射3 min 后制备而成(图2A)。照片显示复合水凝胶支架呈乳白色,多孔网格状,结构清晰稳定(图2B)。SEM可见复合水凝胶支架内部成层状结构,支架柱上有大小不一的球形孔(图2C),HA颗粒分散于孔壁上(图2D)。TEM显示HA颗粒呈明显的层片状结构(图2E)。

图2 GelMA/HA复合水凝胶支架的结构表征
2.2 水凝胶支架的力学性能纯GelMA水凝胶支架组的弹性模量为(47.0±4.7)kPa,而GelMA/HA复合水凝胶支架组弹性模量为(245.3±24.5)kPa,差异有统计学意义(P<0.05),表明HA的引入提高了复合支架的抗压缩性能。
2.3 水凝胶支架的生物相容性倒置荧光显微镜下观察,培养1 d后可见BMSCs存活于GelMA/HA复合水凝胶支架内部,形态呈圆形;7 d后,可见复合支架上的BMSCs增殖,伸展呈梭形,表明GelMA/HA对BMSCs的生长无明显影响(图3A)。选取纯GelMA支架和GelMA/HA支架进行细胞增殖实验,与BMSCs共培养3、7 d的纯GelMA水凝胶支架组及GelMA/HA复合水凝胶支架组的吸光度值均高于空白组(P<0.05),表明复合支架有良好的生物相容性,并且可促进BMSCs的增殖(图3B,表1)。与复合水凝胶支架共培养3 d后,BMSCs在支架上铺展良好(图3C)。

图3 GelMA/HA复合水凝胶支架的生物相容性
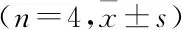
表1 各组支架与BMSCs共培养不同时间后吸光度值的比较
2.4 水凝胶支架对BMSCs成骨分化的影响选择纯GelMA支架、GelMA/HA复合支架的浸提液进行ALP染色实验,光镜下显示GelMA/HA复合水凝胶支架组ALP 染色阳性面积高于纯GelMA水凝胶支架组和空白组,差异有统计学意义(P<0.05),表明复合水凝胶支架对BMSCs的成骨分化具有促进作用。见图4。

图4 成骨诱导7 d的ALP染色观察
3 讨论
随着组织工程的快速发展和深入研究,生物支架材料作为自体骨的替代物在骨修复研究领域越来越受到关注,尤其是3D打印水凝胶支架。与传统的骨组织支架材料比较,水凝胶支架模拟了骨基质中的有机相,同时为细胞生长提供了机械支撑,并且多孔的结构有助于气体和营养物质在支架内互相交换,有利于细胞的生长[5-6]。此外,增材制造技术的引入降低了制备过程的复杂性,可以快速制造出各种与骨缺损形状适配的水凝胶支架,印刷效果好,为个体化修复提供了坚实基础。
本课题组拟将GelMA和HA混合,通过超声破碎,使HA在GelMA体系中充分分散,形成均匀的复合生物材料墨水,增加生物墨水的粘度,增强水凝胶细丝的可控性,提高制备水凝胶支架的印刷仿真性和机械性能,更好的适配于骨缺损。微观结构表征显示GelMA/HA复合水凝胶支架呈清晰的层层叠加的网状结构,内部无塌陷,具有良好的稳定性。力学性能测试结果显示添加了HA的复合水凝胶支架的弹性模量与纯GelMA支架比较,增加了4倍,提升了抗压缩性能,可见其有助于在骨缺损空间提供支撑作用。叔丁醇真空干燥法是制备SEM生物样品的常用方法,其以叔丁醇作为升华介质,将样品置于真空中进行干燥,既保留了冷冻干燥法的优点,又对样品无冷冻损伤,操作简单,且制备的生物样品的各项指标均较理想[13]。经叔丁醇真空干燥法制备的样品在SEM下清晰地展示了BMSCs在复合支架上呈铺展的生长状态。GelMA/HA复合水凝胶支架具有良好的生物相容性,并且促进了BMSCs的增殖,可能是由于GelMA保留了明胶中促进细胞黏附的精氨酸-甘氨酸-天冬氨酸序列[14]。复合支架的多孔结构有助于气体和营养物质在支架内的运输也可能是促进细胞生长的另一个重要原因。同时HA的加入赋予了支架生物活性,ALP染色实验结果显示GelMA/HA复合水凝胶支架组的ALP染色面积增加,表明可促进BMSCs成骨分化。
