p100Rb和p80Rb过表达对细胞周期和凋亡的影响
2022-09-21李彩红刘建军范礼斌
李 强,李彩红,周 恒,乔 兵,刘建军,范礼斌
视网膜母细胞瘤(retinoblastoma,RB)是一种早发的儿童恶性肿瘤,是由基因突变导致的[1],基因分析表明RB的发生与RB1基因的突变有关[2]。RB1基因由27个外显子和26个内含子组成,定位于13q14上,全长178 143 bp, 编码序列(coding sequence,CDS)全长2 787 bp,编码928个氨基酸[3]。RB1基因编码的Rb蛋白含有3个结构域,即N端结构域、A/B口袋结构域和C端结构域[4]。Rb蛋白在细胞内磷酸化的程度与其生物学功能密切相关,例如低磷酸化或非磷酸化状态的Rb可与E2F1结合形成复合物,阻止E2F1转录因子的释放,使得E2F1介导的进入S期所必需的基因无法表达;而当Rb蛋白被CDK与周期蛋白复合物作用转变为超磷酸化状态时,Rb-E2F1复合物解离,释放的E2F1作为转录因子调控下游靶基因的表达[5]。此外,Rb蛋白在细胞的凋亡、染色质重塑等方面也有重要的作用[6]。已经发现在依托泊苷诱导的细胞凋亡过程中,Rb被caspase裂解,去除掉C端的42个氨基酸残基,产生一个100 ku的蛋白p100Rb[7]。在人骨肉瘤细胞Saos-2中也发现了一种突变的Rb蛋白p80Rb,其转录本与野生型Rb相比缺失了编码C端的21~27外显子[8]。目前尚无p100Rb和p80Rb相关生理功能的报道。为此,该研究构建了pcDNA3.1-p100Rb-FLAG和pcDNA3.1-p80Rb-FLAG真核表达载体,并过表达于HEK 293T细胞中,拟确定它们对细胞周期和凋亡的影响。
1 材料与方法
1.1 材料
1.1.1质粒、菌株与细胞 pcDNA3.1-RB1-FLAG和pcDNA3.1真核表达载体、TG1菌株、HEK 293T细胞均为安徽医科大学生命科学学院范礼斌实验室自存,U2OS细胞购于中国科学院上海细胞库。
1.1.2主要仪器 Gelx-1620凝胶成像分析系统(上海欧翔科学仪器有限公司);Axio Observer倒置荧光显微镜(德国Zeiss公司);PTC-1148小型梯度PCR仪(上海伯乐生命医学产品有限公司);BSC-Ⅱ级生物安全柜(美国Thermo公司);光吸收酶标仪(美国Molecular Devices公司);CytoFlex流式细胞仪、Microfuge 20R高速冷冻离心机(美国Beckman公司)。
1.1.3主要试剂 胎牛血清(美国Clark公司);DMEM培养基(澳洲Hyclone公司);Opti-MEM低血清培养基、McCoy′s5a培养基(美国Thermo Fischer Scientific公司);胰酶细胞消化液(含EDTA)、Western细胞裂解液、苯甲基磺酰氟(PMSF)、一抗稀释液、Lipofectamine 8000脂质体转染试剂(上海碧云天生物技术有限公司);改良型Bradford法蛋白浓度测定试剂盒、BamHⅠ、XhoⅠ限制性内切酶、T4连接酶(上海生工生物有限公司);DNA聚合酶(日本Takara公司);胶回收、质粒小抽试剂盒(美国Axygen公司); 0.2 μm PVDF膜(美国BIO-RAD 公司);FLAG抗体F1804(美国Sigma公司);辣根酶标记山羊抗鼠IgG(北京中杉金桥生物有限公司);Annexin Ⅴ-FITC细胞凋亡试剂盒(上海贝博生物科技有限公司);细胞周期PI染液(美国BD公司)。
1.2 方法
1.2.1质粒构建 实验所用PCR引物由通用生物系统(安徽)有限公司合成,序列见表1。以pcDNA3.1-RB1-FLAG真核表达质粒为模板,PCR扩增出含有FLAG标签的p80Rb和p100Rb的CDS序列。PCR产物经琼脂糖凝胶电泳后,利用胶回收试剂盒获得纯化的PCR产物。纯化的PCR产物或pcDNA3.1载体用BamH Ⅰ和Xho Ⅰ限制性内切酶双酶切,酶切后的PCR产物和pcDNA3.1载体用T4连接酶连接,并用连接产物转化TG1感受态细胞。转化的感受态细胞置于含氨苄抗性的LB固体培养基中37 ℃培养约10 h,分别挑取数个单克隆至含有氨苄抗性的LB液体培养基中扩大培养约12 h,质粒抽提后,用BamH Ⅰ和Xho Ⅰ限制性内切酶进行酶切鉴定,最后测序酶切正确的重组质粒。
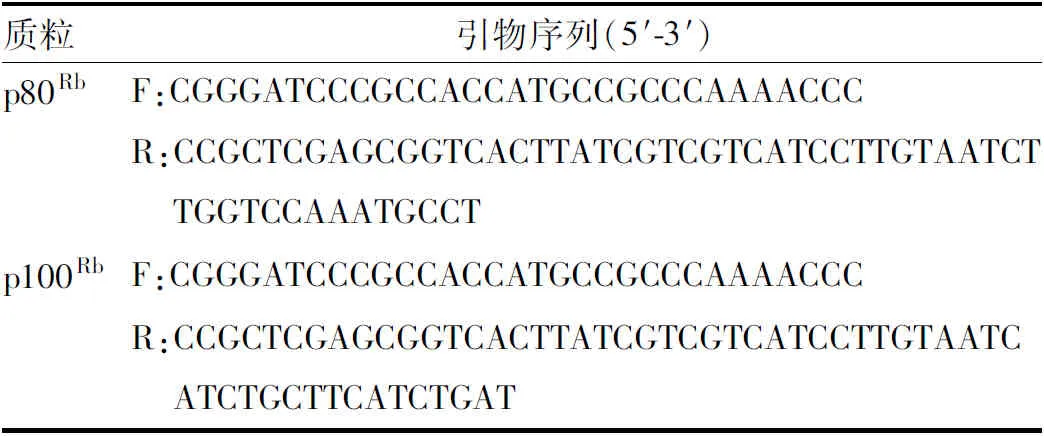
表1 PCR引物序列表
1.2.2细胞培养 U2OS细胞使用含有10% FBS的McCoy′s5a培养基(100 U/ml青霉素+100 μg/ml链霉素)在37 ℃、5% CO2的恒温培养箱中进行培养;HEK 293T细胞使用含有10% FBS的DMEM培养基(100 U/ml青霉素+100 μg/ml链霉素)。37 ℃、5% CO2的恒温培养箱中进行培养。
1.2.3质粒瞬时转染 将1×106个细胞接种于6孔板中,待细胞密度达到约70%~80%时,更换新鲜完全培养液。在无菌离心管中依次加入125 μl Opti-MEM®Medium、2.5 μg质粒DNA、4 μl Lipo8000TM转染试剂,充分混匀后分别均匀滴入上述细胞培养孔内,轻轻混匀。细胞培养48 h后用于蛋白表达和流式细胞术分析,培养24 h后用于免疫荧光观察。
1.2.4间接免疫荧光显微术 取出有U2OS细胞盖玻片,用预冷的PBS溶液清洗,-20 ℃预冷的甲醇固定10 min,封闭液(1%脱脂奶粉的TBST溶液)室温封闭30 min,一抗溶液(1 ∶100)室温孵育2 h,TRITC标记的二抗溶液(1 ∶100)室温孵育1 h,DAPI染细胞核5 min,最后将盖玻片固定至载玻片上,4 ℃保存过夜后,荧光显微镜观察。
1.2.5Western blot检测 收集细胞沉淀并置于冰上裂解,20 min后收集蛋白裂解液,14 000 r/min离心20 min,收集上清液并测定蛋白含量,取适量蛋白上清液加入5×SDS上样缓冲液,100 ℃变性7 min、冰浴3 min后,进行SDS-PAGE电泳,252 mA恒流电转1.5 h将蛋白转移至PVDF膜上,转移后的PVDF膜用含5%脱脂奶粉的TBST溶液室温封闭1.5 h,加入相应的一抗4 ℃孵育过夜,二抗室温孵育1.5 h,最后用ECL试剂盒显色并在化学发光仪(Gelx-1620)上进行显影。
1.2.6细胞周期 离心收集的细胞沉淀用预冷的PBS溶液清洗,逐滴加入500 μl预冷的70%乙醇 -20 ℃ 固定过夜,离心收集细胞,预冷的PBS溶液清洗,加入500 μl PI染液,4 ℃避光孵育15 min后用流式细胞仪检测细胞周期,不同时相的细胞百分比用FlowJo软件分析。
1.2.7细胞凋亡 离心收集的细胞沉淀用预冷的PBS溶液清洗,再用400 μl AnnexinV溶液与密度为106个/ml的悬浮细胞孵育,再加入5 μl Annexin V-FITC 染色液,4 ℃避光孵育15 min后,加入10 μl PI染色液4℃避光孵育5 min,立即用流式细胞仪检测细胞凋亡率,用FlowJo软件分析凋亡率。
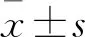
2 结果
2.1 p100Rb和p80Rb真核表达载体的构建利用BamH Ⅰ和Xho Ⅰ限制性内切酶对构建的pcDNA3.1-p100Rb-FLAG和pcDNA3.1-p80Rb-FLAG质粒进行酶切鉴定,结果见图1A。图中可见,构建的质粒含有插入片段,而对照载体没有。酶切鉴定正确的质粒经测序,证明构建质粒的插入片段是正确的,见图1B、C。

图1 pcDNA3.1-p100Rb-FLAG和pcDNA3.1-p80Rb-FLAG重组质粒的酶切鉴定与测序结果
2.2 p100Rb和p80Rb在U2OS细胞中的荧光定位分别转染pcDNA3.1-p80Rb-FLAG和pcDNA3.1-p100Rb-FLAG至U2OS细胞,转染后24 h将盖玻片取出并进行免疫荧光制片,荧光显微镜下观察p100Rb和p80Rb在U2OS细胞中的分布。结果表明p100Rb均主要分布在细胞核中,而p80Rb分布细胞质且聚集在核膜侧,见图2。
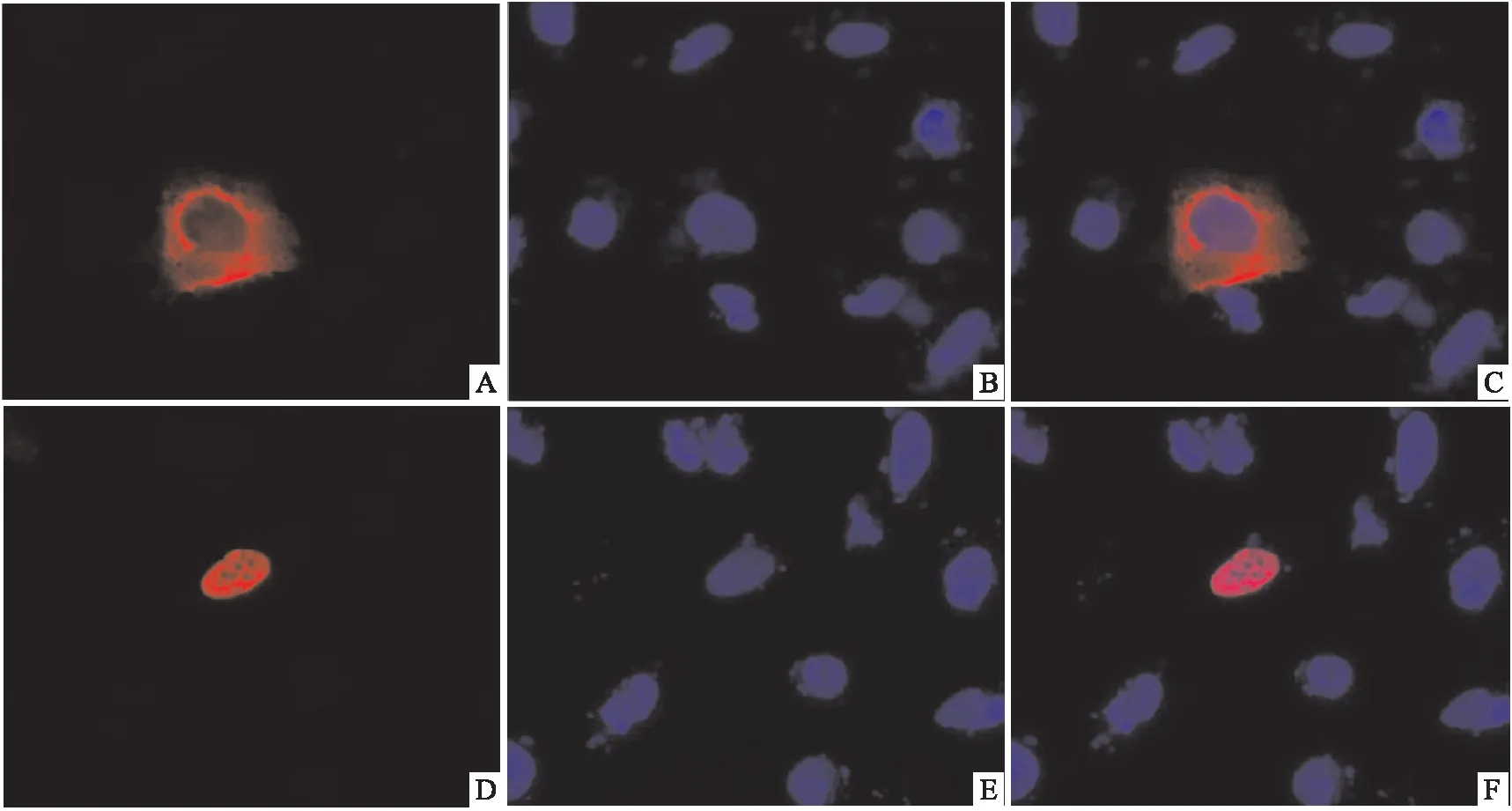
图2 p100Rb和p80Rb在U2OS细胞中的荧光定位图 ×400
2.3 p100Rb和p80Rb在HEK 293T细胞中的过表达将pcDNA3.1-RB1-FLAG,pcDNA3.1-p100Rb-FLAG和pcDNA3.1-p80Rb-FLAG真核表达质粒瞬时转染至HEK 293T细胞中,转染后48 h收集细胞并裂解,进行Western blot检测。结果可见Rb、p100Rb和p80Rb分子量相应的条带,而对照组(未处理和转染pcDNA3.1载体的细胞裂解液)未见任何条带,表明Rb、p100Rb和p80Rb在HEK 293T细胞中可以表达,见图3。
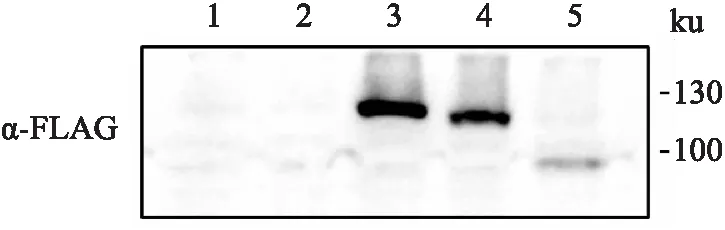
图3 p100Rb和p80Rb在HEK 293T细胞中的过表达
2.4 p100Rb和p80Rb对HEK 293T细胞周期的影响分别将pcDNA3.1-RB1-FLAG,pcDNA3.1-p100Rb-FLAG,pcDNA3.1-p80Rb-FLAG和pcDNA3.1转染至HEK 293T细胞中,约48 h后收集细胞,分别进行PI单染,然后流式细胞仪检测细胞周期(表2)。与pcDNA3.1载体对照组比较,Rb和p100Rb过表达组G1期百分比升高,差异有统计学意义(P<0.05);p80Rb过表达G1期百分比无明显变化,差异无统计学意义(P>0.05)。表明过表达的Rb和p100Rb使HEK 293T细胞周期阻滞在G1期,而过表达的p80Rb对HEK 293T细胞周期无影响,见图4。
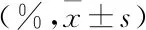
表2 p100Rb和p80Rb对HEK 293T细胞周期的影响
图4 p100Rb和p80Rb过表达后HEK 293T细胞的细胞周期图
2.5 p100Rb和p80Rb对HEK 293T细胞凋亡的影响分别将pcDNA3.1-RB1-FLAG,pcDNA3.1-p100Rb-FLAG,pcDNA3.1-p80Rb-FLAG和pcDNA3.1转染至HEK 293T细胞中,约48 h后收集细胞,分别进行Annexin Ⅴ-FITC/PI双染,然后流式细胞仪检测凋亡(表3)。结果表明,与pcDNA3.1载体对照组比较,Rb、p100Rb和p80Rb过表达组细胞凋亡率降低,差异有统计学意义(P<0.05),表明Rb、p100Rb和p80Rb能够有效抑制HEK 293T细胞的凋亡,见图5。
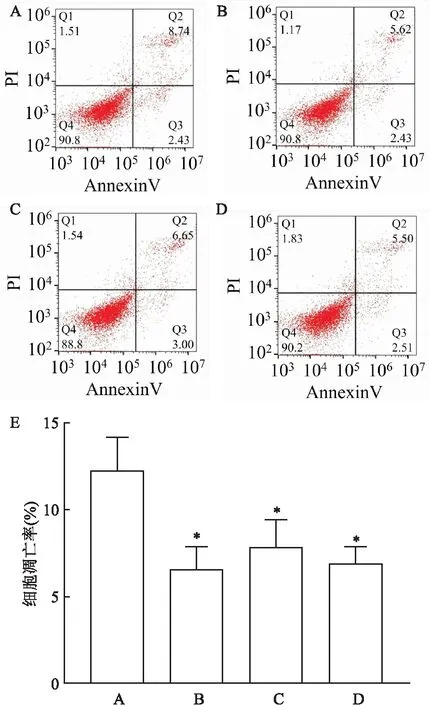
图5 p100Rb和p80Rb过表达后HEK 293T细胞的凋亡图

表3 Rb截短体对细胞的影响
3 讨论
现已经发现Rb蛋白不仅在细胞周期调控方面起关键的作用,而且在染色质重塑、凋亡、衰老以及分化等方面也具有重要的作用[9]。细胞凋亡是细胞程序性死亡的过程,可诱导蛋白质水解和DNA断裂[10]。用凋亡诱导剂依托泊苷处理后,Rb的C端 42个氨基酸被caspase切割产生p100Rb的截短体[7]。另外,早期的研究[8]表明Saos-2细胞中没有全长的Rb蛋白,但是含有一个Rb蛋白的缺失突变体p80Rb(缺失21~27外显子)。Rb蛋白定位于细胞核,其核定位信号为羧端的860KRSAEGSNPP KPLKKLR876[11]。p100Rb含有这个核定位序列,但p80Rb缺失这个序列,本研究结果也表明p100Rb定位在细胞核,而p80Rb定位在细胞质。Rb蛋白的口袋结构域可与E2F1结合,调控细胞周期的进程[12]。口袋结构域中的T373和S608/S612的磷酸化可导致与Rb蛋白结合的E2F1释放出来,E2F1刺激进入S期的相关基因的表达,从而促进细胞进入S 期[12]。p100Rb含有完整Rb口袋结构域,能与E2F1结合;而p80Rb不含有完整的口袋结构域,不能与E2F1结合[7-8]。本研究结果表明p100Rb阻滞细胞周期进程,而p80Rb对细胞周期进程没有影响,原因可能是前者能结合E2F1,而后者不能结合E2F1。
E2F1不仅能够与Rb蛋白结合调控细胞周期的进程,还具有诱导细胞凋亡的功能[13]。研究发现E2F1不仅与口袋结构域结合,还可与Rb的C末端825~860氨基酸区域结合,该部位与E2F1诱导的凋亡反应有关[14]。本研究结果表明p80Rb和p100Rb抑制凋亡,而两个截短体C端均缺失了E2F1的结合部位,提示它们的抗凋亡作用并不是通过E2F1进行的。近年来,发现Rb也可定位于线粒体,并通过与凋亡蛋白Bax的结合,直接诱导线粒体介导的凋亡[15]。p80Rb和p100Rb抑制凋亡表明这两个蛋白可能并不与Bax结合。
综上所述,过表达p100Rb阻滞HEK 293T细胞周期且抑制凋亡;过表达p80Rb对HEK 293T细胞周期无影响但可抑制凋亡。
