动脉瘤性蛛网膜下腔出血介入治疗后慢性意识障碍的危险因素
2022-09-21王如海杨东升胡海成
韩 超 王如海 张 成 杨东升 于 强 胡海成
阜阳师范大学附属第二医院,安徽 阜阳 236000
通信作者:胡海成
动脉瘤破裂性蛛网膜下腔出血(aneurysmal subarachnoid hemorrhage,aSAH)是导致中枢神经系统原发性和继发性损伤并产生较为严重生理、病理改变的急性脑动脉血管疾病,是导致患者重残,甚至死亡的重要因素[1]。动脉瘤破裂出血不仅对脑实质造成原发性损伤,如合并颅内血肿、破入脑室系统,还可引起脑积水、脑血管痉挛、脑细胞水肿等继发性脑细胞损伤,以及引起体内各项炎症指标及生化指标的变化,导致患者预后差异较大[2],特别是造成慢性意识障碍(prolonged disorders of consciousness,pDoC),对患者家庭和社会造成极大的负担。
慢性意识障碍是指各种原因致脑组织严损伤后意识丧失≥28 d 的意识障碍[3],一般认为丘脑-皮层网络和皮层-皮层网络等大脑网络通路的破坏是意识障碍的主要原因[4]。pDoC 包括植物状态(vegetative state,VS)和 微 意 识 状 态(minimally conscious state,MCS)[5]。临床实践表明,植物状态患者意识恢复较困难,微意识状态则有较好的恢复潜力。近年来,动脉瘤的介入治疗越来越被人们接受,影响介入栓塞治疗预后的因素较多,预后存在不确定性。aSAH患者介入治疗与pDoC的相关性研究尚无报道,本研究对阜阳师范大学附属第二医院2019-05—2022-03 治疗的102 例aSAH 经介入治疗后出现pDoC患者的临床资料进行回顾性分析,探讨自发性蛛网膜下腔出血后介入治疗出现pDoC 的危险因素及相关因素对pDoC的预测价值。
1 资料与方法
1.1 纳入与排除标准纳入标准:(1)2019-05—2022-03阜阳师范大学附属第二医院经头颅CT检查已确诊存在自发性蛛网膜下腔出血的患者;(2)行数字减影血管造影(DSA)或头颅CTA检查确诊并行介入治疗的患者;(3)本研究符合《赫尔辛基宣言》原则,所有患者或其家属签署知情同意书。
排除标准:(1)自发性蛛网膜下腔出血经DSA或CTA 检查未发现动脉瘤;(2)脑外伤、破裂的脑血管畸形或肿瘤出血等其他原因致患者意识障碍合并蛛网膜下腔出血患者;(3)既往有意识障碍、凝血功能障碍、肝肾衰竭等严重基础疾病者;(4)破裂动脉瘤行开颅动脉瘤夹闭术及颅内血肿清除术患者;(5)发病28 d内死亡或再次发生脑卒中的患者。
1.2 收集资料纳入102例aSAH患者,收集患者行介入治疗术前各项临床资料,主要包括:年龄、性别、发病时间、入院时Hunt-Hess 分级、白细胞计数及血清葡萄糖与钾的浓度比值、血浆白蛋白、动脉瘤直径、是否合并急性脑积水、脑出血破入脑室系统、合并颅内血肿、28 d后不同医师参照昏迷恢复量表-修订版(coma recovery scale-revised,CSR-R)各项评分标准对患者进行评分,CRS-R 评分为慢性意识障碍患者(pDoC 组)21 例,非pDoC 组81 例。患者术前均行头颅CTA 检查,入院后根据临床症状进行Hunt-Hess 分级:Ⅰ级4 例,Ⅱ级45 例,Ⅲ级30 例,Ⅳ级13例,V级10例。患者临床特征见表1。
1.3 治疗方法患者入院后评估手术指征,102 例患者均行经股动脉穿刺颅内动脉瘤弹簧圈栓塞术或颅内动脉支架辅助弹簧圈栓塞术治疗,其中单独行弹簧圈栓塞术61 例(59.8%),颅内动脉支架辅助弹簧圈栓塞术41 例(40.2%),合并急性脑积水急诊行脑室外引流术26 例(25.4%),术前及术后按动脉瘤破裂伴蛛网膜下腔出血治疗指南给予脱水降颅压、预防脑血管痉挛、预防癫痫等规范化治疗。
1.4 评判标准所有患者通过住院时体格检查或复查获得28 d 后的意识情况,发病后持续≥28 d 意识丧失判定为pDoC。采用CRS-R 量表进行意识评定,1 名主治医师、1 名副主任医师分两次评定入院时GCS评分,取平均值。意识丧失的具体评定方法:①VS:听觉评分≤2 分,视觉评分≤1 分,运动评分≤2分,言语评分≤2分,交流评分0分,唤醒度≤2分;②MCS:听觉3~4分,视觉2~5分,运动3~5分,言语3分,交流1分,唤醒3分。
1.5 统计学方法采用SPSS 26.0 进行统计分析。计数资料采用百分率(%)描述,组间比较行χ2检验;计量资料以均数±标准差(±s)表示,组间比较行t检验。使用单因素和多因素Logistic回归分析,以评估血清葡萄糖与血清钾的比值、Hunt-Hess分级等各变量与是否形成pDoC 这一因变量之间的关系。以急性脑积水、颅内血肿等独立危险因素为检验变量,以pDoC 为状态变量,利用Medcalc(版本19.0.2)软件绘制ROC,同时计算曲线下面积。P<0.05 为差异有统计学意义。
2 结果
2.1 单因素分析单因素分析显示,年龄、性别、发病时间、血浆白蛋白、动脉瘤直径、发病时间差异无统计学意义(P>0.05),术前血清葡萄糖和钾的比值、白细胞计数、血糖、脑出血破入脑室、Hunt-Hess 分级、急性脑积水、颅内血肿是pDoC 形成的可能危险因素(P<0.05),见表1。

表1 102例aSAH患者临床资料单因素分析Table 1 Univariate analysis of clinical data of 102 aSAH patients
2.2 预测pDoC的多因素Logistic 回归分析 对上述单因素分析中P<0.05 的因素进行多因素二元Logistic回归分析,结果显示,Hunt-Hess分级、急性脑积水、颅内血肿等为pDoC 的独立影响因素(均P<0.05)。见表2。

表2 预测慢性意识障碍的多因素Logistic回归分析Table 2 Multivariate Logistics regression analysis of risk factors in predicting prolonged disorders of consciousness
2.3 危险因素对预后的预测价值以Hunt-Hess 分级、急性脑积水、颅内血肿为检验变量,以pDoC为状态变量绘制ROC 曲线。Hunt-Hess 分级的AUC 为0.895(95%CI:0.818~0.947,P<0.001),约登指数为0.4893,敏感度76.20%,特异度91.4%。急性脑积水、颅内血肿、Hunt-Hess 分级联合预测预后的AUC 为0.924(95%CI:0.855~0.967,P<0.001),敏感度85.71%,特异度91.36%。见表3、图1。
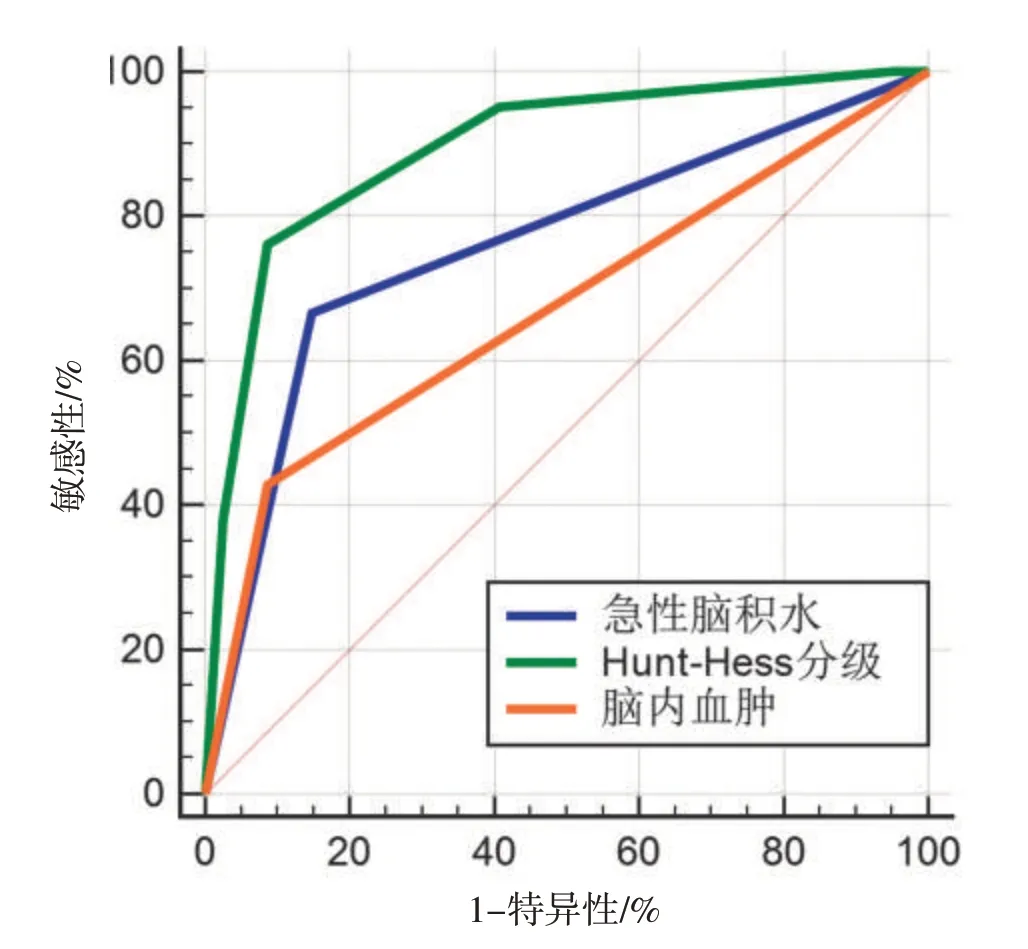
图1 不同危险因素对慢性意识障碍预测能力的受试者特征工作曲线Figure 1 ROC of the predictive power of different risk factors for prolonged disorders of consciousness
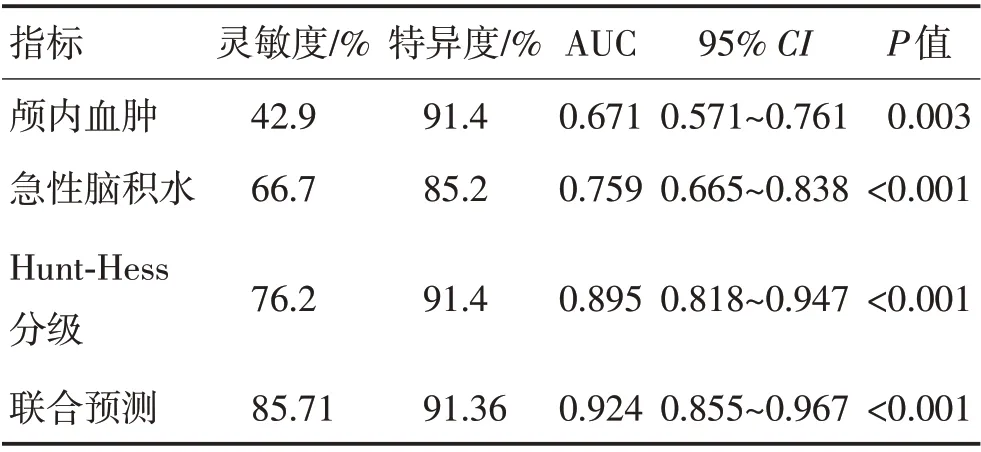
表3 危险因素预测慢性意识障碍的曲线下面积Table 3 Area under the curve of risk factors predicting prolonged disorders of consciousness
3 讨论
动脉瘤性蛛网膜下腔出血是自发性蛛网膜下腔出血(subarachnoid hemorrhage,SAH)的最常见原因,约占85%[6]。脑动脉瘤破裂血液进入蛛网膜下腔并随脑脊液循环充满脑脊液,常合并颅内血肿以及脑室内积血、脑积水等,伴随不同程度的意识障碍及神经功能缺失[7],表现为不同级别的Hunt-Hess 分级。由于aSAH患者病情复杂,在经介入治疗后仍伴随多种影响预后的危险因素。特别是重症患者,同样选择介入治疗的aSAH 患者,预后存在不同的结局,aSAH 患者中约50%死亡,约15%重度残疾,只有20%~35%的患者预后良好[8]。有报道指出,aSAH患者血清葡萄糖和钾的比值、白细胞计数、血糖、Hunt-Hess 分级等与预后有相关性[9]。这些因素与pDoC可能存在一定的关系,而从患者术前各种危险因素中寻找出具有代表性的因素预测pDoC 发生的概率尤为重要。
本研究显示,颅内动脉瘤破裂致颅内血肿形成是pDoC的独立危险因素,本次研究排除了因颅内血肿量较多需行开颅手术的病例,共收集蛛网膜下腔出血合并颅内血肿的病例16例(42.9%),形成pDoC9例(56.3%),发生的概率较高。动脉瘤破裂致颅内血肿的原因可能与以下因素有关:一方面,少量蛛网膜下腔出血致破裂动脉瘤壁炎性反应,炎性细胞浸润增多[10],使动脉瘤体周围的蛛网膜粘连、重叠,影响动脉瘤突然破裂后血流的冲击方向,造成不同部位的颅内血肿或硬膜下血肿;另一方面,颅内动脉瘤破裂口主要位于瘤体尾部较多,形成脑实质血肿的动脉瘤体尾部大多向脑组织生长[11],颅内血肿造成脑组织实质性损害及相邻脑组织的压迫性损害,大量颅内血肿破入脑室时,往往形成较严重的压迫症状及脑室铸型,进而导致术后脑血管痉挛及脑积水,引起脑组织的缺血缺氧[12]。本研究未对不同部位的血肿做统计分析,但有研究显示,侧裂内血肿(interhemispheric subdural hematomas,ISH)、脑实质内血肿(intracerebral hem orrhage,ICH)与预后WFNS 分级量表、GCS 分级指标差异不明显,可能与大部分ISH 血肿量小于ICH 组血肿量有关[13]。有文献指出aSAH合并血肿患者预后差,颅内血肿量与患者预后成反比关系,患者血肿量越大病情越危重[14],支持本次研究结果。
急性脑积水是aSAH 严重并发症之一,是影响aSAH患者pDoC的独立危险因素。本研究中出血破入脑室系统35 例,形成急性脑积水26 例,占脑室系统出血74.3%,较其他文献报告的脑室内积血中25%~55%[15]的病例继发脑积水更高,说明脑室积血是急性脑积水的主要因素,其发生机制尚不完全明确,可能与脑脊液在循环通路中的分泌增加、循环梗阻以及吸收障碍有关[16]。动脉瘤破裂出血后血液进入蛛网膜下腔及脑室系统,血液成分刺激脉络丛分泌脑脊液增加,进入脑室的血液凝聚成血凝块阻塞室间孔、中脑导水管、第四脑室出口等脑脊液循环通路,造成脑脊液循环不畅,脑脊液中红细胞促进释放大量的炎性因子,进而引起蛛网膜下腔纤维化,造成蛛网膜颗粒对脑脊液吸收障碍,最终导致脑室内脑脊液分泌大于吸收,从而形成脑积水[17]。即使手术治疗,其对预后也有一定影响,脑积水症状长期的改善率仅25%[18],可能是因急性脑积水导致颅内压急速增高、脑灌注压降低、脑细胞水肿,增加了脑血管痉挛、脑缺血的概率。研究表明,未及时处理的脑积水严重损害了神经系统,降低了患者的辨别能力和预后生存质量[16],影响患者预后。因此,在保证脑灌注压的前提下尽可能控制血压,防止更多的血液进入脑室及蛛网膜下腔,并通过腰穿、腰大池持续引流等尽快促进脑脊液血液成分减少,及时处理脑积水可以改善患者预后,减少pDoC的发生。
本研究显示,患者术前高级别Hunt-Hess分级与pDoC 的发生密切相关,为其独立危险因素,与国内其他文献[19]报道一致。术前低级别的Hunt-Hess 分级预示着手术效果较好,而高级别Hunt-Hess分级者手术预后较差,可能原因是蛛网膜下腔出血量大,多伴有脑室出血、颅内血肿,且手术难度大,术后脑血管痉挛、再出血等并发症的发生率高[20]。本研究还显示,Hunt-Hess分级越低,手术效果越好,形成pDoC概率越低。有文献报道,早期手术干预能显著降低病死率及伤残率[21]。
本研究显示,较高级别的Hunt-Hess分级合并急性脑积水及颅内血肿导致pDoC 形成的概率更高。入院时高Hunt-Hess 分级的患者预示直接或间接脑组织损伤更加严重,急性脑积水导致颅内压升高,脑血流灌注不足,两者之间产生相互影响,与国外文献[22]报道一致。颅内血肿合并急性脑积水可能导致高Hunt-Hess分级,可能因颅内血肿直接造成脑组织损伤并继发周围脑细胞水肿,且血肿占位效应导致颅内压进步一步增高,甚至形成脑疝,加深了患者意识障碍[23],增加了pDoC发生的概率。
本研究还纳入aSAH 患者术前血清葡萄糖和钾的比值、白细胞计数、血糖、脑出血破入脑室等多个可能造成继发性脑损害的因素,结果显示,上述因素对aSAH 介入术后形成pDoC 可能有影响。KASIUS等[24]研究报道,入院时血白细胞计数升高增加患者发生不良预后的危险性。FUJIKI 等[25]的研究认为,患者的不良预后与血糖、血糖/钾比值呈显著正相关。另一研究[26-39]显示,继发性脑室出血是脑出血患者不良预后的独立因素。但上述因素未进入本次研究的多因素回归方程,可能与本研究中pDoC患者数量较少有关。
aSAH 患者较高级别的Hunt-Hess 分级、合并急性脑积水、颅内血肿可能与介入术后pDoC 有关,联合发生对于pDoC 有更高的预测价值,应尽早干预,降低患者出现pDoC的概率,改善患者预后。本研究为回顾性分析,动脉瘤性蛛网膜下腔出血的样本较少,其发生pDoC 的病例及影响因素分析较少,尚需积累资料进一步探讨。
