基于Dual RNA-seq分析的褪黑素影响萝卜与链格孢菌互作的作用研究
2022-09-21李经纬黄廷敏祖贵东陆芳丽屈立武张万萍
李经纬 夏 铭 黄廷敏 祖贵东 陆芳丽 屈立武 张万萍,*
(1 贵州大学蔬菜研究院,贵州 贵阳 550000;2 贵州大学农学院,贵州 贵阳 550000;3 威宁县农业农村局,贵州 毕节 551700;4 贵州省农业信息中心,贵州 贵阳 550000)
萝卜(RaphanussativusL.)是重要的十字花科蔬菜,其可持续性生产受芸薹链格孢菌(Alternariabrassicae)引起的黑斑病的威胁[1],发病时植株各部位形成黑褐色、具同心轮纹的近圆形病斑,严重影响萝卜光合同化效率和商品性[2]。链格孢菌适应力强、传播快,目前主要依赖化学药剂防治,但大量使用化学农药不利于产业绿色发展,因此应积极探索绿色防控方法。
褪黑素(melatonin,MT)最早发现于牛松果体[3],是广泛存在于生物界的生长调节物质[4-8],主要作用于昼夜节律[9-10]、抗氧化[11-15]和抗逆[11,16-19]调节。在诱导逆境抗性方面,MT可显著提高葫芦科(Cucurbitaceae)作物对黄粉菌(Podsphaeraxanthii)和疫霉菌(Phytophthoracapsici)的抗性[17],以及通过介导水杨酸(salicylic acid, SA)、茉莉酸(jasmonic acid, JA)信号途径调节基因和病程相关蛋白基因表达,提高水稻(OryzasativaL.)对白叶枯病菌(Xanthomonasoryzaepv.Oryzae)的抗性[15];另外,刘建龙[20]证明了MT通过激活PbOPR3转录促进JA合成,最终提高梨(PyrusbretschneideriRehd.)果实对轮纹病的抗性。此外,MT在对微生物生理生化作用上表现出复杂性[21-23]。该物质一方面可促进枝菌根菌(Rhizophagusintraradices)逆境下菌丝体生长发育[24],另一方面会在低剂量下抑制对绿脓杆菌(Pseudomonasaeruginosa)和鲍曼不动杆菌(Acinetobacterbaumannii)增殖[25]。感病植物同时携带植物细胞与病原体,对感病植物喷施MT,该物质同时作用于二者,目前大部分针对MT介导植物抗病的研究集中在植物上,对其影响植物与病原物互作的作用模式研究十分有限。
随着测序和建库技术的提升,以及高通量UTRNAs序列敏感性的增加,促进了“双重RNA序列”的发展[26]。互作转录组测序(Dual RNA-seq)可同时对宿主和病原体的转录水平进行测定,该方法已成为揭示二者相互关系的有效手段[27]。目前,Dual RNA-seq已成功应用于人类-寄生虫[28]、动物-病原菌[27,29]或寄生虫[27]、微生物共生[30]、植物-病原[31-33]互作的研究。本研究以Dual RNA-seq为主要检测手段,在生理水平上和转录水平上初步探究外源褪黑素介导感病萝卜中寄主与芸薹链格孢菌互作的作用模式,以期为研究外源褪黑素调控植物对病原菌的防御机制提供新的理论依据。
1 材料与方法
1.1 试验材料和培养方法
试验使用菌种为芸薹链格孢菌[A.brassicae(Berk.)Sacc],分离于贵州省威宁县双龙镇红光村萝卜种植基地,于合成低营养琼脂培养基(synthetic low nutrient agar,SNA)中培养,环境条件为25±2℃、全黑暗,每3 d转接1次。植物材料为黑斑病易感品种江南圆白四叶一心幼苗(25 d),苗期培养条件为湿度80%、光强100%(33 000 Lux)、温度25℃/16℃,光周期16 h。
1.2 链格孢接种
将剪去叶尖的萝卜幼苗叶面浸泡于106CFU·cm-3的菌悬液5 min,叶片上包裹保鲜膜保湿,在上述苗期培养环境下培养4周至叶片表面出现黑斑病症。以0.6%(v/v)乙醇溶液为溶剂,配置50、100、500、 1 000、 1 500 μmol·L-1MT溶液,过滤灭菌后备用。以ddH2O和溶剂喷施组为对照,对培养4周后出现病症的植株每株喷施5 mL,每3 d喷施1次,共处理5次,期间培养条件同1.1。每个处理至少重复3次,每重复至少使用10棵萝卜幼苗。
1.3 病情指数测定
最后一次喷施MT 3 d后测定病情指数,每个处理随机调查10株,每株均调查全部叶片,总计3次重复。植株发病分级标准如下:0级:无症状;1级:叶黑斑面积占总叶面5%以下;3级:叶黑斑面积占总叶面6%~10%;5级:叶黑斑面积占总叶面11%~20%;7级:叶黑斑面积占总叶面21%~50%;9级:叶黑斑面积占总叶面51%以上。病情指数计算公式如下:
病情指数=[∑(各级病叶数×相对级数值)/(调查总叶数×9)]×100。
1.4 互作转录组的测定和分析
1.4.1 文库构建和测序 对感病叶片提取和纯化总RNA,方法参考TRIzol试剂盒(Invitrogen,美国)和NanoDrop ND-1000超微量分光光度计(Wilmington,美国)说明书进行。RNA质量通过Bioanalyzer 2100试剂盒(Agilent,美国)操作说明和琼脂糖电泳进行验证。通过oligo(dT)磁珠(Thermo Fisher,美国)特异捕获带有PolyA尾的mRNA。利用Magnesium RNA Fragmentation Module(NEBNext®,美国)对mRNA在94℃条件下处理5~7 min至片段化后,参照 Invitrogen SuperScript II Reverse Transcriptase(Invitrogen,美国)操作说明合成cDNA。cDNA的二链合成使用EscherichiacoliDNA polymerase I(NEB,美国)和RNase H(NEB,美国)试剂盒,同时在二链中掺入dUTP Solution(Thermo Fisher,美国),补平双链DNA末端,再在末端各加1个A,随后筛选和纯化片段大小。UDG酶(NEB,美国)消化二链。产物反应程序如下:95℃预变性3 min;98℃变性15 s,60℃退火15 s,72℃延伸5 min,8个循环;72℃终延伸5 min。程序下合成片段大小为300±50 bp的文库。使用illumina Novaseq 6000(联川生物,杭州)对文库进行双端测序,测序模式为PE150。转录组检测中,在各处理组中随机取9个样本,3个样本混合为1重复,共3个重复进行测序。
1.4.2 测序结果分析 利用cutadapt 1.9对原始数据除接头、低质量序列和重复序列。使用HISAT2(2.0.4)将Clean Data比对到基因组上(萝卜参考基因组:https://www.ncbi.nlm.nih.gov/genome/12929 genomeassemblyid=249276,链格孢真菌参考基因:https://ftp.ncbi.nlm.nih.gov/genomes/refseq/fungi/Alternaria-alternata/latestassemblyver sions/GCF-001642055.1-Altal1/GCF-001642055.1-Altal1genomic.fna.gz)。利用StringTie(1.3.4d.Linux-x86-64)进行初组装,gffcompare(0.9.8.Linux-x86-64)进一步组装注释结果。使用ballgown包进行每千个碱基的转录每百万映射读取数(Fragments Per Kilobase per Million,FPKM)定量[Total_exon_fragments/mapped_reads(millions)× exon_length(kb)],R包edgeR或者R包DESeq 2对样本之间进行显著差异分析,将差异倍数(fold change, FC)>2倍或FC<0.5倍且P<0.05的基因定义为差异表达基因(differentially expressed genes,DEGs),并对其进行基因本体论(Gene Ontology,GO,http://geneontology.org/)注释和京都基因与基因组百科全书(Kyoto Encyclopedia of Genes and Genomes,KEGG,http://www.kegg.jp/kegg)富集分析。
1.5 关键基因表达模式的检测
以与萝卜生长和免疫反应相关的DEGs序列和与链格孢菌增殖调控和致病相关的DEGs序列为目标,设计引物(表1、2),进行逆转录实时荧光定量PCR(reverse transcription real-time fluorescence quantitative chain polymerase reaction, RT-qPCR)表达验证并以相对定量方法进行分析,试验平台为LineGene 9600 Plus(博日,杭州)。反应体系为 20 μL:2× SYBR Green qPCR Master Mix(APExBIO,USA)10 μL,10 μmol·L-1上下游引物各0.5 μL,cDNA 2 μL,无酶水7 μL。RT-qPCR程序:95℃预变性2 min;95℃变性15 s,60℃退火30 s,共40个循环。绘制溶解曲线时程序为:95℃变性15 s,60℃退火60 s;95℃变性15 s,每秒升高或者降低0.4℃。RT-qPCR中,每个基因重复检测3次,同时设置3个技术重复。
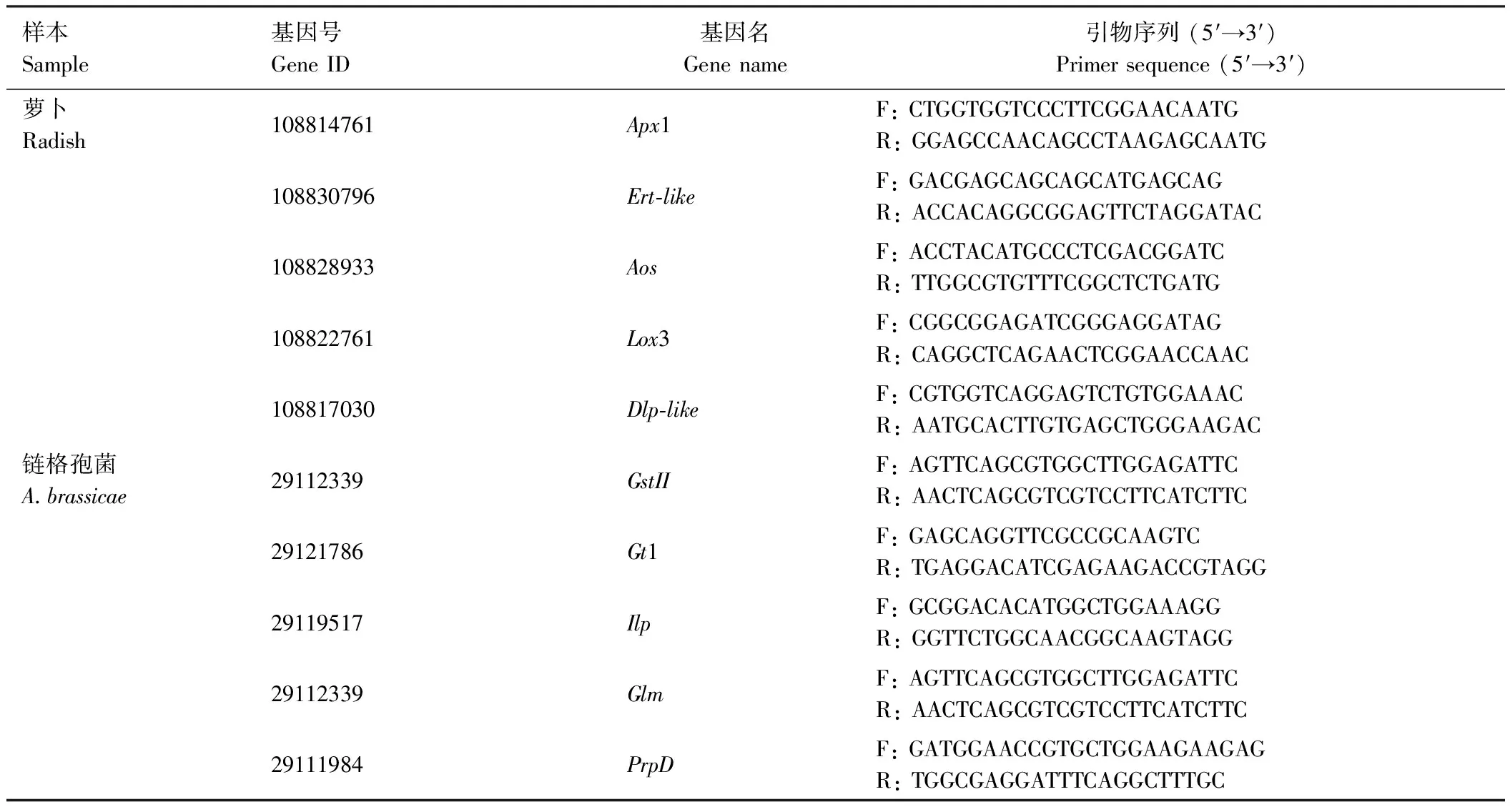
表2 关键DEGs RT-qPCR引物序列Table 2 Key DEGs primer sequences for RT-qPCR
1.6 数据统计
显著性差异分析利用单因素方差分析(One way ANOVA)于0.05水平上进行比较,P<0.05表示显著。
2 结果与分析
2.1 外源褪黑素对病情指数的影响
植株病情指数随褪黑素浓度的增加呈先下降后上升的趋势,50、100和500 μmol·L-1处理组的病情指数低于对照和其他处理组,其中100和500 μmol·L-1处理间无显著性差异,1 000和1 500 μmol·L-1处理组病情指数显著高于其他处理组(图1左)。叶面病症见图1右图。
2.2 互作转录组测序质量分析
互作转录组中CK、500和1 500 μmol·L-1处理组转录测序数据有效率在97%以上,GC含量在46%以上,Q30均为98%(表3),以上数据表明转录组测序质量稳定,可用于下一步分析。测序结果与萝卜基因组数据进行比对,三组总reads比对率均为88%以上,唯一对比率均为62%左右(表4)。测序结果与链格孢菌基因组数据进行比对,三组唯一对比率为0.02%(500 μmol·L-1和1 500 μmol·L-1组)-0.05%(CK)。三组比对结果在萝卜样本上无明显差异,但在链格孢菌样本上差异较大,500 μmol·L-1和1 500 μmol·L-1处理组上可比对reads和唯一比对reads数量明显低于对照(表4)。

注:左图:喷施外源褪黑素的江南元白萝卜黑斑病苗病害指数;数据以平均值±标准误差表示;不同小写字母表示差异显著(P<0.05)。右图:不同浓度外源褪黑素对萝卜黑斑病发病率的影响;A~F分别代表0、50、100、500、1 000和1 500 μmol·L-1外源褪黑素处理的病叶;比例尺=1厘米。Note: Left: disease index of black leaf-spot diseased Jiangnan Yuanbai radish seedlings sprayed with exogenous melatonin. Lowercase letters indicate significant differences at 0.05 level. Right: the disease incidence of radish black leaf spot diseased leaves sprayed with different concentrations of exogenous melatonin. A~F represent diseased leaves with 0, 50, 100, 500, 1 000 and 1 500 μmol·L-1 exogenous melatonin treated. Bar=1 cm.图1 感黑斑病江南圆白萝卜幼苗外源喷施褪黑素后病情指数和发病情况Fig.1 The disease incidence and Disease index of black leaf spot disease in radish leaves sprayed with different concentrations of exogenous melatonin
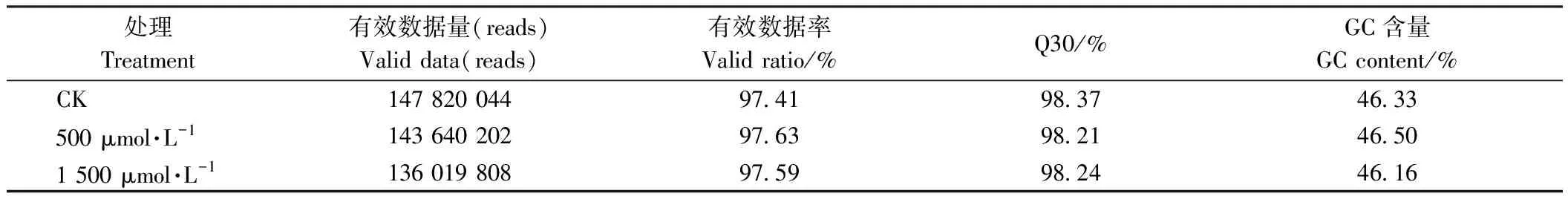
表3 样品测序数据评估Table 3 evaluation of sample sequencing data
2.3 互作转录组转录本区域分布比对
互作转录组中,CK和500、1 500 μmol·L-1处理组测序数据与萝卜和链格孢菌基因外显子的比对率均在98%以上(图2),说明样本和测序质量较高。
2.4 差异表达基因数量分析
萝卜样本中,500 μmol·L-1处理组与CK相比共检测出588个上调基因和898个下调基因,1 500 μmol·L-1处理样品中共检测出1 185个上调基因和1 352个下调基因;1 500 μmol·L-1VS 500 μmol·L-1中共检出606个上调基因和526个下调基因。链格孢菌样本检出差异表达基因较少:500 μmol·L-1处理样品中共检测出6个上调基因和47个下调基因,1 500 μmol·L-1处理样品中共检测出6个上调基因和136个下调基因,1 500 μmol·L-1VS 500 μmol·L-1中未检出上调基因,检出4个下调基因(图3)。与萝卜相比,褪黑素对感病叶片上链格孢菌影响较小。

表4 比对到参考基因组去除核糖体RNA数据Table 4 RNA data that mapped to reference genome and with rRNA data removed

图2 转录本区域分布比对Fig.2 Transcripts mapped region

图3 差异表达基因火山图Fig.3 Volcano plot of deferentially expressed genes
2.5 差异表达基因富集分析
2.5.1 GO富集分析 萝卜和链格孢菌DEGs均被富集为3个GO功能 (GO function):生物过程、细胞组成和分子功能。萝卜500 μmol·L-1VS对照比对组中,生物过程中最显著富集(P<0.05)的GO条目为190个,DEGs 2 208个,最显著富集GO条目包括几丁质应答、脱落酸应答、抗逆境应答、细菌防御反应、创伤应答以及芳香族化合物生物合成过程等;细胞组成中显著变化的条目共24个,共894个DEGs,包括光合系统I和II、质膜、捕光复合体、叶绿体类囊体膜等;分子功能中显著富集的GO条目共97个,包括序列特异DNA结合、叶绿素结合、色素结合、DNA结合转录因子活性等,共涉及1 317个DEGs。萝卜1 500 μmol·L-1VS对照中,生物过程中最显著富集的GO条目195个,共 2 937 个DEGs,包括几丁质应答、细菌抵御反应、创伤应答、氧化胁迫应答、冷胁迫应答和脱落酸反应等;细胞组成上显著富集的GO条目共26个,其中最显著富集为质外体、叶绿体、CCR4-NOT核复合体、细胞壁、质膜和类囊体等;分子功能上最显著富集GO条目共108个,DEGs共1 710个,包括特异序列DNA结合、硫酸盐跨膜转运蛋白活性、DNA结合转录因子活性活性、琥珀酸跨膜转运蛋白活性等。萝卜样本1 500 μmol·L-1VS 500 μmol·L-1中,生物过程中最显著富集的GO条目144个,包括光合作用中光和系统I和II光采集、对生物体反应、叶片衰老的负调控、蛋白质-生色团连锁等,共1 019个DEGs;细胞组成上显著富集的GO条目共40个,包括质体小叶、采光复合体、光和系统I和II、质膜、叶绿体等,共1 358个DEGs;分子功能上共有108条显著富集的GO条目,色素结合、脂质结合、叶绿素结合、过渡金属离子结合和错误折叠蛋白结合等为最显著富集条目,共检出450个DEGs。萝卜对照VS 500 μmol·L-1VS 1 500 μmol·L-1中,生物过程中共检出250个GO条目,最显著富集条目为冷胁迫应答、几丁质应答、脱落酸应答和细菌抵御应答等,DEGs共4 109个;细胞组成上共有GO条目42条,包括质膜、光合体统I和II,光捕捉复合体和叶绿体类囊体膜等,检出3 348个DEGs;分子功能上显著性富集条目141条,包括叶绿素结合、序列特异DNA结合、色素结合和蛋白丝氨酸/苏氨酸激酶活性等,DEGs共2 756个(前20条显著富集GO条目见图4)。
感病叶片上链格孢菌生物量显著低于萝卜,各GO功能上富集的条目数量显著低于萝卜。500 μmol·L-1VS对照中,生物过程上检出52条GO条目,其中有丝分裂肌动球蛋白收缩环组件、肌动蛋白丝退火的负调控、鸟苷一磷酸(guanosine monophosphate, GMP)挽救和脂质转运和肌动蛋白丝脱支等条目富集最显著,DEGs共56个;细胞组成上显著性富集9条GO条目,包括质膜、肌动蛋白相关、Set3复合体和细胞尖端等,DEGs共17个;分子功能上显著富集GO term为30条,包括外源性跨膜转运腺嘌呤核苷三磷酸(adenosine triphophate)ATP酶活性、蛋白质二聚活性、肌动蛋白丝结合和谷胱甘肽合酶活性等,DEGs 37个。1 500 μmol·L-1VS对照中,生物过程中共有63条显著富集GO条目,包括Arp2/3复合物介导肌动蛋白成核的正调控、醋酸盐分解代谢过程、碳利用和RNA聚合酶Ⅱ转录起始前复合物组装的正调控等,DEGs共97个;细胞组成中24条显著性富集GO条目,包括线粒体、细胞质、胞浆蛋白酶体复合体、核蛋白酶体复合体和肌动蛋白皮质片等,DEGs共83个;分子功能上显著富集GO条目共48条,包括蛋白酶体激活ATP酶活性、外源性跨膜转运ATP酶活性、质子跨膜转运蛋白活性和高柠檬酸合酶活性等,DEGs共60个。1 500 μmol·L-1VS 500 μmol·L-1中,各GO功能下没有显著性富集条目。对照VS 500 μmol·L-1VS 1 500 μmol·L-1比对组中,生物过程中显著性富集条目共52条,包括Arp2/3复合物介导肌动蛋白成核的正调控、RNA聚合酶ⅡC末端丝氨酸2残基的磷酸化与RNA聚合酶Ⅱ启动子转录延伸的正调控、肌动蛋白成核、甾醇进口等,显著DEGs 52个;细胞组成上共17个显著GO条目,包括核蛋白酶体复合体、线粒体、肌动蛋白皮质片、细胞质、内质网和脂滴等,显著DEGs 92个;分子功能上显著性富集GO条目共34个,包括外源性跨膜转运ATP酶活性、RNA聚合酶Ⅱ羧基末端结构域激酶活性、肌动蛋白丝结合和ATP结合等条目,共57个DEGs(前20条显著富集GO条目见图4)。

图4 差异表达基因GO富集分析Fig.4 GO classification analysis of DEGs
2.5.2 KEGG富集分析 萝卜叶片样本上,500 μmol·L-1VS对照组中,DEGs主要富集植物丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)信号通路(46个)、光合作用天线蛋白(10个)、植物-病原体互作(48个)、倍半萜和三萜生物合成(9个)、膦酸盐和膦酸盐代谢(5个)、丁酸代谢(6个)等;1 500 μmol·L-1VS对照组中,DEGs主要富集于植物-病原体互作(85个)、丝裂原活化蛋白激酶(mitogen-activated protein kinase, MAPK)信号通路(59个)、丙氨酸、天冬氨酸和谷氨酸代谢(14个)等;1 500 μmol·L-1VS 500 μmol·L-1组中,DEGs主要富集光合作用天线蛋白(9个)和真核生物自噬(7个)等;500 μmol·L-1VS 1 500 μmol·L-1VS对照比对中,光合作用天线蛋白(15个)、植物-病原体互作(91个)和MAPK信号通路(67个)等。
链格孢菌样本上,显著富集的DEGs较萝卜样本明显减少。500 μmol·L-1VS对照组中,仅3个DEGs显著富集于ATP结合盒转运体(ATP-binding cassette transporter, ABC transporter)通路;1 500 μmol·L-1VS对照组和1 500 μmol·L-1VS 500 μmol·L-1比对组中,各有1个DEGs显著富集于淀粉和蔗糖代谢通路;在3个处理的比对组中,共有9个DEGs被富集于3个KEGG通路上,其中蛋白酶体通路上4个,萜类主链生物合成通路上3个,脂肪酸延长2个(图5)。
2.6 关键DEGs表达模式验证
本研究根据转录组测序结果分别在萝卜和链隔孢菌上各筛选出5个关键DEGs,其中萝卜关键基因为Apx1、Ert-like、Aos、Lox3和Dlp-like,涉及功能分别为L-抗坏血酸过氧化物酶1、乙烯反应转录因子3、丙二烯氧化物合酶、叶绿体脂氧合酶3和防御素样蛋白合成;链格孢菌上DEGs分别为GstII、Gt1、Ilp、Glm和PrpD,其功能分别涉及谷胱甘肽S-转移酶II合成、葡萄糖/半乳糖转运体合成、异柠檬酸裂解酶和磷酰变位酶合成、谷胱甘肽代谢调控、2-甲基柠檬酸脱水酶合成。
萝卜样本中,RT-qPCR结果证实Apx1在对照样品中表达量最高,为5.45,500 μmol·L-1组中最低,为0.53,1 500 μmol·L-1组样本中表达量居中,为1.02;Ert-like表达趋势与LPd相反,500 μmol·L-1组样本表达量最高,为69.42,对照最低,为29.43,1 500 μmol·L-1组居中,为50.74;Aos表达量在对照中显著高于500和1 500 μmol·L-1褪黑素处理组;Lox3在1 500 μmol·L-1样本中表达量显著高于对照和500 μmol·L-1;Dlp-like在500 μM外源褪黑素处理样本中的表达量明显高于对照和1 500 μmol·L-1。链格孢菌样本中,GstII在500 μmol·L-1组中表达量高于其他两组,其中对照为0.52,1 500 μmol·L-1组中为0.82;Gtl、Ilp和Glm表达趋势与GstII相似,500 μmol·L-1组表达量高于其他两组;PrpD在对照组样本中表达量显著高于外源褪黑素处理组,其中500 μmol·L-1组中为0.92,1 500 μmol·L-1组中为0.51。10个DEGs在3组中的表达趋势与RNA-seq测序结果基本一致(表5、6)。

表5 关键DEGs的RNA-seq FPKM值Table 5 RNA-seq FPKM value of DEGs and their RT-qPCR verification
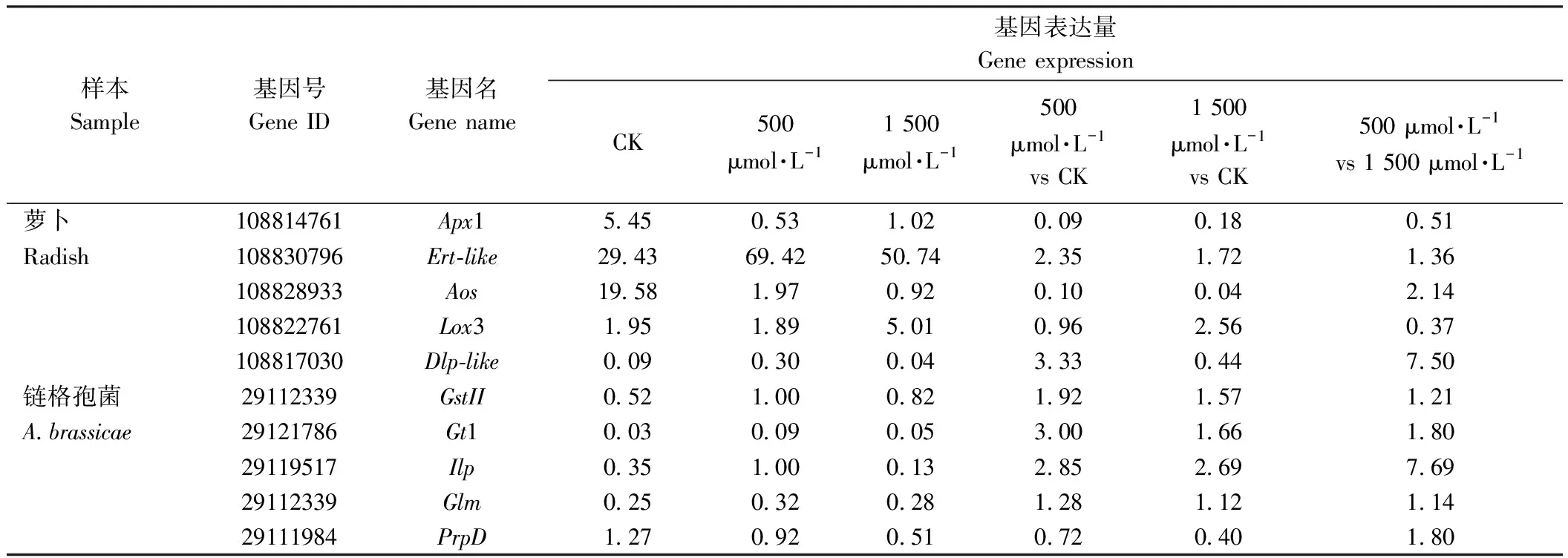
表6 关键DEGs的RT-qPCR验证Table 6 RT-qPCR verification of DEGs
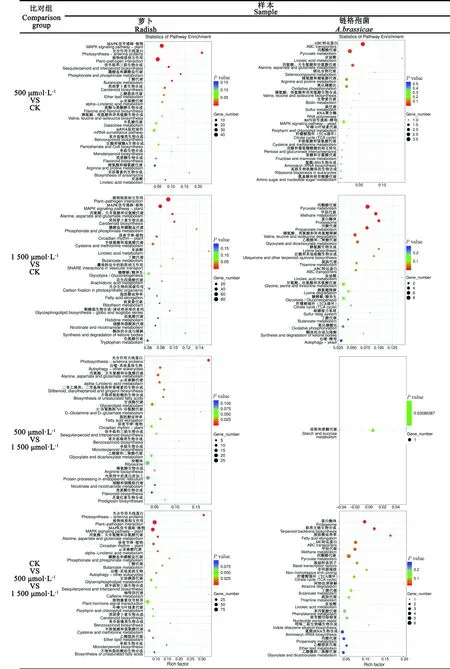
图5 差异表达基因KEGG pathway功能富集分析Fig.5 KEGG enrichment analysis of DEGs from each contrast set
3 讨论
MT是自然界广泛存在的胺类物质,对植物和微生物均具有较复杂的生长调节作用[22-23,34-35]。大量报道证实外源施加MT可显著提升农作物对生物胁迫的抗性,但该类报道主要集中于植物的研究[11,17,20,36],忽略了其对病原微生物的影响,限制了对外源MT介导作物与病原菌互作作用机制的理解。本研究主要利用基于RNA-seq的互作转录组分析解析不同浓度外源褪黑素影响萝卜黑斑病叶上寄主与链格孢菌互作的作用模式,为进一步明确MT诱导植物抗病的机制提供数据支持。
已有报道证实MT对植物的生长调节作用具有明显的剂量依赖性效应[37-39]。外源MT对萝卜健康叶片的生长和对链格孢菌免疫力、以及对链格孢菌菌落生长和孢子发生的影响亦表现为明显的剂量依赖型效应,共同呈现低浓度(50~500 μmol·L-1)促进、高浓度(1 000 和1 500 μmol·L-1)抑制的趋势,其中500 μmol·L-1对寄主和链格孢菌的促生作用最明显,1 500 μmol·L-1明显抑制二者生长(数据尚未发表)。理论上,外源MT在相同浓度下对寄主和病原物的生长调节影响作用相同,可能不具备缓解萝卜黑斑病的作用,但本研究证实适宜浓度的外源MT可显著降低黑斑病病情指数(图1)。以上结果证明外源褪黑素对萝卜-链格孢菌互作影响的作用模式与其单独对二者的作用模式存在明显差异。
为分析差异发生原因,以CK、外源喷施500、1 500 μmol·L-1MT的感病叶片进行Dual RNA-seq测序,并做互作转录组分析。各组样本比对到萝卜基因组的read比例均为88%以上,而比对到链格孢菌基因组上reads比率仅为0.02%~0.06%(表4),结合叶面积与病斑面积的比率计算(病情指数)可知,在感病叶片上,萝卜叶片的生物量与链格孢菌生物量相比占绝对优势,推断植物寄主与MT的作用水平显著超过MT对链格孢菌的作用,导致各浓度MT对萝卜叶片的生长和抗性的影响明显超过对链格孢菌侵染力的影响。另外,500及1 500 μmol·L-1处理组上,萝卜样本中可分别检出1 486和2 537个DEGs,而链格孢菌上检出数量分别为53和142个,进一步说明在感黑斑病叶片上,MT对萝卜的影响远超对链格孢菌。
褪黑素可通过多种途径调节植物对病原菌抗性[11]。Yin等[36]证明外源MT通过调控苹果(Malusprunifolia)叶片抗氧化酶活性以降低植株H2O2含量,最终提高对苹果斑点病(Diplocarponmali)的抗性。L-抗坏血酸过氧化物酶在清除H2O2中起到重要作用,可通过调控水杨酸合成途径诱导抗性[39]。一般逆境会诱导抗坏血酸过氧化物酶家族成员表达量上调[40],且该酶合成受H2O2负调控,参与植物对病原物的超敏反应和免疫反应[39]。本研究中,萝卜L-抗坏血酸过氧化物酶1合成基因Apx1在500及 1 500 μmol·L-1处理组中表达量显著低于对照,且500 μmol·L-1中表达量最低,说明萝卜因感病引起的氧化逆境可能因外施MT得到缓解,从而提高对链格孢菌的抗性。RT-qPCR证明萝卜类乙烯反应转录因子3合成基因Ert-like在500 μmol·L-1处理上表达量为对照的2.35倍。已有研究证明生物和非生物胁迫均可刺激乙烯反应转录因子3合成上调[41]。本研究中,低浓度外源MT可能通过提高Ert-like的表达以提高萝卜叶片对链格孢菌抗性。丙二烯氧化物合酶属于细胞色素P450酶超家族,定位于叶绿体中,Rustgi等[42]认为该酶可通过调控植物防御调节剂JA的生物合成以防御环境胁迫,是植物抗逆中重要的酶,但也有研究认为该酶对葡萄(VitisviniferaL.)中JA合成意义不大[43],说明该酶在不同植物中作用复杂。本研究中,丙二烯氧化物合酶合成基因AOS受外源MT负调控,且其表达量随MT浓度提高而下降,与各处理病情指数的变化不一致,说明该基因或许不参与MT诱导的抗性调控,可能存在更加复杂的模式。脂质过氧化是植物内源氧化胁迫中的重要内容,可由脂氧合酶家族介导合成,在对抗性表现差异较大的番茄(Lycopersiconesculentum和L.pennellii)中,脂氧合酶合成基因LOX的表达量之间的差异达400倍[44]。本研究中,500 μmol·L-1处理组中Lox3的表达量显著低于对照,且1 500 μmol·L-1处理组中表达量最高,说明低浓度外源MT可有效减轻萝卜叶片脂质氧化,从而提高植株抗性,但高浓度MT可能转变为氧化胁迫,使植物丧失抗性。MAPK通路是MT诱导植物抗逆的重要途径[16]。RNA-seq结果显示,MAPK通路中防御样蛋白1合成基因Dlp-like随MT施用表达量变化明显,其中500 μmol·L-1处理组中表达量显著高于对照和1 500 μmol·L-1处理组。Naguib[45]证明该蛋白可调控小麦(Triticumaestivum)对枯萎病(Fusariumwilt)抗性,Dlp-like在各组中的表达模式与各处理组种病情指数的变化类似,说明其可能受MT调控,介导萝卜对生物胁迫抗性的变化。
谷胱甘-S-转移酶基因家族广泛存在于所有生命形式中,主要参与生物解毒、生长发育以及逆境抗性[46-47]。本研究中,谷胱甘-S-转移酶合成基因GstII在MT处理的表达高于对照,且500 μmol·L-1处理组中最高,说明适宜浓度MT可能通过调节该酶表达量以促进链格孢菌发育。MT参与调节谷胱甘肽代谢以提高动植物对逆境的抗性[48-49]。RNA-seq和RT-qPCR证实链格孢菌参与谷胱甘肽代谢的基因Glm的表达量受外源MT诱导,且在500 μmol·L-1处理组表达量最高,可为MT在真菌中调节谷胱甘肽代谢提供证据。谷胱甘肽S-转移酶以及参与调控谷胱甘肽代谢的酶在真菌应对氧化逆境中具有重要作用[50],但真菌上相关研究较匮乏,GstII和Glm的具体功能和MT调控两者机制需进一步验证。葡萄糖是大多数生物碳和能量的主要来源,在细胞代谢和维持细胞内稳态中起着重要作用,也是一种信号分子,在基因转录、酶活性、激素分泌等方面具有多种调节功能。细胞外通过葡萄糖转运蛋白介导的细胞膜摄取葡萄糖,是葡萄糖代谢的关键步骤[51]。本研究中控制葡萄糖/半乳糖转运的基因Gt1在MT处理组中表达量高于对照,且500 μmol·L-1处理组中量最高,说明MT可能提高植物对碳源的获取能力以刺激菌落生长。异柠檬酸裂解酶是一种参与乙醛酸途径的关键酶,对多种真菌的毒力和致病性至关重要。目前认为可通过开发异柠檬酸裂解酶抑制剂以控制真菌的生长[52]。本研究中参与柠檬酸裂解酶合成的基因Ilp在500 μmol·L-1处理组中表达最高,说明适宜浓度MT可能提高链格孢菌毒力。2-甲基柠檬酸脱水酶对柠檬酸盐、异柠檬酸盐和2-甲基柠檬酸盐具有脱水催化作用,也对部分羟基酸具有脱水催化作用[53],在细菌中参与丙酸氧化为丙酮酸过程[54]。敲除2-甲基柠檬酸脱水酶合成基因PrpD导致苏云金杆菌(Bacillusthuringiensis)大量合成2-甲基柠檬酸[55],而该物质可抑制芽孢形成[56]。目前,针对PrpD的研究大多集中在细菌上,该基因对真菌发育和毒性影响的生物功能尚不十分明确。本研究证实MT显著抑制PrpD基因的表达,且浓度越高表达量越低,但具体机制需要后续深入研究。以上结果显示,500 μmol·L-1MT对感病叶片上链格孢菌生长和毒性具有正向影响作用,但可能因MT对寄主细胞免疫诱导作用更强,导致喷施后叶片表现抗病性增强现象。
4 结论
本研究首次利用互作转录组检测手段分析外源MT介导萝卜-链格孢菌互作作用机制,研究了梯度浓度MT在寄主和病原菌代谢变化、以及萝卜对链格孢菌抗性诱导上的作用,并证明该作用存在低浓度促进、高浓度抑制的剂量依赖性效应:50~500 μmol·L-1浓度下MT对双方均具生长促进作用,其中500 μmol·L-1在表型和转录水平上均可显著提升寄主及病原菌的生长及抗性/致病性,但MT对寄主的影响显著超过对菌的作用,最终表现为萝卜抗性提高。另外,1 500 μmol·L-1浓度下MT抑制双方生长及抗性/致病性。
