灌浆期高温胁迫下外源水杨酸对小麦旗叶抗氧化生理特性的影响
2022-09-21樊永惠李宇星马亮亮吕钊彦武倩倩张文静马尚宇黄正来
樊永惠 李宇星 马亮亮 吕钊彦 武倩倩 张文静 马尚宇 黄正来,*
(1安徽农业大学农学院/农业部黄淮南部小麦生物学与遗传育种重点实验室,安徽 合肥 230036;2安徽农业大学园艺学院,安徽 合肥 230036)
小麦(TriticumaestivumL.)属于喜凉的C3作物,但随着全球范围气候变暖的不断加剧,月平均气温持续呈上升趋势,小麦灌浆期出现高温天气的频率随之不断提高[1]。18~22℃是小麦适宜的灌浆温度。当日平均气温达到30℃以上时,小麦叶片细胞结构与功能遭受破坏,叶绿素含量下降,导致光合能力减弱以及氧化代谢能力下降,叶片提前衰老,同化效率下降,灌浆速率降低,灌浆期缩短,籽粒干瘪,千粒重降低,从而造成减产[2]。因此,缓解高温对小麦的伤害是生产中亟待解决的问题[3]。
抗氧化系统是植物生理过程中抵御胁迫的关键。当植物遭遇环境胁迫时,抗氧化酶通过改变其含量从而降低植物受到的逆境胁迫伤害,辅助植物适应环境[4]。水杨酸(salicylic acid,SA)在高等植物细胞内普遍存在,是小分子酚类物质,具有调节植物生长发育和增强植物抵御高温胁迫等多方面的生理功能[5]。已有研究发现,SA能够参与植物的许多系统反应,如种子萌发、气孔关闭和离子吸收等[6]。高温条件下,SA能够通过植物体内的抗氧化酶活性来降低高温胁迫对细胞膜的破坏程度,保护光合机构免受活性氧(reactive oxygen species,ROS)的伤害[7]。覃泳智等[8]研究表明,外源SA能显著提升高温胁迫下月季的抗氧化酶活性,降低高温胁迫生成的大量丙二醛(malondialdehyde,MDA),减弱细胞膜过氧化程度,最终缓解高温逆境胁迫引起的氧化损害。孙建明等[9]发现,用10 μmol·L-1的SA处理匍匐剪股颖,其叶片日平均生长速度显著高于未处理组,减弱了细胞损伤程度,植株抗热性显著提升。孙军利等[10]研究表明,随着高温胁迫时间的延长(>60 min),施用外源SA可显著提高植株脯氨酸水平,明显降低质膜透性与MDA水平,减弱植物的膜质过氧化损伤,最终显著提升葡萄的抗热性。徐小芳等[11]指出,SA浸泡种处理可大大提高南瓜幼苗和黄瓜幼苗的耐热性,降低幼苗叶片中MDA水平,减轻膜脂过氧化程度,提高植株中脯氨酸水平,最终提高植株抵抗逆境的能力。苯丙氨酸解氨酶(phenylalanine ammonia lyase,PAL)是连接初级代谢和苯丙烷代谢的关键酶和限速酶,在逆境条件下,通过积累黄酮类物质等次生代谢产物,清除自由基而增强质膜完整性[12-13]。张杼润等[14]发现,SA处理诱导PAL基因表达量增加,从而提高PAL的活性,使得植物抗病性提高。多酚氧化酶(polyphenol oxidase,PPO)是一种非常重要的防御酶,参与酚类聚合,酚类物质的累积也与植物抵抗非生物胁迫相关[15-16]。Sofo等[17]研究表明,干旱胁迫通过抑制PPO活性,从而提高酚类物质的抗氧化作用。然而目前有关外源SA对高温胁迫下作物影响的研究大多集中于园艺作物[8-10]。此外,有关小麦在高温胁迫下的缓解措施多集中于多胺[1]、海藻糖[18]、脱落酸[19]等生长调节物质,而外源SA对高温胁迫下小麦生长特性影响的研究结果尚未明确。
为此,本研究以小麦品种扬麦18为试验材料,探讨SA对高温胁迫下冬小麦抗氧化生理特性的影响,阐明其生理机制,以期为春小麦抗高温生产提供理论依据和技术指导。
1 材料与方法
1.1 供试材料
试验选用品种扬麦18来自于江苏省里下河地区农业科学研究所,分蘖力较强,成穗率较高,纺锤型穗,适宜种植区为安徽省淮河以南麦区。
1.2 试验地概况
本试验于2019—2020年在安徽省合肥市蜀山区安徽农业大学校内试验基地农萃园(31.83°N、 117.24°E)进行。试验地土壤为黄棕壤土,地面平整,土层深厚,地力中等,0~20 cm土层土壤pH值6.5,2018—2019年小麦生长季试验田播前土壤有机质13.9 g·kg-1、速效氮86.2 mg·kg-1、速效磷13.4 mg·kg-1、 速效钾71.5 mg·kg-1。2019—2020年小麦生长季试验田播前土壤有机质15.2 g·kg-1、速效氮90.6 mg·kg-1、速效磷16.5 mg·kg-1、速效钾79.6 mg·kg-1。
1.3 试验方法
试验共设6个处理,分别为NN:对照(棚外正常生长条件,CK);NG:人工模拟高温;SAHG:高温处理下抽穗期外施0.1 mmol·L-1水杨酸;SAAG:高温处理下开花期外施0.1 mmol·L-1水杨酸;SA5G:高温处理下花后5 d外施0.1 mmol·L-1水杨酸;SA10G:高温处理下花后10 d外施0.1 mmol·L-1水杨酸。
试验种植管理采用原位回填土的大田盆栽方式,将田间0~20 cm土壤放入聚乙烯塑料盒盆(高30 cm、直径25 cm),每个盒装7.5 kg筛土。小麦种植于试验盆中,盆底部嵌入地面以下20 cm。为保证植株营养需求,种植时每盆施用复合肥6 g,复合肥中各养分的比例为N∶P∶K=17∶17∶17,其中氮肥分两次施入,基追比为5∶5,追肥于拔节期施入。播种日期为2018年11月7日和2019年11月4日,土壤经水沉实后播种,每盆播种20粒,在三叶一心时期,间苗至每盆8株。每个处理21盆,6个处理共计126盆,且每个处理均设置3个重复。试验盆周围大田种植相同品种小麦,种植及栽培管理方式按照高产田块要求进行。
SA处理浓度为2016—2017年预试验中筛选出的最佳喷施浓度(0.1 mmol·L-1),在抽穗期、开花期、花后5 d、花后10 d分别对小麦进行叶面喷雾(每个时期连续喷施4 d),至叶片正反两面均湿润为止(有一层小水珠欲落),每天1次(傍晚),对照组喷施等量的蒸馏水。采用随机区组试验设计,所有喷施溶液均用1 mmol·L-1KOH调整pH值为6.0±0.1,每100 mL溶液含有0.02 mL 吐温-20(Tween-20)。
黄淮海麦区小麦在灌浆中后期极易遭遇极端高温天气,导致小麦灌浆期缩短,产量下降[20-21]。本研究通过被动式增温棚模拟高温环境[1]设置对照与高温处理,将前期进行过SA喷施的盆子在增温棚中进行5 d的高温处理。高温时段为全天,为控制棚内增温幅度,每天正午将塑料薄膜上卷30 cm便于棚内通风。以Elitech(RC-4hc)智能温湿度记录仪(徐州江苏精创电器股份有限公司)每10 min 1次连续记录小麦冠层空气温湿度。单日棚内、棚外平均温度见图1。处理结束后将大棚移走,让小麦继续在自然环境下生长。2019—2020年灌浆期高温胁迫平均增温6℃。
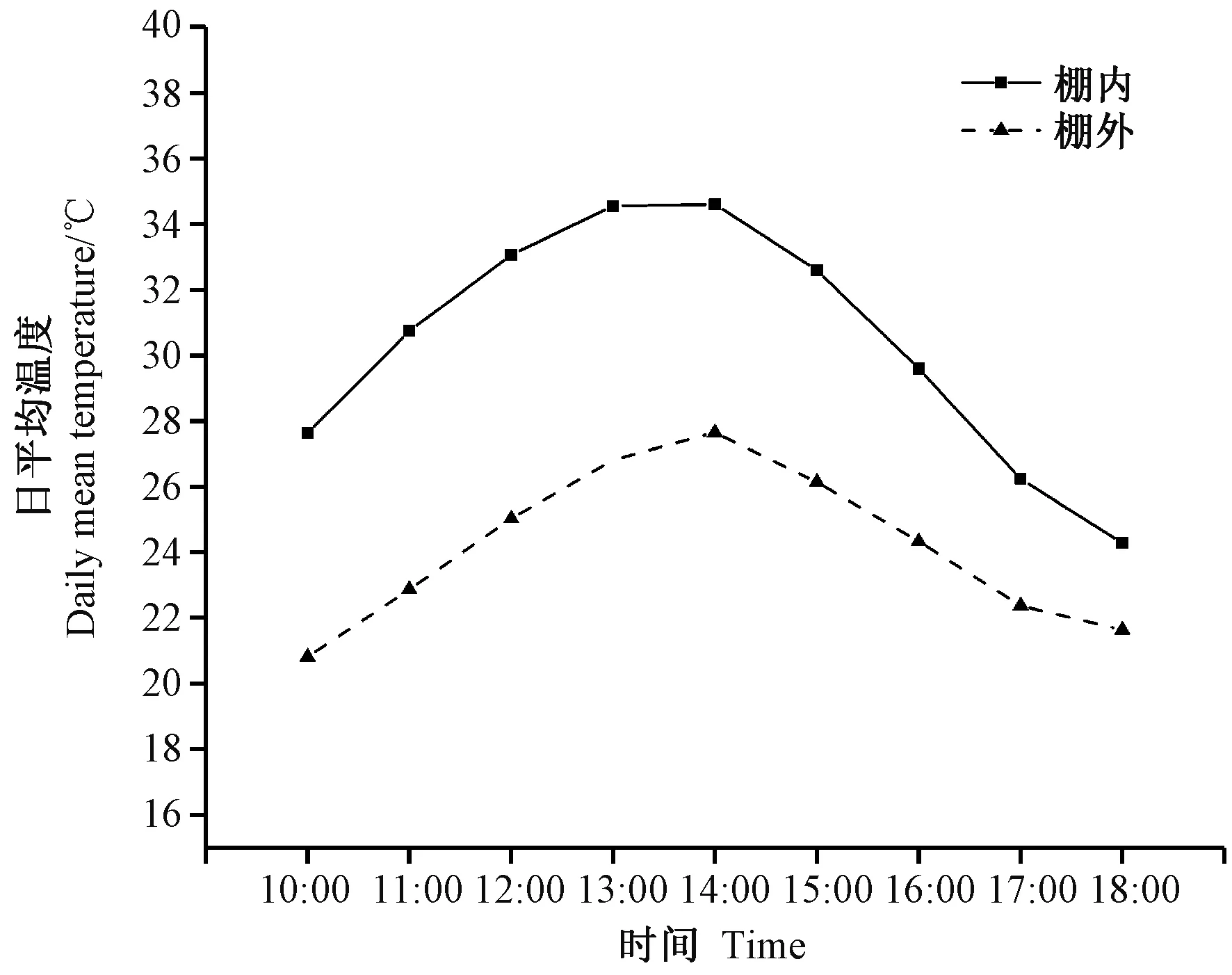
图1 高温处理期间增温大棚内外日平均温度Fig.1 Daily mean temperature inside and outside greenhouse during high temperature treatment
1.4 测试项目与方法
开花期选择长势一致的小麦植株进行标花。分别于花后5、10、15、20、25、30 d,取生长一致的旗叶,液氮速冻后放入-80℃冰柜保存。
酶液提取:将保存于-80 ℃的小麦旗叶取出,称取0.2 g小麦旗叶,加入3 mL 0.05 mol·L-1pH值7.8的磷酸缓冲液(phosphate buffer, PB)和少许石英砂于冰浴中的研钵体内研磨成匀浆,然后转入离心管,再定容至5 mL,于4℃、12 000 r·min-1条件下离心20 min,上清液即为酶粗提取液,用于丙二醛(MDA)、超氧化物歧化酶(superoxide dismutase,SOD)、过氧化物酶(peroxidase,POD)、过氧化氢酶(catalase,CAT)、苯丙氨酸解氨酶(PAL)和多酚氧化酶(PPO)的测定。
2)MDA含量:采用硫代巴比妥酸(thiobarbituric acid,TBA)比色法测定[22]。加入4 mL三氯乙酸和TBA混合液,1 mL酶液,沸水浴20 min,4 000×g离心15 min,上清液用UV-2800A紫外可见分光光度计(上海尤尼柯仪器有限公司)测定532和600 nm处的吸光度(optical dentisy, OD)值。
3)H2O2含量:使用BC3595 H2O2含量检测试剂盒(索莱宝生物,北京)微量法测定。
4)SOD活性:采用氯化硝基四氮唑蓝(nitrotetrazolium chloride blue,NTB)光化还原法测定[11]。依次加入1.5 mL 0.05 mol·L-1磷酸盐缓冲液(phosphate buffer saline,PBS)(pH值7.8),0.3 mL 130 mmol·L-1甲硫氨酸,0.3 mL 750 μmol·L-1NTB,0.3 mL 100 μmol·L-1EDTA-Na2,0.3 mL 20 mmol·L-1核黄素,0.05 mL H2O,酶液50 μL,混匀后于4 000 lx日光下反应15 min,结束后迅速测定560 nm处OD值。
5)POD活性:采用愈创木酚法测定[23]。分别加入愈创木酚0.019 mL,0.2 mmol·L-1PBS(pH值6.0)50 mL,29% H2O20.028 mL,与100 μL酶液混合,测定470 nm处OD值。
6)CAT活性:采用高锰酸钾滴定法测定[24]。
7)PAL活性:使用BC0215 PAL活性检测试剂盒(索莱宝生物,北京)微量法测定。
8)PPO活性:使用BC0195 PPO活性检测试剂盒(索莱宝生物,北京)微量法测定。
1.5 统计分析
采用Excel 2010软件进行数据处理,DPS对试验数据进行显著性分析,用Duncan分析方法进行多重比较,并采用Origin 8.5软件作图。
2 结果与分析
2.1 外源SA对灌浆期高温胁迫下小麦旗叶MDA含量的影响
由图2可知,灌浆期高温胁迫前,各处理条件下小麦旗叶MDA含量均低于对照。灌浆期高温胁迫后,与对照相比,高温胁迫显著提高了小麦旗叶MDA含量,且在花后30 d时提高幅度较大。不同阶段SA预喷施后,开花期(SAAG)、花后5 d(SA5G)和花后10 d(SA10G)预喷施SA处理条件下的小麦旗叶MDA含量均显著低于高温胁迫处理,抽穗期(SAHG)预喷施SA处理在花后25 d和花后30 d时与高温胁迫处理差异均不显著,这表明SA预喷施缓解了高温胁迫下小麦旗叶MDA含量的升高,且开花期预喷施SA对高温胁迫的缓解效果较好,抽穗期喷施SA缓解效果最差。灌浆期高温胁迫条件下MDA含量升高,表明旗叶的膜脂过氧化程度加剧,衰老程度加剧,而外源SA缓解了灌浆期高温胁迫下旗叶膜脂过氧化程度。
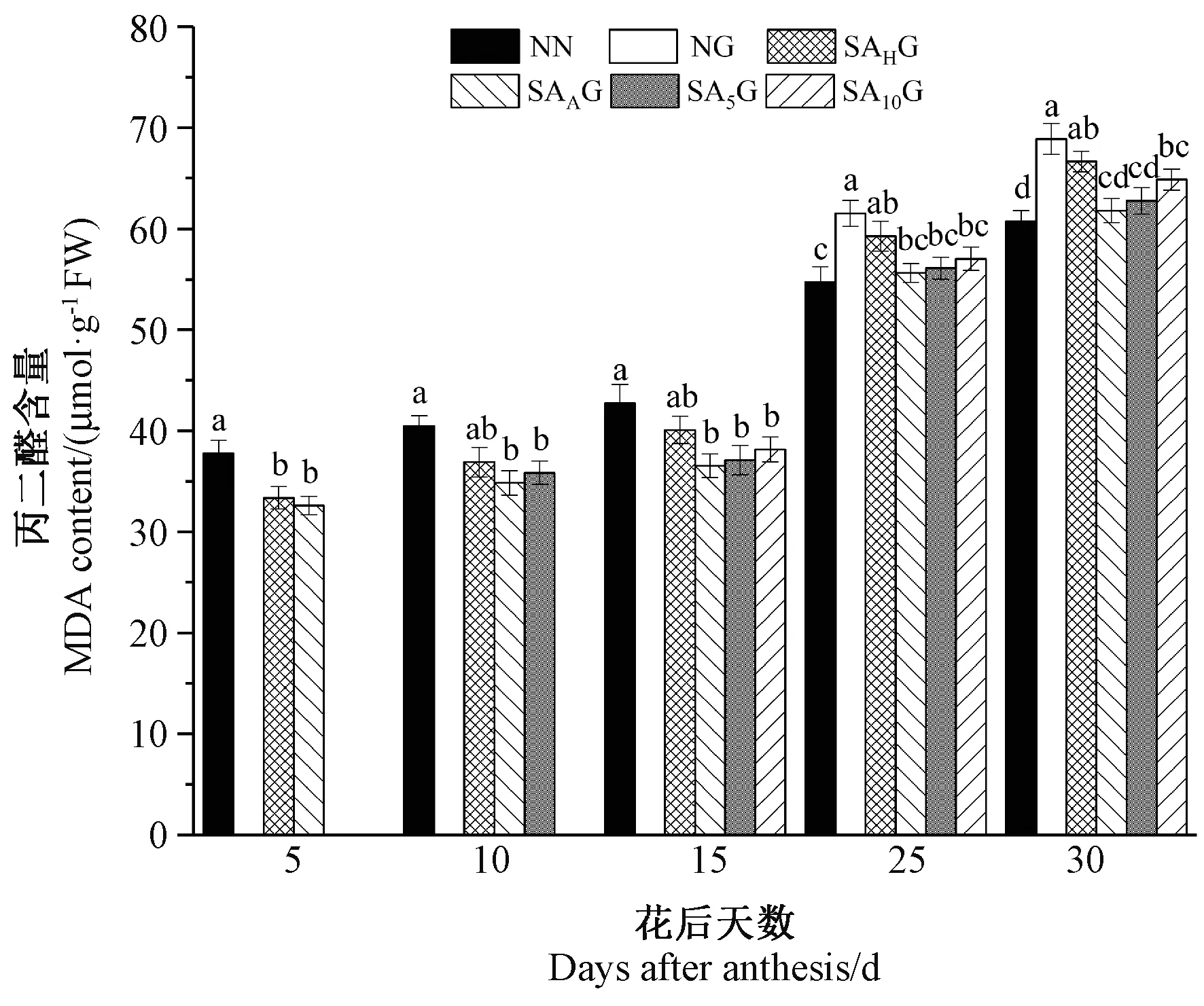
注:不同小写字母表示差异显著(P<0.05)。下同。Note: Different lowercase letters indicate significant difference at 0.05 level. The same as following.图2 外源SA对灌浆期高温胁迫下小麦旗叶丙二醛含量的影响Fig.2 Effects of exogenous salicylic acid on content of malondialdehyde in flag leaves of wheat under high temperature stress during grain filling period
2.2 外源SA对灌浆期高温胁迫下小麦旗叶H2O2含量的影响
由图3可知,小麦旗叶H2O2含量随着生育进程的推进而呈现逐渐上升的趋势。灌浆期高温胁迫前,各处理条件下的小麦旗叶H2O2含量均显著低于对照。灌浆期高温胁迫后,与对照相比,高温胁迫显著提高了小麦旗叶H2O2含量,不同阶段的SA预喷施后,开花期(SAAG)、花后5 d(SA5G)和花后10 d(SA10G)预喷施SA处理条件下的小麦旗叶H2O2含量均显著低于高温胁迫处理,抽穗期(SAHG)预喷施SA处理在花后25 d时与高温胁迫处理差异不显著,这表明SA预喷施对高温胁迫下小麦旗叶H2O2含量的升高有所缓解,且在不同时期SA预喷施对灌浆期高温胁迫下小麦旗叶H2O2含量缓解效果表现为开花期预喷施SA处理最好,其次依次为花后5 d、花后10 d和抽穗期预喷施SA处理。

图3 外源SA对灌浆期高温胁迫下小麦旗叶过氧化氢含量的影响Fig.3 Effects of exogenous salicylic acid on hydrogen peroxide content in wheat flag leaves under high temperature stress during grain filling period
2.3 外源SA对灌浆期高温胁迫下小麦旗叶O2.-产生速率的影响
由图4可知,灌浆期高温胁迫前,各处理条件下的小麦旗叶O2.-产生速率均显著低于对照。灌浆期高温胁迫后,与对照相比,高温胁迫显著提高了小麦旗叶O2.-产生速率,不同阶段的SA预喷施后,各处理条件下的小麦旗叶O2.-产生速率均显著低于高温胁迫处理,这表明SA预喷施缓解了高温胁迫下小麦旗叶O2.-产生速率的升高,且开花期预喷施SA对高温胁迫的缓解效果较好。外源SA处理后,旗叶O2.-产生速率与MDA的变化趋势相似,表明外源SA有利于缓解灌浆期高温胁迫造成的膜脂过氧化。
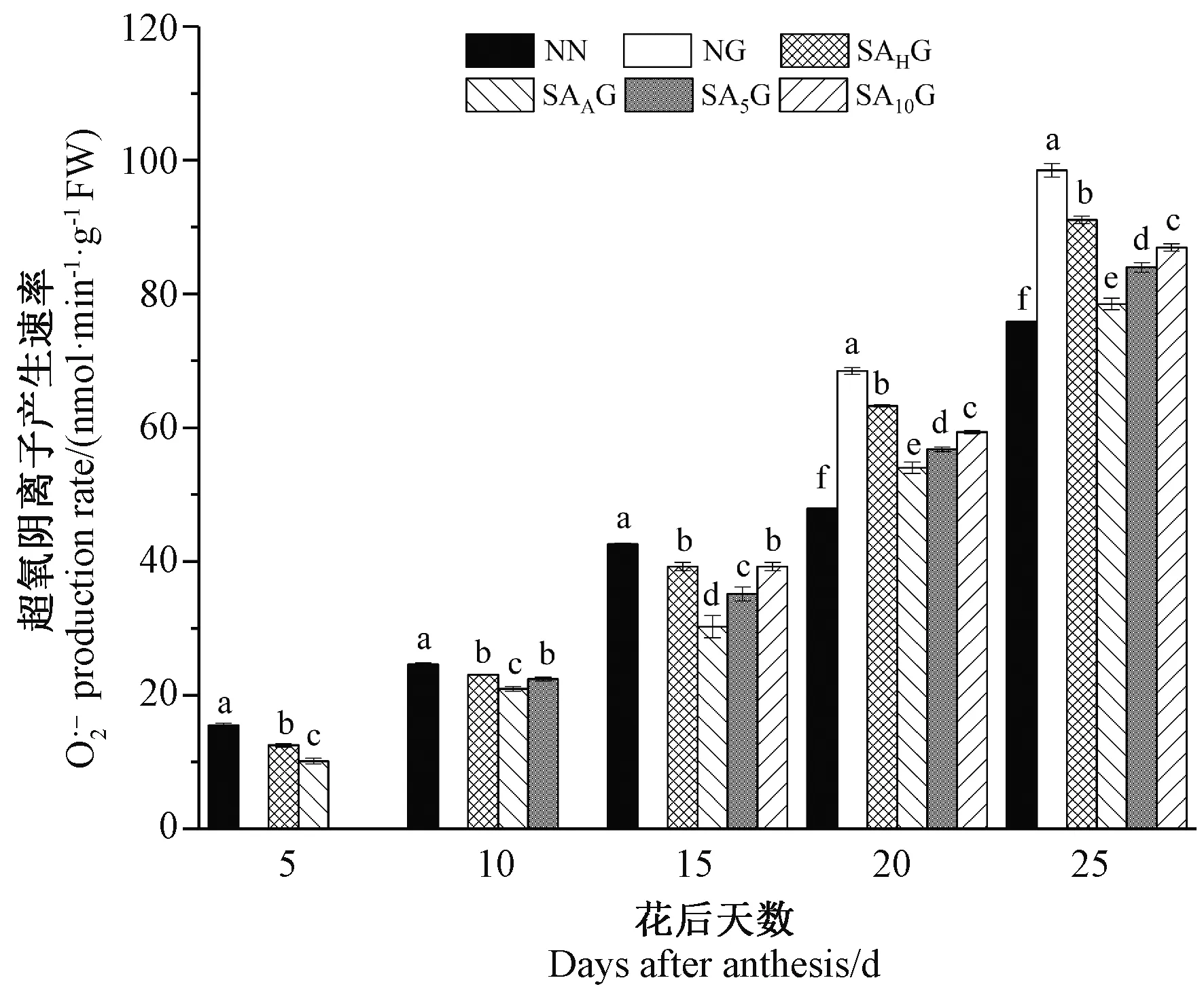
图4 外源SA对灌浆期高温胁迫下小麦旗叶超氧阴离子产生速率的影响Fig.4 Effects of exogenous salicylic acid on the production rate of superoxide anion in wheat flag leaves under high temperature stress during grain filling period
2.4 外源SA对灌浆期高温胁迫下小麦旗叶SOD活性的影响
由图5可知,小麦旗叶SOD活性随着生育进程的推进而呈现逐渐下降的趋势。灌浆期高温胁迫前,各处理条件下的小麦旗叶SOD活性均高于对照。灌浆期高温胁迫后,与对照相比,高温胁迫显著降低了小麦旗叶SOD活性,且花后25 d时相较于花后30 d下降幅度更大。在不同阶段的SA预喷施后,开花期(SAAG)和花后5 d(SA5G)预喷施SA处理的小麦旗叶SOD活性均显著高于高温胁迫处理,抽穗期(SAHG)和花后10 d(SA10G)预喷施SA处理在花后25 d以及花后30 d时与高温胁迫处理差异均不显著,这表明SA预喷施对高温胁迫下小麦旗叶SOD活性的降低有所缓解,且在不同时期SA预喷施对灌浆期高温胁迫下小麦旗叶SOD活性缓解效果表现为开花期喷施SA处理最好,其次依次为花后5 d、花后10 d和抽穗期预喷施SA处理。以上结果说明外源SA处理能够维持小麦旗叶SOD较高活性,提高其高温胁迫下的抗氧化能力,减轻O2·-对叶片的伤害。
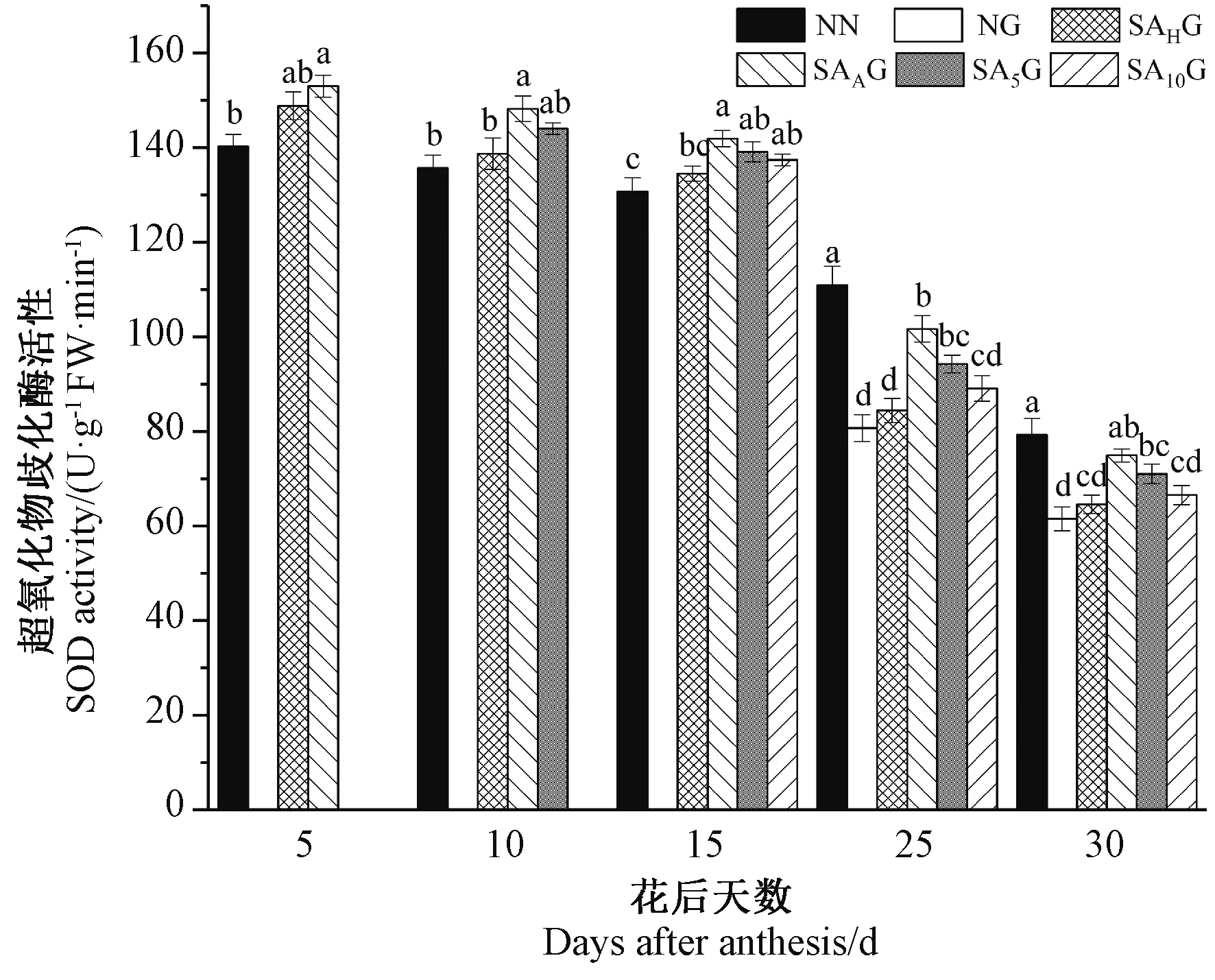
图5 外源SA对灌浆期高温胁迫下小麦旗叶超氧化物歧化酶活性的影响Fig.5 Effects of exogenous salicylic acid on superoxide dismutase activity in flag leaves of wheat under high temperature stress during grain filling period
2.5 外源SA对灌浆期高温胁迫下小麦旗叶POD活性的影响
由图6可知,灌浆期高温胁迫前,各处理条件下的小麦旗叶POD活性均高于对照。灌浆期高温胁迫后,与对照相比,高温胁迫显著降低了小麦旗叶POD活性,不同阶段的SA预喷施后,各处理条件下的小麦旗叶POD活性均高于高温胁迫处理,这表明SA预喷施缓解了高温胁迫下小麦旗叶POD活性的降低,且开花期预喷施SA对高温胁迫的缓解效果较好。说明外源SA能够提高小麦旗叶POD活性,减少活性氧积累,抵御膜脂过氧化,保护膜结构完整性,减缓高温带来的伤害。
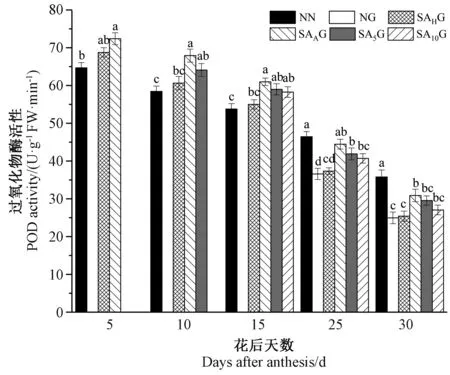
图6 外源SA对灌浆期高温胁迫下小麦旗叶过氧化物酶活性的影响Fig.6 Effects of exogenous salicylic acid on peroxidase activity in flag leaves of wheat under high temperature stress during grain filling period
2.6 外源SA对灌浆期高温胁迫下小麦旗叶CAT活性的影响
由图7可知,小麦旗叶CAT活性随着生育进程的推进而呈现逐渐下降的趋势。灌浆期高温胁迫前,各处理条件下的小麦旗叶CAT活性均高于对照。灌浆期高温胁迫后,与对照相比,高温胁迫显著降低了小麦旗叶CAT活性,在不同阶段的SA预喷施后,各处理条件下的小麦旗叶CAT活性均高于高温胁迫处理,但只有开花期预喷施SA处理(SAAG)在花后25 d时与高温胁迫处理之间达到显著差异,这表明SA预喷施对高温胁迫下小麦旗叶CAT活性的降低有所缓解,且在不同时期SA预喷施对灌浆期高温胁迫下小麦旗叶CAT活性缓解效果表现为开花期预喷施SA最好,抽穗期预喷施SA最差。这表明灌浆期高温胁迫不利于花后旗叶抗氧化保护系统活性的维持,而经过外源SA预处理可以缓解灌浆期高温胁迫对抗氧化酶活性的抑制。
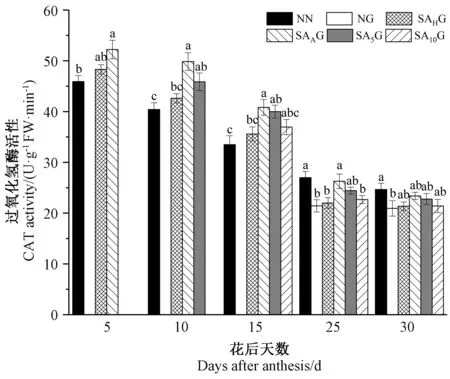
图7 外源SA对灌浆期高温胁迫下小麦旗叶过氧化氢酶活性的影响Fig.7 Effect of exogenous salicylic acid on catalase activity of wheat flag leaf under high temperature stress during grain filling period
2.7 外源SA对灌浆期高温胁迫下小麦旗叶PAL活性的影响
由图8可知,灌浆期高温胁迫前,各处理条件下的小麦旗叶PAL活性均高于对照。灌浆期高温胁迫后,与对照相比,高温胁迫显著降低了小麦旗叶PAL活性,不同阶段的SA预喷施后,开花期(SAAG)、花后5 d(SA5G)和花后10 d(SA10G)预喷施SA处理的小麦旗叶PAL活性均显著高于高温胁迫处理,这表明SA预喷施处理使高温胁迫下小麦旗叶PAL活性有所提高,且开花期预喷施SA对高温胁迫的缓解效果较好。
2.8 外源SA对灌浆期高温胁迫下小麦旗叶PPO活性的影响
由图9可知,小麦旗叶PPO活性随着生育进程的推进而呈现逐渐下降的趋势。灌浆期高温胁迫前,各处理条件下的小麦旗叶PPO活性均高于对照。灌浆期高温胁迫后,与对照相比,高温胁迫显著降低了小麦旗叶PPO活性,在不同阶段的SA预喷施后,各处理条件下的小麦旗叶PPO活性均显著高于高温胁迫处理,这表明SA预喷施对高温胁迫下小麦旗叶PPO活性的降低有所缓解,且在不同时期SA预喷施对灌浆期高温胁迫下小麦旗叶PPO活性缓解效果表现为开花期预喷施SA处理最好,其次依次为花后5 d、花后10 d和抽穗期预喷施SA处理。
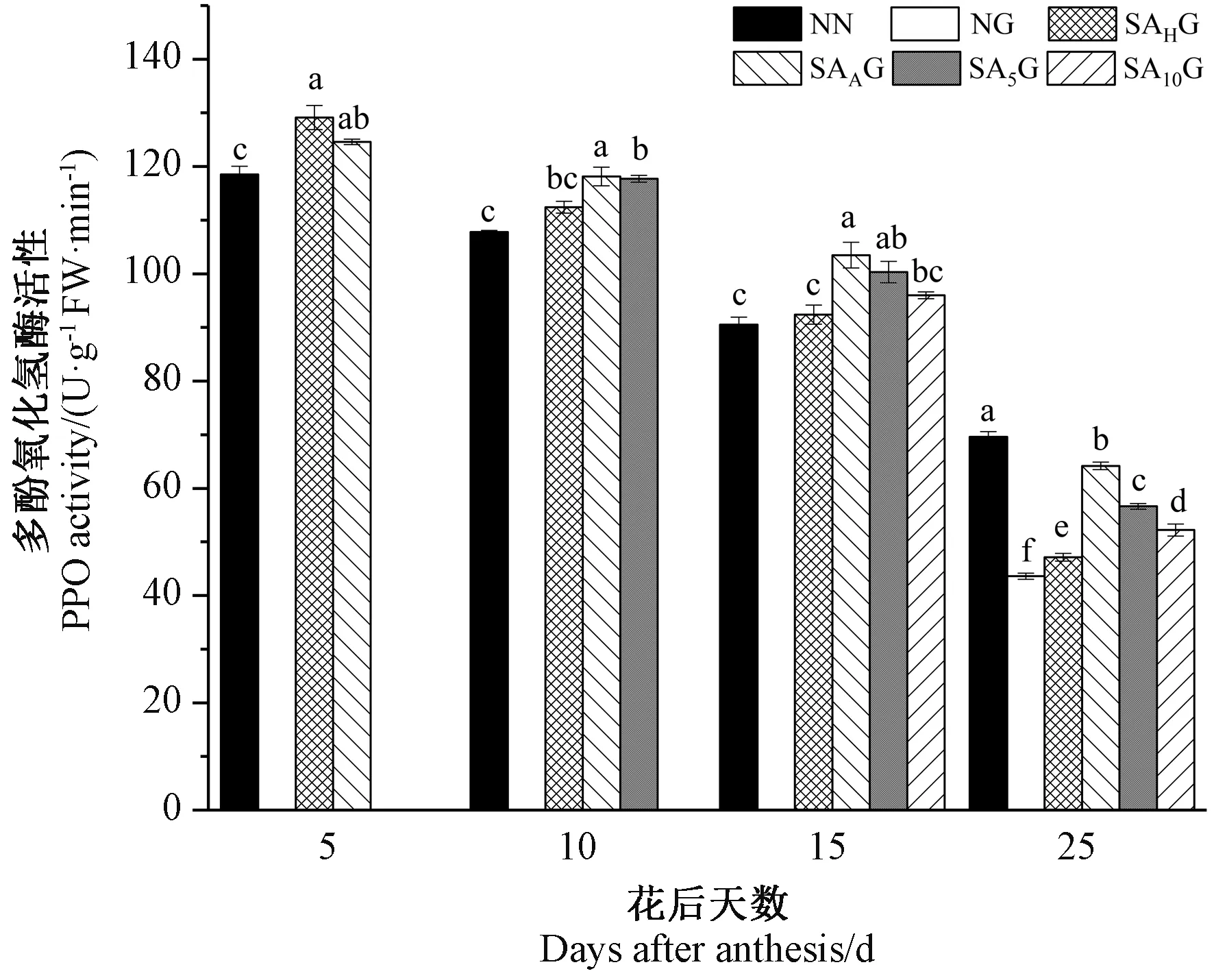
图9 外源SA对灌浆期高温胁迫下小麦旗叶多酚氧化酶活性的影响Fig.9 Effects of exogenous salicylic acid on the activity of polyphenol oxidase in flag leaves of wheat under high temperature stress during grain filling period
3 讨论
3.1 外源SA对灌浆期高温胁迫下小麦膜质过氧化的影响
本试验结果表明,灌浆期高温胁迫使得小麦旗叶MDA含量和H2O2含量显著增加,旗叶O2.-产生速率加快,高温胁迫加剧了小麦细胞膜脂过氧化程度。与高温胁迫处理相比,不同时期外源SA预喷施缓解了高温胁迫对小麦的伤害程度,小麦旗叶MDA含量和H2O2含量有所降低,旗叶O2.-产生速率减慢,这将有利于减缓花后旗叶的氧化速率,缓解高温胁迫对小麦细胞膜系统的损伤,从而延缓旗叶衰老,这与孙艳等[25]在黄瓜中的研究结果一致。此外,SAAG处理条件下旗叶MDA积累最少,H2O2和O2.-产生速率较慢,这表明本研究中开花期预喷施SA可以更好地缓解小麦高温伤害。有研究指出,外源SA预处理可加强植物诸多防御反应机制,如生成植保素及各种ROS、生成相关酶、诱导病程相关蛋白,最后使得植物的抗性得以提升[26-27]。梁永富等[28]研究表明,高温胁迫条件下,外源喷施SA能够诱发多花黄精叶片的气孔开放,提升光合作用效率,一定程度上保证植物逆境中光合作用的进行。这也验证了本研究中喷施外源SA可以缓解高温胁迫对小麦细胞膜造成的伤害,有利于保持光合膜的完整性和光合作用的正常运行。
3.2 外源SA对灌浆期高温胁迫下小麦抗氧化酶活性的影响
植物体内的抗氧化酶系统是其免遭逆境胁迫的重要屏障,主要包含SOD、POD和CAT等。SOD是首要防线,可清除细胞中过量的O2.-,把其歧化成H2O2与O2,CAT和POD催化H2O2转化成无毒的H2O以及O2[29-30]。小麦对高温胁迫的反应主要通过提高SOD、POD和CAT的活性来快速启动其抗氧化系统[1]。本试验发现,高温胁迫下小麦旗叶SOD、POD和CAT活性与对照相比显著降低,细胞膜脂过氧化程度加剧,衰老加快。外源SA预喷施后提高了小麦旗叶抗氧化酶的活性,使得高温胁迫下小麦旗叶保持较高的氧化还原水平,降低了活性氧对细胞的伤害,这与单长卷等[31]的研究结果相一致。何亚丽等[32]指出,SA和热锻炼增强植物耐热能力的作用机制相类似,上述两种处理方法使植物在热胁迫下产生大量热激蛋白(heat shock protein, HSPs),保持CAT和SOD活性,提高植物的抗氧化性能,减轻高温诱导的氧化胁迫对植物的损伤,确保细胞膜的稳定性,并最终提高抗热性。在本研究中,开花期外源喷施SA后,小麦旗叶抗氧化酶活性提高程度较为显著,这将有利于植株体内过量活性氧的清除和光合机构完整性的保持,有助于提高高温胁迫下小麦的光合能力,为小麦产量形成提供物质条件。
PAL是连接植物初级代谢与苯丙烷类代谢的关键酶,且催化苯丙烷类代谢第一步反应。诸多植物在暴露于紫外线[33]、干旱[34]、寒冷[35]等非生物胁迫后,防卫系统尤其是苯丙烷类代谢被激发,PAL活性快速升高,故PAL活性可以反映植物抗逆能力。PPO参与酚类聚合,酚类物质的累积也被认为和植物抵抗非生物胁迫相关,在热胁迫[36]、水分胁迫[16]以及冷胁迫[37]条件下均已观察到此现象。本试验结果表明,高温胁迫显著降低了小麦旗叶PAL和PPO活性,降低了植株的抗逆能力,而不同时期预喷施SA后,旗叶PAL和PPO活性显著提高,推测原因是外源SA通过提高PAL活性促进了苯丙烷代谢途径,激活了PPO活性,催化了多酚类物质氧化,促进了酚类物质积累,进而提高了小麦抵御高温胁迫的能力。
4 结论
本研究结果表明,灌浆期高温胁迫加速了小麦旗叶膜脂过氧化,降低了抗氧化酶活性,进而导致叶片衰老加剧。外源喷施SA后,旗叶抗氧化酶活性有所提高,增强了旗叶清除活性氧的能力,抗逆酶苯丙氨酸解氨酶和多酚氧化酶活性提高,表明外源SA增强了小麦对高温环境的抵抗能力,从而延缓了旗叶的衰老速率。此外,开花期预喷施外源SA对高温胁迫的缓解效果最好。
