二苯-α-吡喃酮类链格孢霉毒素和人血清白蛋白的相互作用及机理探究
2022-09-21任思瑞李道亮周鸿媛张宇昊
任思瑞 李道亮 周鸿媛 郭 婷 张宇昊,2 马 良,2,*
(1 西南大学食品科学学院,重庆 400715;2 西南大学生物学研究中心,重庆 400715)
链格孢霉菌属极易污染小麦、大麦、燕麦、高粱等农作物和番茄、柑橘、苹果等果蔬及其制品[1-4],其次级代谢产物主要有二苯-α-吡喃酮类链格孢霉毒素[链格孢酚单甲醚(alternariol monomethyl ether,AME)、链格孢酚(alternariol,AOH)和交链孢烯(altenuene,ALT)等]、四酸类链格孢霉毒素[细交链格孢菌酮酸(tenuazonic acid,TeA)和异-细交链格孢菌酮酸(iso-tenuazonic acid,iso-TeA)]等[5-6]。其中AME和AOH由于污染范围广、毒性较大而受到较高关注[7-9]。研究表明,AME和AOH对动物体具有潜在致癌性、发育与遗传毒性作用,且二者之间具有协同效应[10]。但目前链格孢霉毒素毒性资料较为缺乏,绝大多数国家和地区针对此类毒素仍没有限量标准。2019年欧盟发布了一份监测食品中链格孢霉毒素(AME、AOH、TeA)的建议草案,建议AME和AOH在加工番茄制品、芝麻、葵花籽、葵花籽油以及婴幼儿谷类食品的基准值为5~30 μg·kg-1[11-14],这对补充和完善相关的毒理学资料具有重要意义。人血清白蛋白(human serum albumins,HSA)是外源性小分子进入血液中的常见转运工具[15-17]。本研究体外模拟生理血液pH条件,通过稳态荧光光谱、同步荧光光谱、3D荧光光谱和圆二色光谱方法,探究二苯-α-吡喃酮类链格孢霉毒素(AME、AOH)与HSA的相互作用,并对其相互作用过程中的猝灭速率常数、结合常数、结合位点数、结合距离、结合作用力等信息进行分析,初步探讨链格孢霉毒素结构性质及其与人血清白蛋白相互作用后对蛋白结构变化的影响,这对补充和完善该类毒素的毒理学资料及其安全风险评估具有重要意义,还可对该类毒素进行有效评估、防控,为其在农作物及其制品、饲料等农业产品中限量标准的制定提供依据。
1 材料与方法
1.1 材料与试剂
HSA(规格>96%),美国Sigma-Aldrich公司;AME(规格>99%)、AOH(规格>99%),新加坡Pribolab公司;乙腈(色谱纯),美国Honeywell公司;Tris(分析纯),美国Bio Basic公司;HCl(分析纯),成都科龙化工试剂公司。
1.2 仪器与设备
F-380荧光分光光度计,天津港东科技发展股份有限公司;UV-1800紫外分光光度计,上海美析仪器有限公司;MOS-500圆二色谱仪,法国Bio-Logic公司;SDC-6恒温水浴循环,宁波新芝生物科技股份有限公司;HH-S2恒温水浴锅,郑州长城科工贸有限公司;pHS-25酸度计,上海雷磁仪器有限公司;Milli-Q超纯水仪,美国Millipore公司;QL 901涡旋振荡仪,海门市其林贝尔仪器制造有限公司。
1.3 试验方法
1.3.1 荧光光谱测定方法
1.3.1.1 稳态荧光光谱法 在1 cm光径的荧光比色皿中进行光谱扫描,血清白蛋白的浓度固定为5 μmol·L-1, AME/AOH的最终浓度为0、2.5、5、10、15、20 μmol·L-1[16]。控制检测温度为25、31、37℃,激发波长为280 nm,扫描速度为240 nm·min-1,激发和发射狭缝均为5 nm,电压为400 V,增益为3。记录血清白蛋白在300~550 nm波长下的荧光光谱。校正后的荧光强度计算公式如下[18]:
(1)
式中,Fcor为校正后的荧光强度;Fobs为观测到的荧光强度;Aex和Aem分别为受试毒素在激发波长和最大发射波长处的吸光度值。
1.3.1.2 3D荧光光谱法 固定血清白蛋白的浓度为5 μmol·L-1,AME和AOH最终浓度为0和20 μmol·L-1。 激发波长为260~320 nm,发射波长为260~400 nm,扫描间隔为2 nm,扫描速度为240 nm·min-1, 激发和发射狭缝均为5 nm,电压为400 V,增益为3。测定该体系的3D荧光光谱。
1.3.1.3 同步荧光光谱法 固定血清白蛋白的浓度为5 μmol·L-1,AME和AOH浓度为0、2.5、5、10、15、20 μmol·L-1。在激发波长260~320 nm条件下,收集发射波长275~335 nm范围内的荧光光谱(Δλ=15 nm)。在激发波长250~320 nm条件下,收集发射波长310~380 nm范围内的荧光光谱(Δλ=60 nm)。扫描速度为240 nm·min-1,激发和发射狭缝均为5 nm,电压为400 V,增益为3。
1.3.2 相互作用的猝灭常数计算方法 利用Stern-Volmer方程对不同温度下(25、31、37℃)的荧光猝灭数据进行分析[19-20]。
(2)
式中,F0和F分别代表不存在和存在毒素时血清白蛋白的荧光强度;Ksv为Stern-Volmer猝灭常数(L·mol-1);Q为受试毒素的浓度(mol·L-1);Kq为血清白蛋白的猝灭速率常数(L·mol-1·s-1);τ0为不存在毒素时血清白蛋白的平均荧光寿命(一般为10-8s)。
1.3.3 相互作用的结合常数计算方法 参照Sun等[21]的方法,在不同温度下,假设蛋白质P上有n个猝灭剂Q的结合位点,则有以下方程:
nQ+P→QnP
(3)
(4)
如果总的蛋白含量为P0,则有P0=QnP+P,其中P为未结合的蛋白。
(5)
F0和F分别代表不存在和存在猝灭剂时血清白蛋白的荧光强度;Q为受试毒素的浓度(mol·L-1);Ka为结合常数;n为结合位点数。
1.3.4 相互作用的热力学参数计算方法 根据van’t Hoff方程计算AOH/AME-HSA结合作用的热力学参数ΔH和ΔS[22]。
(6)
式中,Ka为相应温度下的结合常数;R为气体常数,8.314 J·mol-1·K-1;以lnKa为纵坐标,1·T-1为横坐标作图,线性拟合后可得ΔH和ΔS。各温度下的自由能变化ΔG可由Gibbs方程计算得出:
ΔG=ΔH-TΔS
(7)
1.3.5 相互作用的结合距离测定方法 在不同温度下,通过以下公式计算HSA(供体)和AOH/AME(受体)之间的结合距离和能量转移效率[23]:
(8)
式中,F和F0为毒素存在和不存在时血清白蛋白的荧光强度;R0为能量转移效率为50%时的临界距离;r为能量供体和受体之间的结合距离。
(9)
式中,K2为偶极子的空间取向因子;N为介质的平均折射率;φ为供体的荧光量子产率;J为供体荧光发射光谱和受体紫外吸收光谱的重叠积分。对于HSA,K2=2/3,N=1.336,φ=0.118。
(10)
式中,F(λ)为供体在波长λ处的荧光强度;ε(λ)为受体在波长λ处的消光系数。
1.3.6 圆二色光谱测定方法 在不同温度下,使用0.1 mm的石英比色皿,HSA浓度为10 μmol·L-1,在与AME/AOH的浓度比为1∶0、1∶1、1∶2、1∶3条件下测定圆二色谱数据。扫描间隔1 nm,带宽2 nm,采集持续时间1 s,测定波长为200~250 nm。每个样品测定3次取平均值。使用以下公式将数据单位转换为平均残留椭圆率(mean residue ellipticity,MRE)[24]:
(11)
式中,MRE为平均残留椭圆率(deg·cm2·d·mol-1);θobs为仪器测量值(mdeg);n为蛋白质的残基数,HSA为584;c为血清白蛋白的浓度(mol·L-1);l为比色皿光径(cm)。
通过以下公式计算HSA的α-螺旋含量:
(12)
1.4 数据处理
使用Excel 2019收集和处理数据,使用Origin 2018软件进行数据分析和绘图。
2 结果与分析
2.1 AME和AOH与HSA互作类型研究
通过小分子毒物对血清白蛋白内源荧光的猝灭作用可判断二者之间的互作类型[25]。由图1可知,随着AME和AOH浓度的增加(2.5~20 μmol·L-1),HSA荧光强度逐渐降低,发生明显荧光猝灭,说明二者发生了相互作用。随AME毒素浓度的不断增加,HSA-AME的荧光值不断增加并在475 nm处显示一个新荧光峰,可能是由于二者互作发生荧光能量转移形成了复合物。

图1 不同浓度AME、AOH存在下HSA的荧光发射光谱Fig.1 Fluorescence emission spectra of human serum albumins in the absence and presence of increasing concentrations of toxins
由表1可知,随着温度的升高,AME-HSA和AOH-HSA体系的猝灭常数(quenching constant,Ksv)值和结合常数(association constant,Ka)值及猝灭速率常数(quenching rate constant,kq)均呈下降趋势,体系的猝灭速率常数Kq均远大于生物分子的最大扩散速率常数(2×1010L·mol-1·S-1)[25]。表明AME、AOH与HSA发生了静态猝灭(动态荧光猝灭是由体系中分子碰撞造成,表现为Ksv随温度的升高而升高),并形成了复合物。除AOH-HSA在25℃结合下的Ksv
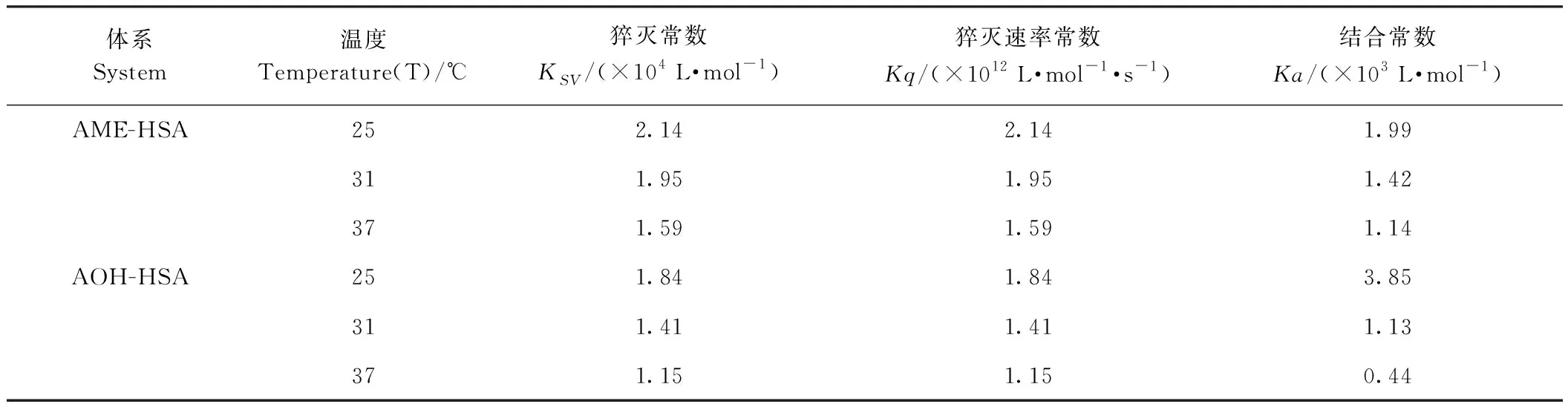
表 1 不同温度下AME/AOH-HSA相互作用的猝灭常数Table 1 The quenching constants for serum albumins and toxins interaction at different temperatures
2.2 AME和AOH与血清白蛋白互作的结合位点数和结合距离
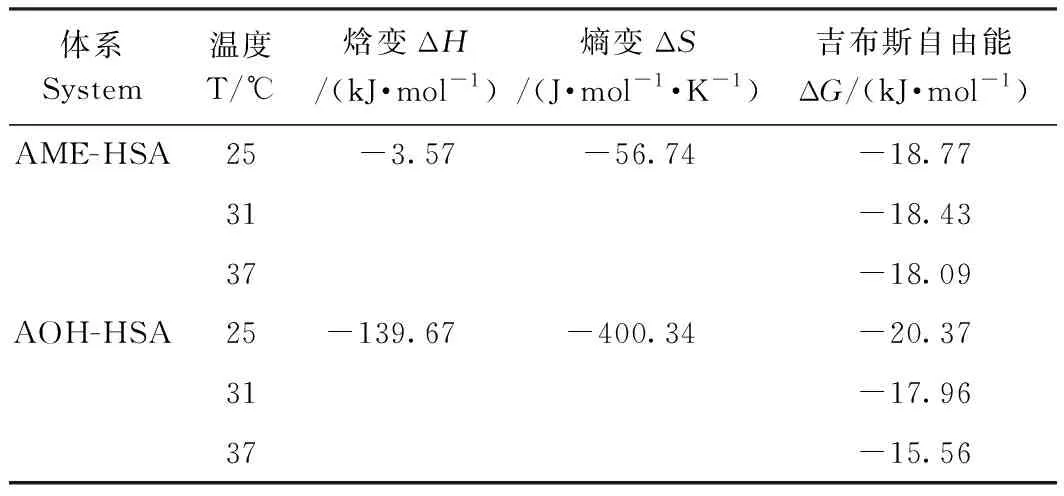
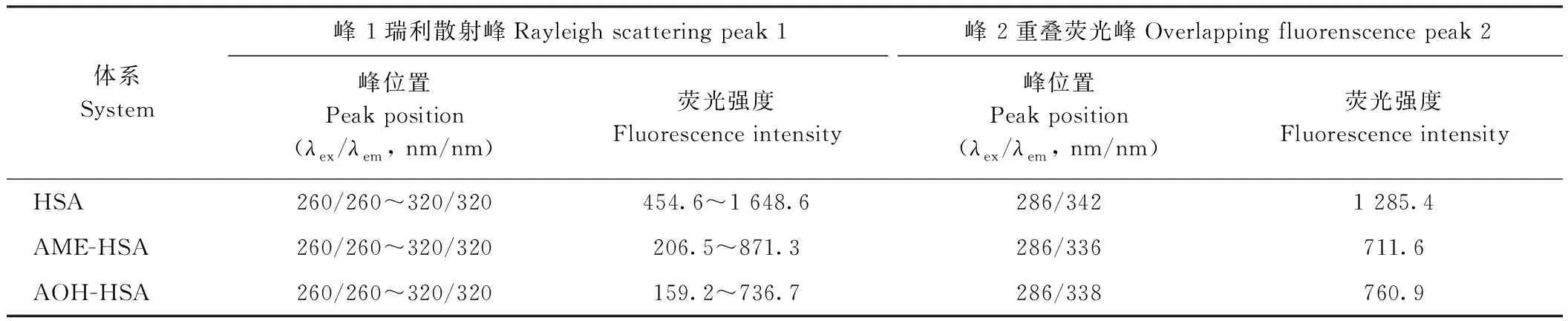
由图2和表2可知,在所研究的温度(25、31、37℃)下,两种毒素与HSA可形成1∶1复合物,且随着温度的升高,结合位点数逐渐降低,说明两者结合程度逐渐降低。AME(r1=2.56 nm)和AOH(r2=2.60 nm)结合距离r<8 nm,且满足r1 图2 AME和AOH的紫外光谱与HSA荧光光谱的重叠图Fig.2 The overlap of the UV absorption spectrum of toxins with the fluorescence emission spectrum of human serum albumins 表 2 AME和AOH-HSA相互作用的能量转移参数及不同温度下的结合位点数Table 2 Energy transfer parameters and the number of binding sites for for serum albumins and toxins interaction at different temperatures 由表3可知,所有相互作用体系中的ΔG均小于0,表明结合反应是自发进行的;ΔH<0,ΔS<0,表明两种毒素与HSA的结合作用力主要为氢键和范德华力。随着温度升高,AME和AOH与HSA相互作用的ΔG逐渐降低,氢键和范德华力削弱[27]。 表3 不同温度下AME和AOH与HSA相互作用的热力学参数Table 3 Thermodynamic parameters for HSA and AME and AOH interaction at different temperatures 由表4和图3可知,AME、AOH的加入可与HSA形成复合物,表现为峰1(瑞利散射峰:λex=λem)和峰2(Trp、Tyr和Phe的重叠荧光峰)荧光强度下降。而两者的加入并未使Tyr残基最大发射波长蓝移,图4-B、D显示Trp残基发生了蓝移(AME蓝移1 nm,AOH蓝移1.4 nm),表示AME和AOH可使Trp残基微环境疏水性增加,极性降低,说明两者与HSA的结合位置更靠近Trp残基,并推测可能位于结合位点I(亚结构域IIA)的空腔中,可针对该结合位点研究AME、AOH的毒性干预措施。 由图4可知,随着AME和AOH的加入,HSA的CD光谱峰形位置未发生明显变化,表明HSA仍然以α-螺旋结构为主;与HSA∶AME=1∶0相比,在208 nm和222 nm处的峰强度逐渐增大,表明AME、AOH与HSA的结合会导致α-螺旋结构减少,使α-螺旋含量从48.93%分别减少至39.41%和44.01%,同时AME、AOH的加入会使HSA的二级结构发生改变,在相同浓度下,AME可更大程度地改变HSA结构。 表4 HSA和AME/AOH相互作用前后的3D荧光特征参数Table 4 Three-dimensional fluorescence spectral characteristics for serum albumins and toxins interaction 图3 不同浓度的AME和AOH存在下HSA的同步荧光光谱Fig.3 Synchronous fluorescence spectra of human serum albumins in the absence and presence of increasing concentrations of AME and AOH 注:A:HSA-AME;B:HSA-AOH;HSA浓度:10 μmol·L-1;AME和AOH浓度:0、10、50 μmol·L-1。Note: A: HSA-AME. B: HSA-AOH. The concentration of HSA: 10 μmol·L-1. The concentrationof AME and AOH: 0,10,50 μmol·L-1.图4 不同比例AME和AOH存在下HSA的圆二色光谱Fig.4 CD spectra of human serum albumins in the absence of toxins 链格孢霉毒素是一种广泛存在于农产品及其相关制品中的一类毒素,研究其与人血清白蛋白的结合方式及结合位点,可以进一步了解该毒素在体内的代谢作用。本研究发现,AME/AOH与HSA之间会发生相互作用,并形成一种1∶1复合物,表明毒素在进入体内后有与人体内血清白蛋白结合的可能,并随着血液转运到身体的其他器官、组织中,发挥毒性作用。本研究还发现两种毒素与HSA在色氨酸残基附近结合,位于结合位点I(亚结构域IIA)的空腔中,对其结合位置的确定可为链格孢霉毒素减毒技术的研究提供参考。此外,对比发现AME与HSA之间有更强的结合力,反映出AME可能在体内有更长的半衰期并发挥持续毒性作用,比AOH更易转运到机体各处。Ma等[28]和Li等[29]分别利用玉米赤霉烯酮(zearalenone,ZEN)和脱氧雪腐镰刀菌烯醇(deoxynivalenol,DON)与血清白蛋白[牛血清白蛋白(bovine serum albumin,BSA)和HSA]发生互作,发现两种毒素均通过静态机制猝灭血清白蛋白荧光,并通过疏水作用力和静电相互作用发生互作,且会改变血清白蛋白的二级结构,这与本研究中AOH和AME可改变HSA二级结构的结果相似。这些研究表明,不同真菌毒素与血清白蛋白之间会发生不同的交互作用,有利于深层次探索真菌毒素毒性,但链格孢霉毒素的具体结合位置、结合方式及体内毒性还需进一步深入研究。 目前链格孢霉毒素在农作物及其制品中的限量标准尚不完善。本研究明确了二苯-α-吡喃酮类链格孢霉毒素与HSA之间的互作过程及机理,有利于进一步了解该类毒素进入体内的转运、代谢等毒动力过程,补充和完善链格孢霉毒素相关毒理学资料,并为该类毒素在农作物及粮食制品中限量标准的制定提供依据,对有效防治该类毒素在农业中的污染,减少经济损失具有重要意义。 本试验利用稳态荧光光谱、3D荧光光谱、同步荧光光谱以及圆二色光谱等方法研究AME和AOH与HSA的相互作用,结果表明,AME和AOH通过静态猝灭与HSA发生相互作用,以氢键和范德华力作用形成1∶1复合物,且两种毒素的结合会使HSA二级结构以及色氨酸残基微环境改变,结合位点更可能位于色氨酸残基所在的空腔(HSA亚结构域IIA 结合位点I);其中AME对HSA的猝灭程度更大,结合距离也更近,AME与HSA之间表现出更强的亲和力,表明其在体内可能会有更长的毒性作用时间。

2.3 AME和AOH与HSA互作结合过程中的作用力
2.4 AME/AOH对HSA上结合位置微环境的影响
2.5 AME/AOH对血清白蛋白结构的影响


3 讨论
4 结论
