野生彩茶“蓝宝石”抗褐化及丛生芽诱导研究
2022-09-21杨玉珍
杨玉珍
(南阳农业职业学院植物组织培养中心,河南南阳 473000)
野生彩茶“蓝宝石”(cv. “lanbaoshi”),属山茶科山茶属灌木小叶种变种,发现于大别山腹地桐柏山天云峰北斗湖畔,牙尖初期呈紫红色,散开后逐渐变蓝色至深蓝色。有反射蓝光,故命名为“蓝宝石”。送检结果表明,其花青素含量约6.4 mg/g、氨基酸4.4%、茶多酚22.8%、茶红素8.65%、茶褐素8.07%、茶黄素0.61%、咖啡碱3.8%。制作绿茶汤色黄绿相间,制作红茶形如火焰,棕红鲜艳,香味醇厚耐泡。彩茶母树稀缺,若采用传统的扦插繁育,由于基数少,成苗需3年左右,远远不能满足市场对该珍贵彩茶种苗的需求,因此急需快速大量繁育。目前,茶树组织培养技术虽有成功先例,但彩茶尚缺少相关组织培养研究。有关资料显示,茶树组织培养中因多酚含量高,且自身携带较多内生菌,导致外植体易污染、褐化严重、难以分化和生长缓慢等,其中最关键的问题是褐化,尤其是彩茶,检测结果显示其茶黄素、茶红素、茶褐素、茶多酚、儿茶素、咖啡碱含量均较高,外植体更易褐化死亡。外植体能否克服褐化成活下来,是决定后期能否继续开展组培与快速繁育的关键,也是彩茶良种无性繁殖技术的瓶颈问题。因此,笔者以彩茶“蓝宝石”新生枝条为外植体进行组织培养,探寻建立快速繁育的关键技术,以期为彩茶产业化种植提供技术支撑。
1 材料与方法
供试材料为桐柏山野生彩茶“蓝宝石”母株上采集的新生枝条。试验地点在南阳农业职业学院植物组织培养中心。
将健壮彩茶枝条从山上带回后冲洗干净,基部浸泡在洁净水中2 d,置于阴凉低温处,每天换水,接种当天把枝条取出,将彩茶“蓝宝石”基部成熟叶片摘下,用洗涤剂溶液浸泡5 min左右,用软毛刷仔细清洗后,剪成1.5 cm左右带腋芽的茎段。将带腋芽的茎段分别用0.1%高锰酸钾溶液浸泡2 h,然后用800倍甲基托布津溶液浸泡2 h,然后用自来水冲洗0.5 h。
不同灭菌时间处理。将预处理后的茎段置于超净工作台上,先用75%乙醇消毒20 s,再置于0.1% HgCl溶液中分别处理10、12、15、20、25 min,再用无菌水冲洗5遍;根据文献资料和预备试验结果,用MS作为基本培养基,5个处理时间分别接种20瓶,每瓶接种1个茎段,10 d后观察统计污染率、褐化率。
添加不同抗褐化成分对比。MS分别加入10 mg/L V溶液、1 g/L AC、100 mg/L PVP、10 mg/L V+1 g/L AC及对照(CK)共5个处理,每处理接种20瓶,每瓶接种1个茎段,10 d后观察统计污染率、褐化率。
不定芽诱导培养。将获得的无菌茎段接种到培养基上,选取6-BA、NAA、IBA 3种激素进行不同浓度的组合配比试验,MS培养基为基本培养基,探讨其对彩茶“蓝宝石”腋芽萌发的影响。每处理分别接种20瓶,每瓶接种1个外植体茎段,定期观察无菌芽的生长情况,30 d后统计腋芽诱导情况。
丛生芽增殖培养。根据文献资料和以上的试验结果,选择 MS+1.0 mg/L 6-BA为基础培养基,设置NAA浓度为0.5~1.0 mg/L,6-BA浓度为1.0~3.0 mg/L,IBA浓度为1.0~2.0 mg/L,GA浓度为0.5~1.0 mg/L,将诱导培养获得的不定芽分切后,接种到增殖培养基上,每处理接种20瓶,每瓶接种1个芽丛,35 d后观察芽的生长情况。
培养条件。以MS培养基为基本培养基,3%蔗糖,0.5%琼脂,pH 为5.6~5.8。光照时间12 h/d,强度2 500 lx,温度控制在22~24 ℃。
2 结果与分析
由于茶树植株中酚类物质含量高,外植体切割时伤口的多酚类物质遇到氧气产生褐色醛类物质,易扩散到培养基使外植体和培养基褐变,以致外植体死亡。农艳丰等研究发现,在培养基中添加1.0 g/L V和1.0 g/L AC,能将外植体的褐化率降至41%。根据相关文献、预备试验和以往经验,在培养基中加入抗氧化剂及吸附剂也能减轻外植体在组织培养过程中褐变,如在培养基中加入抗氧化剂V、PVP、活性炭,可以吸附培养基中的醌和酚等有害物质,减轻褐变。因此,笔者首先将外植体基部浸泡在洁净水中1 d,置于阴凉低温处,每天换水进行统一预处理,以有效隔断氧化,溶解、稀释伤口产生的酚类物质,减少酚类物质在培养基中的富集,有效减轻褐变。茶树组织培养分为一般性污染和内源性污染。内源性污染是由植株自身携带的内生菌引起的,一般的表面灭菌难以达到应有的效果,建立无菌体系时,极易发生内生菌污染。试验用0.1%高锰酸钾溶液浸泡2 h,使高锰酸钾对浸泡的茎段切口产生氧化,从而预先去除部分醌类物质,以抑制褐化现象;然后用800倍甲基托布津溶液进行浸泡2 d,以减少表面及内生菌引起的污染,一系列预处理可有效降低因外植体灭菌处理时间过长导致的褐化死亡和污染。
将外植体采用 0.1% HgCl按不同时间灭菌,接种后20 d调查记录,比较不同灭菌方式处理效果。由表1可知,对外植体采用不同灭菌时间处理,灭菌时间过长,对材料造成伤害,导致材料褐化枯死。处理12 min时间过短,灭菌不彻底,材料污染率高,达90%;处理24 min污染率低(20%),但大部分茎段褪去绿色褐化死亡,枯死率达70%,说明灭菌剂在灭菌的同时伤害了茎段;灭菌处理20 min茎段污染率为35%,存活率达到35%,较为理想。

表1 不同灭菌时间对茎段存活率的影响Table 1 Effect of different sterilization time on stem survival rate
在预处理的基础上,批量采用75%乙醇进行表面消毒20 s,0.1% HgCl灭菌处理外植体20 min,接种10 d后,将存活茎段转接到不同培养基中进行进一步抗褐化处理。由表2可知,不同处理对抗褐化均有一定的效果,4 个处理与 CK 相比,褐化率均有所降低,均控制在 45% 及以下。培养基中以添加10 mg/L V+1 g AC效果最好,存活率达75%。这与农艳丰等的研究结果一致。该试验表明,彩茶培养基中同时添加1 g/L AC和10 mg/L V能有效防止褐化。
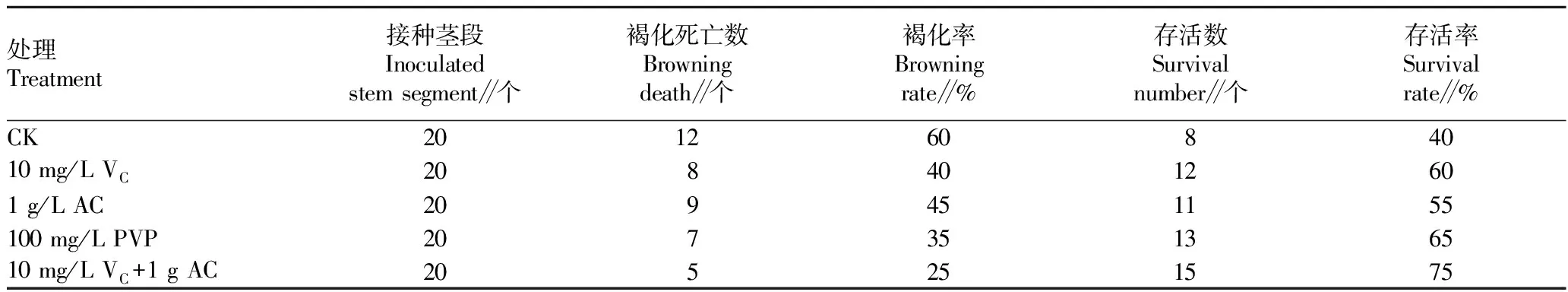
表2 不同添加物对外植体的抗褐化效果Table 2 Anti-browning effect of different additives on explants
茎段在启动培养基上15 d侧芽开始萌动,30 d后将启动培养的侧芽切下,接种于添加不同激素的不定芽诱导培养基上,30 d后统计不同培养基中的不定芽生长情况。由表3可知, 6-BA浓度在0.5~1.0 mg/L 时,丛生芽的长势较好,但2.0 mg/L 6-BA 时,丛生芽的分化数量逐渐减少。当6-BA 浓度为2.0~3.0 mg/L时,外植体的基部诱导出了愈伤组织,腋芽生长缓慢,既不长高也不分化丛生芽。但随着NAA浓度升高,丛生芽的长势变差,芽诱导的个数逐渐减少。当NAA为0.5 mg/L时,丛生芽呈绿色;而当 NAA为1.0 mg/L 时,丛生芽少,比较细弱,向上生长较快。比较配方E、F数据可知,1.0 mg/L 6-BA的培养基添加较高浓度的NAA和IBA时有利于外植体腋芽诱导丛生芽,即1.0 mg/L 6-BA和 0.5 mg/L NAA时,添加IBA对丛生芽的生长有明显的促进作用,此时腋芽诱导丛生芽的效果较好,萌芽数量多,长势最好。不同激素配比处理的不定芽诱导情况见图1。

表3 不同激素配比处理诱导不定芽效果Table 3 Effects of different hormone ratios on the induction of adventitious buds

图1 不同激素配比不定芽诱导情况Fig.1 Adventitious bud induction with different hormone ratios
诱导出不定芽后,需要继续诱导大量丛生芽,试验将诱导出的不定芽转接到不同浓度组合增殖培养基中,筛选最佳增殖培养基,接种后30 d调查丛生芽增殖生长情况,结果见表4。由表4可知,增殖阶段与腋芽诱导不定芽阶段相比,6-BA浓度从1.0 mg/L增加到2.0 mg/L对不定芽的诱导增殖作用更明显,不添加IBA改为添加GA后对不定芽诱导没有明显的促进作用,说明GA对彩茶“蓝宝石”丛生芽诱导生长作用不明显,但过高浓度的6-BA反而导致丛生芽低矮,紧实,生长缓慢。从图2可以看出,处理e的生长情况最好,当6-BA浓度为2.0 mg/L,NAA为1.0 mg/L,IBA 2.0 mg/L时有利于不定芽的分化,芽增殖倍数较高,达7,且苗健壮,生长快。丛生芽在诱导培养基中生长25 d左右,将丛生芽切分后转入新鲜的增殖培养基中培养,每35 d继代1次。
3 结论
该试验在参考前人有关茶树和其他富含内生菌的外植体材料组织培养方案研究的基础上,研究彩茶“蓝宝石”的无菌体系建立及抗褐化方法,诱导出大量丛生芽,为快速繁育稀缺新种质茶树优良种苗奠定基础,同时为茶树良种繁育和资源保存提供技术支持。该试验外植体灭菌预处理为枝条清水浸泡,再用0.1%高锰酸钾溶液浸泡2 h,使高锰酸钾对浸泡中的茎段切口产生氧化,从而预先去除部分醌类物质,以降低酚类物质氧化产生的褐化现象;然后用800倍甲基托布津溶液浸泡2 d以减少表面及内生菌引起的污染,一系列预处理对降低外植体灭菌处理时间过长导致的褐化死亡和污染打下基础。使用浓度0.1% HgCl溶液进行灭菌,以20 min为较好。茎段腋芽诱导不定芽以较低浓度的NAA配合6-BA可诱导丛生芽的生长,但增殖及生长速度不高,前期高浓度6-BA还会导致褐化明显,分析原因可能是由于6-BA刺激多酚氧化酶的活性,在外植体脱分化阶段,分生能力强的细胞大量增殖,酚类的氧化会受到激活,从而诱导出大量愈伤组织生成。因此,野生彩茶腋芽诱导不定芽最佳培养基为MS+6-BA 1.0 mg/L+NAA 0.5 mg/L+IBA 1.0 mg/L;但在丛生芽增殖阶段,已经完成了脱分化,褐变已被抑制,增加激素用量不再引起褐变,诱导出无菌短枝和丛生芽经分切后再用较高浓度激素的培养基,彩茶丛生芽的增殖效果较好,丛生芽的数量多,添加适量IBA后对无菌短枝的伸长效果明显,长势最好,因此筛选丛生芽增殖阶段培养基以MS+6-BA 2.0 mg/L+NAA 1.0 mg/L+IBA 2.0 mg/L为佳。后续需要继续探讨其他激素对生根的影响,筛选最适宜配比。试验还发现试管苗幼嫩丛生芽阶段彩茶叶色表现不明显,大苗阶段会呈现品种特性,生根试验和移栽炼苗还需要进一步探索和研究。
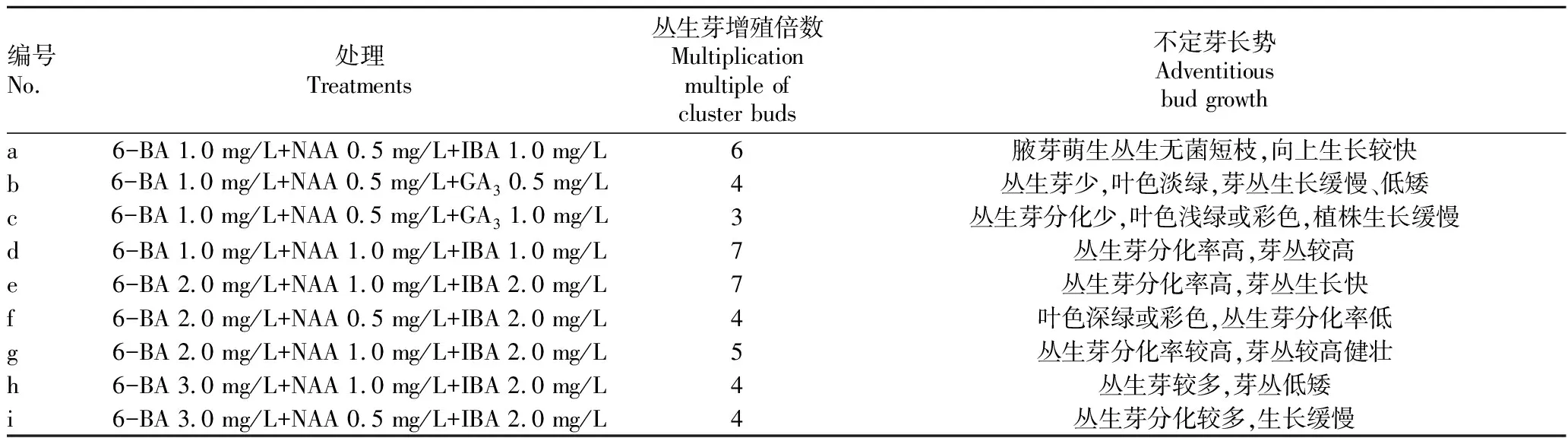
表4 不同激素配比对不定芽增殖的影响Table 4 Effects of different hormone ratio on inducing adventitious bud proliferation

图2 不同激素配比不定芽增殖情况Fig.2 Proliferation of adventitious buds with different hormone ratios
