帕金森病快动眼睡眠行为障碍的临床特征及与血清神经营养因子-3水平相关性分析
2022-09-20
帕金森病(Parkinson’s Disease,PD)是临床常见的慢性神经退行性疾病,疾病基础主要为中脑黑质中多巴胺能神经元渐进性变性坏死,中枢神经系统多巴胺递质缺乏,引起一系列锥体外系功能失调[1]。随着人口老龄化的进展,PD发病率不断升高[2]。目前临床尚无根治方法,给家庭以及社会带来沉重的经济负担。研究发现[3],PD患者由于中脑外其他脑组织损害引起睡眠、自主神经功能以及神经精神等多方面障碍,以睡眠障碍最为常见,主要表现为快动眼睡眠行为障碍(Rapid Eye Movement Sleep Behavior Disorder,RBD)。RBD是在快动眼睡眠期间骨骼肌张力迟缓消失[4],严重影响患者的生活质量。血清神经营养因子-3(NT-3)是中枢神经系统中最重要的一种内源性蛋白,具有调控神经元生长、发育、分化以及生存的作用[5]。本次研究通过统计PD患者中RBD的发生率,比较伴发RBD患者与不伴发RBD患者的临床特征,分析血清NT-3、白细胞介素-1β(IL-1β)与PD伴发RBD的相关性,为临床提供一些参考依据。
1 对象与方法
1.1 对象 选取联勤保障部队第九〇四医院2019年1月~2020年6月收治PD患者86例为研究对象,设为病例组。纳入标准:(1)符合《2016中国帕金森病诊断标准》[6]诊断为帕金森病;(2)患者或家属自愿签署知情同意书;(3)病例资料信息齐全。排除标准:(1)因脑血管疾病、中毒、创伤等原因造成的帕金森综合征;(2)合并恶性肿瘤、较为严重的躯体疾病者;(3)各类原因造成的贫血、铁代谢相关性疾病;(4)沟通困难或精神障碍者。并选取同时期健康体检者50名设为对照组,既往无糖尿病史,口服糖耐量试验结果正常,并且无PD、继发性帕金森综合征、帕金森叠加综合征、RBD等。病例组男67例,女19例,平均年龄(69.48±5.99)岁;对照组男39名,女11名,平均年龄(67.22±8.26)岁。两组一般资料比较差异无统计学意义(P>0.05)。本次研究符合医学伦理学标准,获医院伦理委员会批准。采用快动眼睡眠行为障碍筛查量表(RBDSQ)对病例组进行评定,将RBDSQ≥6分定义为PD伴RBD患者(PRBD组),将RBDSQ<6分定义为PD不伴RBD患者(NPRBD组)。
1.2 方法
1.2.1 一般资料收集 收集所有研究对象的性别、年龄等一般资料信息,病例组的病程以及起病侧信息等。
1.2.2 生化指标检测 采集所有研究对象空腹静脉血,离心(1 200 r/min,15 min)后取血清,置于-80℃冰箱备用待检。采用酶联免疫吸附法测定NT-3、IL-1β水平,操作步骤严格按照试剂盒说明书执行。
1.2.3 运动症状评价 采用Hoehn-Yahr(H-Y)分期[7]评估PD患者伴有运动症状的严重程度,分期越高代表运动症状越重。采用统一帕金森病量表(UPDRS)与改良Webster评分量表评估PD患者的运动症状,评分越高, PD症状越严重。
1.2.4 非运动症状评价 (1)抑郁状态评估:采用汉密尔顿抑郁量表(HAMD)[8]评估,评分>13分提示存在抑郁症状,<8分提示无抑郁状态。(2)焦虑状态评估:采用汉密尔顿焦虑量表(HAMA)[9]评估,评分≤7分表示无焦虑症状,≥14分表示有焦虑症状,≥21分时肯定有明显的焦虑症状。(3)认知功能:采用蒙特利尔认知评估量表(MoCA)[10]评估,≥26分为正常,<26分提示存在轻度认知功能障碍。(4)嗅觉评估:阿根廷嗅觉减退评定量表(AHRS)[11]评估,分值0~24分,分数越低,嗅觉障碍越严重。(5)白天嗜睡程度:爱泼沃斯嗜睡量表(ESS)[12]评估,评分>6分为瞌睡,>10分为非常瞌睡,>16分为存在危险性的瞌睡。(6)PD改良淡漠量表(MAES):分值0~42分,评分与淡漠程度呈正相关。(7)非运动症状问卷调查量表(Non-Motor Symptom Quest,NMSQ)[13]:各项症状各计1分,评分与非运动症状严重程度呈正相关。
1.2.5 日常生活能力与生活质量评价 采用日常生活能力量表(Activity of Daily Living Scale,ADL)评估生活能力,量表总分为0~100分,0分表示日常生活能力完全依赖,40分以下为日常生活能力重度损害,41~60分为日常生活能力中度损害,61分以上为日常生活能力轻度损害。采用PD生活质量问卷(Parkinson Disease Quality of Life Question-39,PDQL-39)评定生活质量,评分越高表示生活质量越差。
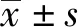
2 结果
2.1 两组血清指标比较 病例组血清NT-3水平为(115.91±26.94)ng/L,对照组血清NT-3水平为(138.39±33.52)ng/L,病例组血清NT-3水平低于对照组(t=4.282,P=0.000)。病例组血清IL-1β水平为(48.03±6.87)ng/mL,对照组血清IL-1β水平为(14.62±3.19)ng/mL,病例组血清IL-1β水平高于对照组(t=32.381,P=0.000)。
2.2 PD患者伴RBD的发生率与临床特征 86例PD患者中,有59例患者伴有RBD,占68.60%。将此59例患者设为PRBD组,余下27例患者设为NPRBD组。PRBD组年龄,H-Y分期,以及RBDSQ、UPDRS、MAES、NMSQ、HAMD、PDQL-39评分,血清IL-1β水平均高于NPRBD组(P<0.05);MoCA、ADL评分以及血清NT-3水平均低于NPRBD组(P<0.05)。见表1。
2.3 PD伴发RBD与血清NT-3、IL-1β的相关性分析 PD伴发RBD与血清NT-3水平呈负相关(r=-0.672,P=0.000),与IL-1β水平呈正相关(r=0.594,P=0.000)。
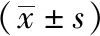
表1 PRBD组与NPRBD组临床特征比较
3 讨论
PD是临床常见的一种神经系统变性疾病,多见于老年人群,神经元的变性死亡是其主要的病理改变,而造成这一病理改变的病因目前尚未统一,遗传、环境、年龄、氧化应激等均参与了PD多巴胺能神经元变性死亡过程[14]。数据显示[15],PD伴发RBD具有较高的发病率,严重影响患者的生活质量。因此识别PRBD患者临床特征与相关因素对及早干预、改善患者生活质量具有重要意义。
本次研究结果显示,86例患者中共有59例伴发RBD,占68.60%,并以此进行分组,分析PD伴发RBD与不伴发RBD患者的临床特征,结果显示,PRBD组年龄,H-Y分期,以及RBDSQ、UPDRS、MAES、NMSQ、HAMD、PDQL-39评分,血清IL-1β水平均高于NPRBD组(P<0.05);MoCA、ADL评分以及血清NT-3水平均低于NPRBD组(P<0.05)。提示PD患者中伴发RBD具有较高的发病率,同时与不伴发RBD患者相比,PRBD患者年龄较大、肌强直与肌张力障碍等运动症状更为严重,抑郁、认知功能损害等非运动症状也更为严重。相关文献指出[16],年龄增加是PD发生的独立危险因素,年龄不断增长,机体内抗氧化功能随之降低,线粒体DNA的氧化损伤程度越严重,促使自由基大量释放增加的同时细胞能量不断减少,进而导致神经递质代谢异常,最终促使细胞凋亡速度加快。而PD患者氧化应激与神经免疫炎症更为显著,促使路易小体在黑质致密部的沉积更多,加剧多巴胺能神经元的损伤,因此运动症状更为严重。淡漠是PD患者极为常见却易被忽视的非运动症状,研究发现,PRBD患者比NPRBD患者更容易出现淡漠,且淡漠的程度更为严重。因此诸多学者认为淡漠与RBD之间存在重要的相关性。RBD与认知功能障碍存在密切联系,大量研究均证实[17,18],PD伴发RBD患者认知功能下降趋势更为显著。由于快动眼期睡眠对巩固记忆、稳定认知等方面具有重要作用,因此这一时期睡眠减少可能会使认知活动受到影响,从而造成认知功能障碍。有研究指出[19],PD伴发RBD患者呈现出不同程度的认知功能受损,主要涉及词语记忆力、非词语记忆力、视空间能力、注意力等方面。可见RBD造成认知功能障碍的风险较高。Laperle AH等[20]研究中指出,PD伴发RBD比PD不伴发RBD的患者出现抑郁症状的风险更高。由于PD患者黑质与脑桥等区域受到损伤,促使投射到相应脑区的神经递质减少,脑干脑桥盖部功能紊乱也参与了RBD的发生。另外,抑郁症状本身也存在入睡困难或早醒等表现,因此与PD伴发RBD之间互为因果,二者互相促进,形成恶性循环[21]。基于此,PD伴发RBD患者存在多种严重的运动症状以及抑郁、认知功能障碍等非运动症状,进而对其生活能力以及生活质量造成影响。
研究证实[22],PD患者运动与记忆障碍与神经元变性以及缺失密切相关,神经营养因子则可促进神经元的增加与分化。NT-3是一种中枢神经系统中极为重要的内源性蛋白,具有调控神经元生长发育、分化生存的作用,同时还可提高神经细胞活性。Holtbernd F等[23]研究中证实,NT-3可有效维持机体钙离子平衡,从而缓解电解质紊乱,对提高自由基的代谢能力具有重要作用,最终有效缓解由此引起的缺血对神经系统的损伤。因此当NT-3表达降低时提示神经元损伤。既往研究中均证实,PD患者脑脊液以及黑质多巴胺能神经元附近存在大量的IL-1β分泌,局部区域炎症反应发生时促使IL-1β表达增加,因此IL-1β水平与神经炎症反应之间关系密切。既往研究证实,IL-1β在PD患者血清中表达显著高于健康人群,因此IL-1β表达水平与PD发生密切相关,且存在一定的线性关系。PD的病理特征为黑质致密部多巴胺能神经元逐渐缺失、特定中枢神经系统区域内的α-突触核蛋白异常聚集以及磷酸化,而α-突触核蛋白具有激活小胶质细胞的作用,从而促使大量IL-1β、IL-6等物质产生。因此PD患者血清中IL-1β表达水平较高。本次研究结果显示,PRBD与血清NT-3呈负相关,与IL-1β呈正相关,提示当NT-3表达降低、IL-1β表达升高时,PRBD发生风险增加。
综上所述,与NPRBD患者相比,PRBD患者年龄更大、运动症状更为严重,合并非运动症状较多,抑郁、认知功能损害更严重。PRBD的发生与血清NT-3、IL-1β密切相关,与NT-3呈负相关,与IL-1β呈正相关。
