建立体外星形胶质细胞活化模型的优化方法
2022-09-20秦洁邱星辰龚光明郑怀信轩小燕王鹏郭艺楠雷蕾
秦洁,邱星辰,龚光明,郑怀信,轩小燕,王鹏,郭艺楠,雷蕾
(1.郑州大学第一附属医院 神经内科,河南 郑州 450000;2.郑州大学基础医学院 微生物学与免疫学系,河南 郑州 450000)
炎症引发的神经系统继发性损伤一直是临床研究的热点,炎症与中枢神经系统疾病的病程和预后密切相关[1]。星形胶质细胞在脑内免疫炎症反应中起重要作用,当创伤、脊髓损伤、感染及退行性病变等发生后,小胶质细胞最先被激活,释放炎症因子如白介素-1β(interleukin-1β,IL-1β)、肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)等,使星形胶质细胞的形态、数目、功能等发生变化,这一过程称为星形胶质细胞活化[2]。活化的星形胶质细胞由静息态转化为反应性星形胶质细胞参与病理情况下的炎症反应、营养因子分泌、瘢痕形成等。胶质纤维酸性蛋白(glial fibrillary acidic protein,GFAP)是星形胶质细胞的骨架蛋白,生理情况下在脑内的表达水平很低,当神经系统受损时,GFAP表达反应性上升是星形胶质细胞活化的典型标志[3]。脂多糖(lipopolysaccharide,LPS)作为一种经典的致炎因子,可以模拟星形胶质细胞的炎症反应。因此,本研究旨在通过利用LPS、IL-1β和TNF-α建立一种体外星形胶质细胞活化模型,用于神经系统疾病的炎症反应研究。
1 材料与方法
1.1 细胞和试剂C8-D1A细胞系、DMEM高糖培养液购于武汉普诺赛生命科技有限公司,青霉素-链霉素混合液(100×)、胰蛋白酶购于美国Gibco公司,TNF-α、IL-1β购于近岸蛋白科技有限公司,LPS、Triton X-100购于Sigma公司,兔抗人GAPDH多克隆抗体购自南京巴傲得生物科技有限公司,兔抗人GFAP多克隆抗体购于赛默飞世尔科技(中国)有限公司,BCA蛋白定量试剂盒购自上海雅酶生物医药科技有限公司,RNA纯化试剂盒购自赛默飞世尔科技(中国)有限公司,引物由上海生工生物工程股份有限公司合成,反转录试剂盒、荧光定量试剂盒购自康为世纪生物科技有限公司。
1.2 细胞培养C8-D1A细胞置于含体积分数10%胎牛血清的DMEM高糖培养液中,在37 ℃、体积分数为5% CO2的培养箱中培养。每日用显微镜观察细胞生长情况,每3~4 d进行消化传代。
1.3 实验分组将细胞系分别在基础培养液和完全培养液中培养,根据LPS和IL-1β、TNF-α浓度和0、6、24、48、72 h时间点分组,通过Western blot或荧光定量PCR检测GFAP表达水平。
1.4 Western blot 检测C8-D1A细胞中GFAP的表达分组处理细胞系后,PBS洗涤,RIPA裂解细胞提取总蛋白,BCA法测定蛋白浓度。将蛋白样品与5×SDS-PAGE混合煮沸5 min,120 V电泳1 h后,250 mA电泳1 h湿转至聚偏二氟乙烯膜,使用无蛋白快速封闭液封闭10 min,加入兔抗人GFAP一抗(1∶1 000)、兔抗人GAPDH一抗(1∶10 000)4 ℃过夜孵育,TBST漂洗5遍后,加入HRP标记的山羊抗兔IgG(1∶10 000)室温孵育1 h。TBST漂洗3遍,将增强化学显影剂滴加至膜上,曝光并显影。使用Image J软件进行灰度分析。将目的条带GFAP与内参条带GAPDH的灰度比值作为GFAP的相对表达水平。实验重复3次。
1.5 荧光定量PCR检测GFAPmRNA的表达实验分组后,使用RNA纯化试剂盒提取总RNA,按照反转录试剂盒说明书去除基因组的DNA合成cDNA,以此为模板进行荧光定量检测。扩增反应时间:95 ℃预变性30 s,95 ℃变性5 s,60 ℃退火30 s,60 ℃延伸30 s,40个循环。溶解反应时间:95 ℃ 15 s,60 ℃退火1 min,95 ℃延伸15 s,0 ℃30 s。采用2-△△Ct方法计算目的基因相对表达水平。引物序列:GFAP(上游5’-AGAAAACCGCATCACCATTC-3’,下游5’-TCACATCACCACGTCCTTGT-3’);GAPDH(上游5’-ATGATTCTACCCACGGCAAG,下游5’-CTGGAAGATGGTGATGGGTT-3’)。实验重复3次。
1.6 免疫荧光吸去培养液,PBS清洗,加入40 g·L-1的多聚甲醛固定30 min,并用PBS在室温摇床上清洗3次,每次5 min。加入0.2%Triton X-100破膜10 min,PBS在室温摇床上清洗3次,每次5 min,加入适量体积分数10%的山羊血清封闭30 min。吸去山羊血清,每孔加入GFAP抗体,4 °C过夜。吸去一抗,置于摇床,于室温下用PBS洗3次,每次5 min。加入二抗,室温放置1 h后吸去二抗,加入PBS避光清洗,方法同一抗。加入DAPI溶液染细胞核,室温放置5 min。吸去DAPI溶液,加入PBS避光清洗,荧光显微镜下拍照。

2 结果
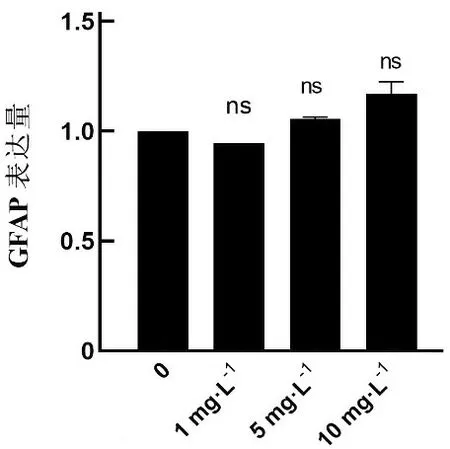
2.1 完全培养液中不同浓度LPS干预下C8-DIA细胞的GFAP表达水平不同浓度LPS干预C8-D1A细胞系48 h后,各组GFAP表达水平与空白组比较,差异无统计学意义(P>0.05)。见表1、图1、图2。
表1 完全培养液中,不同浓度LPS干预下C8-DIA细胞的 GFAP表达水平比较
ns表示,与空白组比较,P>0.05。

图2 完全培养液中不同浓度LPS干预C8-DIA细胞 48 h后GFAP的Western blot结果
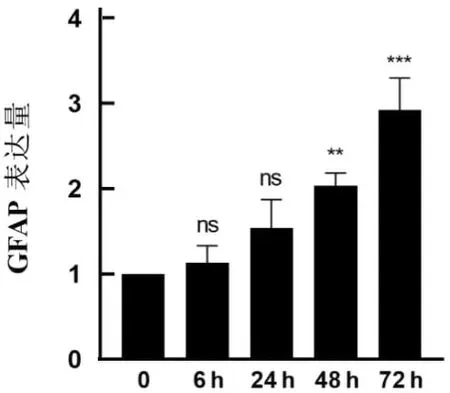
2.2 基础培养液中1 mg·L-1LPS不同时间干预下C8-DIA细胞中GFAP的表达水平48 h组、72 h组GFAP表达水平高于空白组,差异有统计学意义(P<0.05)。见表2、图3、图4。
表2 基础培养液中,1 mg·L-1 LPS不同时间干预下, C8-DIA细胞中GFAP的表达水平比较
ns、**、***分别表示,与空白组比较,P>0.05、P<0.01、P<0.001。
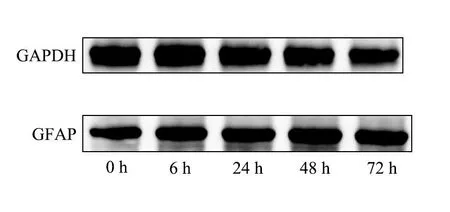
图4 基础培养液中,1 mg·L-1 LPS干预下,不同时间点 GFAP的Western blot结果
2.3 基础培养液中不同浓度LPS干预下C8-D1A细胞系GFAP的表达水平不同浓度LPS干预C8-D1A细胞系48 h后,当LPS浓度为1、5、10 mg·L-1时,GFAP表达水平高于空白组,差异均有统计学意义(P<0.05)。见表3、图5。
表3 不同浓度LPS干预48 h,C8-D1A细胞中 GFAP的表达水平比较
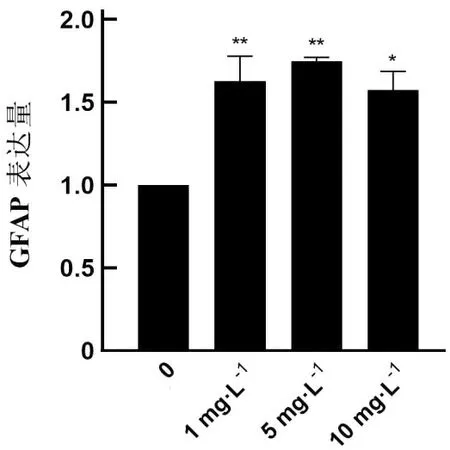
ns、*、**分别表示,与空白组比较,P>0.05、P<0.05、P<0.01。
2.4 基础培养液中LPS和炎症因子对GFAP表达水平的影响基础培养液中,1 mg·L-1LPS、10 μg·L-1IL-1β联合10 μg·L-1TNF-α干预C8-D1A细胞系48 h后,GFAP表达水平高于空白组,差异均有统计学意义(P<0.05)。见表4、图6。
2.5 LPS或炎症因子体外干预对星形胶质细胞系C8-D1A形态的影响相比于空白组,1 mg·L-1LPS干预48 h后活化的星形胶质细胞GFAP表达增加,细胞由扁平变为突起,交织成网,透光性增加,细胞状态良好。见图7。1 mg·L-1LPS干预48 h,荧光显微镜下进行GFAP免疫荧光检测,实验组荧光强度高于空白组,细胞肥大,突起增多。见图8。
表4 LPS及炎症因子干预48 h,C8-D1A中 GFAP表达的比较
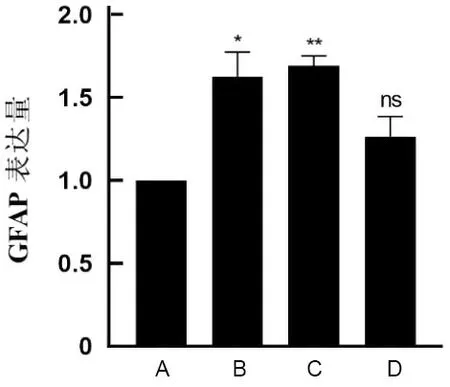
A为空白组;B为1 mg·L-1 LPS组;C为10 μg·L-1 IL-1β联合10 μg·L-1 TNF-α组;D为1 mg·L-1 LPS、10 μg·L-1 IL-1β联合10 μg·L-1 TNF-α组;ns、*、**分别表示,与空白组比较,P>0.05、P<0.05、P<0.01。
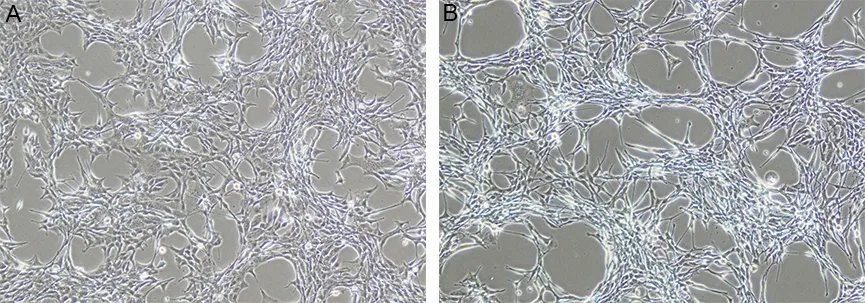
A为正常培养48 h后的C8-D1A细胞形态(20×) ;B为干预48 h后的 C8-D1A细胞形态(20×)
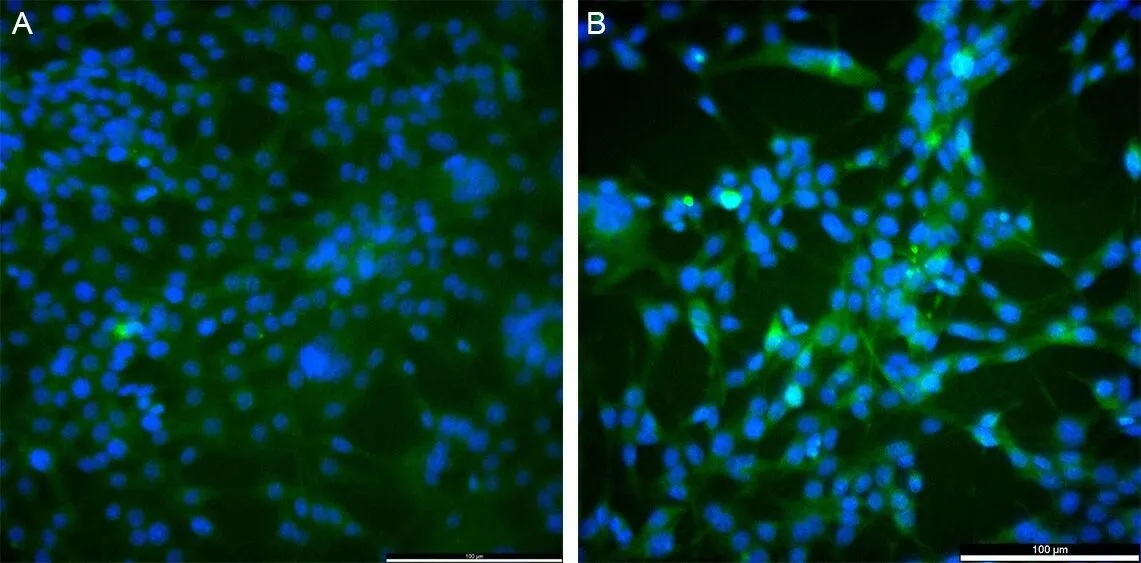
A为正常培养48 h后的C8-D1A细胞(20×) ;B为1 mg·L-1 LPS干预48 h后的 C8-D1A细胞(20×)
3 讨论
星形胶质细胞支撑神经元架构,参与血脑屏障的形成和维持。星形胶质细胞由静息态转变为反应态是大脑内环境对应激损伤作出的基本应答。活化增殖的星形胶质细胞能够限制局部炎症反应播散,维持血脑屏障稳态,但在炎症反应后期,这些变化诱发不必要的突触连接,导致神经性疼痛,影响神经功能恢复[4]。星形胶质细胞活化的发生和作用一直是神经领域关注的焦点。GFAP是星形胶质细胞的特征性蛋白,生理情况下,大脑内GFAP表达水平很低,当星形胶质细胞受到损伤或外界刺激后,形态会发生变化并产生GFAP。研究报道,GFAP的表达与损伤时间存在相关性[5],且与星形胶质细胞活化程度成正比[6]。因此本研究通过观察GFAP表达的变化和星形胶质细胞形态学变化来显示活化的星形胶质细胞,结果显示,诱导后的星形胶质细胞系形态改变,GFAP表达增高,这与以往研究[7]一致,表明星形胶质细胞活化成功。
诱导星形胶质细胞活化的递质主要是Toll样受体4(Toll-like receptor 4,TLR4)受体激动剂LPS和细胞因子(IL-1α、TNF-α和补体成分C1q以及IL-1β)[8-9]。TLR4受体由TLR4基因编码,可以识别革兰阴性细菌细胞壁外壁组成成分LPS,并通过核因子κB或JNK/SAPK途径启动炎症反应。使用LPS刺激星形胶质细胞,可以引起星形胶质细胞系NADPH氧化酶活性增加以及超氧化物和3-硝基酪氨酸水平升高[10]。故本实验使用LPS作为体外诱导星形胶质细胞系活化的递质,研究结果显示,不含血清的基础培养液是建立LPS体外活化星形胶质细胞系的首要条件。血清中含有使细胞快速增殖的上百种蛋白质,如生长因子、补体、球蛋白等。去血清培养条件下,饥饿细胞对刺激因子LPS的吸收增加,且血清内物质对星形胶质细胞活化的影响被去除。本实验选择1 mg·L-1LPS干预星形胶质细胞系0、6、24、48、72 h,结果显示,从48 h开始,GFAP表达增高,差异有统计学意义,这与中枢神经系统损伤后GFAP表达变化一致[11]。有研究证明LPS干预星形胶质细胞72 h时,细胞活力下降且大量凋亡[12]。此外,星形胶质细胞GFAP的表达水平与LPS浓度呈正相关,当浓度为1 mg·L-1时,GFAP表达水平最高,浓度为10 mg·L-1时表达水平略有下降[13],本研究结果与之相符,但未得出GFAP与LPS呈剂量相关。有研究报道GFAP表达与卒中严重程度相关[14],本次研究证明了体外适宜的LPS浓度能使星形胶质细胞活化,但其不同剂量是否可作为模拟刺激强度和损伤的递质,仍需进一步实验证明。
大脑中TNF-α对星形胶质细胞的活化作用最初靠小胶质细胞实现,激活的小胶质细胞分泌TNF-α促使星形胶质细胞向A1型和A2型转化,同时,活化的星形胶质细胞通过产生血管内皮生长因子A、粒细胞-巨噬细胞集落刺激因子、IL-1β、肿瘤坏死因子等递质与小胶质细胞、少突胶质细胞、内皮细胞、白细胞相互作用,促进炎症细胞的活化,形成炎症瀑布[15]。除此之外,TNF-α还发挥“触动因子”的作用,刺激星形胶质分泌IL-6等炎症因子,产生长期免疫反应[16]。本研究结果显示,在星形胶质细胞系中加入10 μg·L-1IL-1β联合10 μg·L-1TNF-α 48 h后,细胞内GFAP水平高于空白组,说明IL-1β、TNF-α在体外也可以实现对星形胶质细胞的活化,但同时加入LPS和炎症因子IL-1β、TNF-α刺激星形胶质细胞系时,未出现活化表现,这可能与LPS和炎症因子联合会使星形胶质细胞发生凋亡有关[17],其机制需进一步探究。
以往大多以原代细胞为基础建立体外星形胶质细胞活化模型,但原代星形胶质细胞提取过程繁琐且细胞不能多次传代,相较原代细胞,C8-D1A细胞系具有稳定培养、多次传代、细胞形态和功能不发生变化的优点。本研究体外给予1 mg·L-1LPS或10 μg·L-1IL-1β联合10 μg·L-1TNF-α在无血清的基础培养液中刺激星形胶质细胞系48 h,星形胶质细胞形态改变,细胞状态良好,GFAP表达增加,获得了较为理想的星形胶质细胞体外活化模型,为研究星形胶质细胞的受体表达、功能变化与中枢神经系统炎症及疾病的关系提供参考。
