食管上皮内瘤变术前活检和内镜黏膜下剥离术后病理分析
2022-09-20史正扬郑权
史正扬,郑权
(郑州大学第五附属医院 消化内科,河南 郑州 450000)
食管癌的发病率全球排第7名,且病死率较高。2018年全球癌症统计数据显示,食管癌患者的病死率在所有恶性肿瘤中排第6名[1]。在中国,食管癌的发病率排第6名,病死率排第4名,每年食管癌的新发病例数甚至达到全世界的一半以上[2]。食管癌组织学类型以食管鳞状细胞癌(esophageal squamous cell carcinoma,ESCC)为主。食管上皮内瘤变是食管癌前病变,呈现出从低级别上皮内瘤变(low-grade intrae-pithelial neoplasia,LGIN)至高级别上皮内瘤变(high-grade intraepithelial neoplasia,HGIN),再到早期食管癌、进展期食管癌的分阶段演变模式[3]。我国食管癌早期检出率仍处于较低水平,食管癌早期临床症状不典型,大多数患者就诊时病情已经进展到了中晚期。而食管癌患者的预后与肿瘤分期密切相关。晚期食管癌的5 a生存率仅为10%~20%,早期诊断和治疗可使食管癌5 a生存率提高至90%以上[4-5]。
内镜下活检是诊断食管黏膜病变的常用手段,被认为是食管癌诊断的金标准。但近年来一些研究发现食管癌或癌前病变术前活检与术后病理存在差异。本研究旨在分析食管上皮内瘤变内镜黏膜下剥离术(endoscopic submucosal dissection,ESD)后与术前活检病理差异,并对患者术后病理升级的危险因素进行分析。
1 资料与方法
1.1 一般资料回顾性分析2016年7月至2022年4月在郑州大学第五附属医院消化内镜中心接受ESD治疗的119例术前活检病理为HGIN或LGIN的患者的临床资料。经超声内镜和CT检查,明确浸润深度及无淋巴结转移。记录患者的性别、年龄、病变部位(以距食管上、下括约肌5 cm为界将食管分为上、中、下3部分)、病变大小、内镜下形态、上皮乳头内毛细血管袢(intrapapillary capillary loop,IPCL)、黏膜表面是否发红、有无结节样改变、术前与术后病理等。内镜下形态依据巴黎分型标准,IPCL参照日本食管学会AB分型[6]。
1.2 研究方法对术前活检诊断为HGIN或LGIN的患者进行ESD治疗。术后标本放入体积分数为4%的甲醛溶液中固定24 h后,每隔2 mm连续平行切开标本,由经验丰富的病理科医生观察判断病变组织学类型、浸润深度、分化程度、有无脉管浸润、切缘是否阳性等。组织病理学分型采用WHO新分类标准[7]。
1.3 统计学方法应用SPSS 26.0统计软件进行数据分析。单因素分析采用χ2检验或Fisher精确概率法,对发现有统计学意义的变量进行多因素logistic回归分析,分析结果用OR值及95% CI等表示。P<0.05为差异有统计学意义。
2 结果
2.1 患者一般情况及病理结果本研究共纳入119例患者的124个病灶,男性占61.29%(76/124),女性占38.71%(48/124)。LGIN组ESD术后病理与术前活检病理一致率为56.52%(26/46);36.96%(17/46)升级为HGIN,4.35%(2/46)升级为ESCC,总升级率41.30%(19/46);术后2.17%(1/46)病理降级为慢性炎症。HGIN组中52.56%(41/78)术后病理仍为HGIN,38.46%(30/78)的病灶术后病理升级为ESCC,降级为LGIN占8.97%(7/78)。见表1。

表1 124个病灶内镜活检与ESD术后病理结果/个
2.2 单因素分析结果
2.2.1LGIN组 46个术前活检为LGIN的病灶均完成了治愈性切除,1个发生术后迟发性出血,经内科保守治疗后治愈。19个(41.30%)病灶经ESD术后病理升级为HGIN或ESCC,病变黏膜发红、表面结节样改变、B型IPCL是病理升级的危险因素(P<0.05),而患者的性别、年龄、病变大小、部位、内镜分型与术后病理升级无关(P>0.05)。见表2。
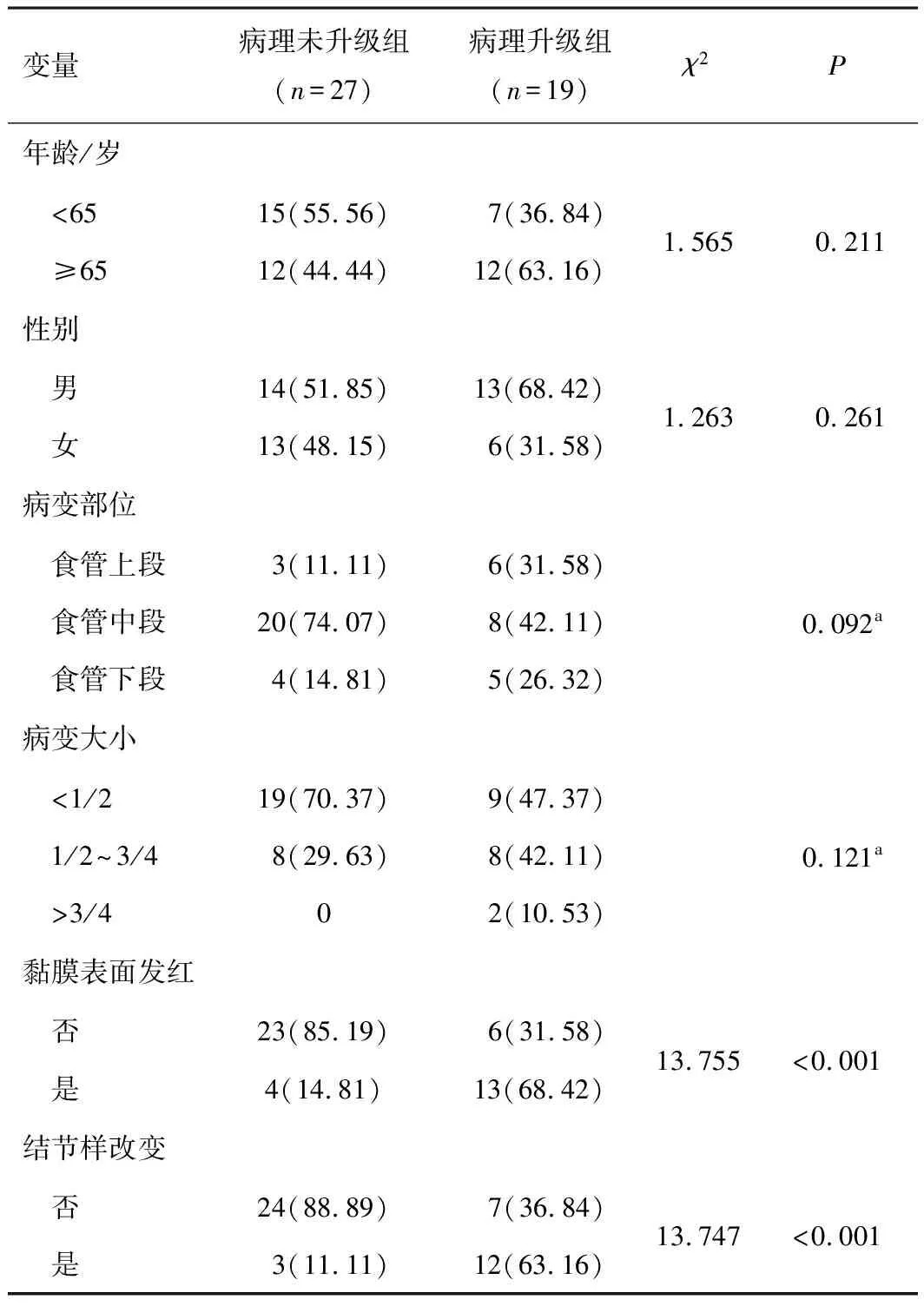
表2 LGIN组ESD术后病理升级的单因素分析结果

表2(续)
2.2.2HGIN组 78个术前活检病理为HGIN的病灶中,30个(38.46%)升级为ESCC,其中2个浸润至黏膜下层,1个在手术过程中发生穿孔,使用钛夹封闭创面,2个术后出现迟发性出血,均经内科保守治疗后治愈。单因素分析结果显示病变表面发红、结节样改变与ESD术后病理升级相关(P<0.05),而性别、年龄、病变大小、病变部位、内镜分型、IPCL分型、内镜分型与ESD术后病理升级无关(P>0.05)。见表3。

表3 HGIN组ESD术后病理升级的单因素分析
2.3 多因素回归分析结果将单因素分析中P<0.05的变量作为自变量并赋值,见表4。纳入多因素logistic回归分析,因变量为术后病理是否升级(否=0,是=1),结果显示,病变表面发红、结节样改变和B型IPCL是LGIN组病理升级的独立危险因素;病变表面发红、节样改变是HGIN组病理升级的独立危险因素。见表5。

表4 自变量赋值情况
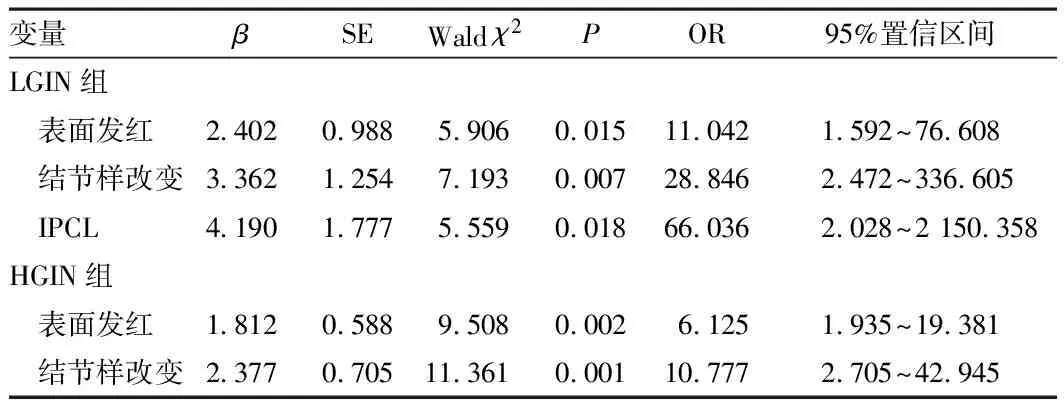
表5 食管上皮内瘤变ESD术后病理升级的多因素 logistic回归分析结果
3 讨论
食管上皮内瘤变包括LGIN(相当于轻度和中度异型增生)和HGIN(相当于重度异型增生和原位癌)。HGIN易进展为食管癌,为ESD治疗的绝对适应证[8],一项历时13 a的随访研究结果显示,74%的HGIN患者在随访过程中进展为癌[9]。相对于HGIN,LGIN癌变风险较低,医务人员可对患者定期随访,或者根据病情实施内镜下治疗。内镜活检具有损伤较小、取材简便、准确性较高等优点,是诊断食管癌及癌前病变的常用手段。但近年来研究发现,术前活检与术后病理结果存在一定差异。病灶内可能同时存在炎症、LGIN、HGIN和ESCC,而活检标本只钳取少量病灶,未必能取到整个病灶中病变最严重的部位。韩国一项研究结果显示,44.5%的病例术后病理发生改变[10]。Yang等[11]的研究结果显示,137个病灶的术前活检与术后病理差异率为45.3%,其中LGIN组中43.7%的病灶术后病理升级为HGIN或ESCC,HGIN组41.0%的病灶术后升级为ESCC。本研究结果显示,124个食管病灶术后病理差异率为45.97%,LGIN组的病灶术后病理升级率为41.30%,HGIN组的病灶术后病理升级率为38.46%。
为了进一步探讨引起活检与术后病理差异的原因,国内外研究者对影响术后病理升级的危险因素进行了研究。Park等[12]通过对77例(84个病灶)食管病变术前活检及术后病理结果进行分析发现,当病变位于食管上段,病灶面积/活检块数≥158.6 mm2时,术后病理升级的可能性增加。对于肿瘤直径<14 mm的病灶,可取1块组织活检;肿瘤直径≥14 mm,应至少进行2次活检。国内有研究报道,病变直径>2.0 cm、表面凹陷或溃疡以及≤4个活检样本是HGIN术后病理升级的危险因素[13]。本研究结果显示,病变表面发红、结节样改变是术后病理升级的危险因素,这与张松等[14]的研究结果一致。本研究中,B型IPCL在LGIN组与术后病理升级有关,但在HGIN组,B型IPCL不是病理升级的危险因素,这可能是因为HGIN组中B型IPCL病例数量过少。另外,本研发现在LGIN组中1例降级为黏膜慢性炎,HGIN组中7例降级为LGIN。分析原因,可能是这些病灶中病变严重处范围比较小,通过活检已将其完全去除,因而ESD术后标本病理发生降级。
增加活检标本数量是提高活检准确率的有效方法。有研究报道,6次活检可使诊断准确率提高至100%,但是这也会增加黏膜下发生纤维化风险,使后续内镜下治疗更加困难;使用放大内镜(magnifying endoscopy,ME)、窄带成像(narrow band imaging,NBI)、蓝激光显像(blue laser imaging,BLI)等内镜技术既有助于提高病变检出率,又能指导活检部位,提高活检准确性[15]。苏振华等[16]的研究结果显示,ME结合NBI引导活检病理结果明显优于白光内镜。日本一项研究结果显示明,与传统的白光内镜相比,ME-NBI有更高的检测准确率和特异度[17]。因此,对于ME-NBI观察为B型IPCL,但活检未确诊为HGIN或ESCC的患者,应尽快接受内镜切除术或重复活检。卢戈液染色对于食管病变的诊断也具有重要价值。正常的食管鳞状上皮内含有丰富的糖原,遇到卢戈液中的碘会呈现棕褐色。而肿瘤细胞内糖原减少或消失,遇碘不会像正常食管黏膜一样出现着色反应,所以喷洒卢戈液后病变部位会出现淡染区或不染区[18]。张惠晶等[19]对170例食管早癌及癌前病变患者进行回顾性分析发现NBI及碘染色对HGIN具有诊断价值,但对于LGIN,NBI诊断价值不如碘染色。刘芝兰等[20]的研究结果表明,白光内镜联合ME-NBI和卢戈液染色对可疑食管病变的检出率明显高于白光内镜联合ME-NBI。白光内镜联合ME-NBI和卢戈液染色术前活检诊断HGIN及早癌的准确率达96.1%。因此,对于可疑食管早癌或癌前病变,应联合使用ME、NBI、卢戈液染色,提高活检准确率。
综上所述,食管病变活检提示为LGIN或HGIN,术后发生病理升级的情况并不少见。对于内镜下黏膜发红、表面结节样改变以及B型IPCL的病灶,医生应仔细观察,必要时增加活检样本数量,积极使用ME、电子染色等先进内镜技术,结合卢戈液染色情况,对IPCL异型严重处进行靶向活检,以提高活检准确率。本研究为回顾性研究,样本量有限,结论有待多中心、更大样本量、前瞻性研究加以证实。
