地西他滨联合低剂量CAG方案化疗对老年急性髓系白血病的疗效与预后分析
2022-09-20杨晗春黄娟娟三亚中心医院海南省第三人民医院血液内科海南三亚572000
杨晗春,成 斐,黄娟娟(三亚中心医院/海南省第三人民医院血液内科,海南 三亚 572000)
急性髓系白血病(acute myeloid leukemia,AML)是指患者造血系统髓系的原始细胞出现恶性增殖性克隆,并具有高度异质性。AML患者主要表现为出血、贫血、感染、发热及脏器浸润等,对其生命造成严重威胁[1-3]。我国白血病的发病率为3/10万 ~ 4/10万,其中老年患者占比> 60%,且随着我国人口老龄化,老年AML的发病率呈逐年上升趋势[4-5]。地西他滨是一种特异性DNA甲基化转移酶抑制剂在骨髓异常增生综合征治疗中具有较好效果[6-8]。研究显示,AML患者也存在甲基化改变,这在AML的发病过程中具有重要作用。地西他滨联合CAG方案(阿糖胞苷+阿柔比星+粒细胞刺激因子)是治疗该病的常用方法[9],老年患者由于身体机能下降,骨髓造血能力差,对药物耐受性降低,老年AML患者应用CAG方案的给药剂量存在较大争议。本研究对我院老年AML患者进行了地西他滨联合低剂量CAG治疗,旨在探索更加适合老年AML患者的治疗方法,为临床确定最佳给药剂量提供参考。
1 资料与方法
1.1 临床资料
采用前瞻性研究方法,选择2017年10月 – 2020年3月我院收治的100例老年AML患者为研究对象,按照随机数字表法将患者分为对照组(50例)和观察组(50例)。本研究经我院伦理委员会的批准,批件号:[2017第(09)号]。
纳入标准:①患者均为初次诊断为AML且未进行化学治疗,诊断标准符合《血液病诊断及疗效标准》[9];②年龄> 60岁;③患者神志清醒且愿意配合治疗;④患者或其家属均已签署知情同意书。排除标准:①合并其它部位恶性肿瘤;②合并内分泌系统疾病;③合并其它严重脏器疾病;④合并其它血液病,如骨髓纤维化和血友病等;⑤对本研究所用药物过敏患者;⑥精神障碍者;⑦中途失访或退出研究者。
1.2 方法
给药方案:①标准剂量CAG方案:阿糖胞苷(Actavis Italy S.p.A,规格:0.1 g,20 mg·m-2,q 12 h,ih,d1 – d14);阿柔比星(深圳万乐药业,规格:20 mg,20 mg·m-2,qod,ivgtt,d1 – d4);粒细胞刺激因子(山东科兴生物制品有限公司,规格:150 μg,300 μg·m-2,qd,ih,d1 – d14)。②低剂量CAG方案:阿糖胞苷(10 mg·m-2,q 12 h,ih,d1 – d14);阿柔比星(10 mg·m-2,qod,ivgtt,d1 – d10);粒细胞刺激因子(300 μg·m-2,qd,ih,d1 – d14)。③地西他滨方案:地西他滨(华北制药,规格:50 mg,10 mg·m-2,ivgtt,d1 – d5)。
化疗同时给予患者保肝、止吐及营养支持等对症治疗。当患者WBC > 20×109·L-1时,停止用药直至白细胞数量恢复;当Hb < 60 g·L-1时,给予红细胞悬液静脉滴注;当PLT < 20×109·L-1时,对患者进行促血小板生成素治疗。
按照上述给药方案,对照组采用地西他滨联合标准剂量CAG治疗,观察组采用地西他滨联合低剂量CAG治疗,两组均治疗14 d,随访时间为18个月。
1.3 观察指标
由我院检验科检测血液指标(中性粒细胞计数、血小板计数及血红蛋白含量);采用流式分析仪检测血清免疫指标(血清CD4+和CD8+细胞数量);记录患者化疗期间所发生的不良反应,包括胃肠道反应、肺部感染、肝功能受损、心力衰竭、血小板减少和粒细胞减少;通过随访统计患者治疗后18个月的总生存率。
1.4 临床疗效评价
根据《血液病诊断及疗效标准》[9]评估患者疗效。完全缓解(complete remission,CR):患者症状与体征完全消失,骨髓原始粒细胞比例< 5%,且血常规检查显示中性粒细胞和血小板处于正常范围;部分缓解(partial remission,PR):患者症状与体征明显缓解,骨髓原始粒细胞比例在5% ~ 20%,且血常规检查显示中性粒细胞和血小板接近正常水平;未缓解(nonremission,NR):患者症状、体征无明显改善,甚至加重,骨髓原始粒细胞与血常规检查结果均未满足CR与PR要求。有效率=(完全缓解例数+部分缓解例数)/总例数×100%。
1.5 统计学方法
采用SPSS 20.0软件进行统计学分析。计量资料以均数±标准差表示,两组间比较采用t检验;计数资料以例数(%)表示,组间比较采用χ2检验。P<0.05为差异具有统计学意义。
2 结果
2.1 患者一般资料
研究共纳入100例患者,观察组男性29例,女性21例,患者平均年龄(68.93±5.27)岁,FAB分型:M2 24例,M4 10例,M5 13例,M6 3例;对照组男性29例,女性21例,患者平均年龄(68.74±5.33)岁,FAB分型:M2 23例,M4 11例,M5 12例,M6 4例,两组患者一般资料经对比无显著性差异(P> 0.05)。
2.2 血液指标
治疗前,两组患者血液中的中性粒细胞、血小板和血红蛋白含量经对比均无显著性差异(P> 0.05);治疗后观察组患者血红蛋白含量显著高于对照组(P<0.05),两组中性粒细胞和血小板数量无显著性差异(P> 0.05),见表1。

表1 两组血液指标对比. n = 50Tab 1 Comparison of blood indexes between the two groups. n = 50
2.3 血清免疫指标
治疗前,两组患者血清中的CD4+和CD8+细胞数量经对比无显著性差异(P> 0.05);治疗后,观察组患者血清中上述细胞数量显著低于对照组(P<0.05),见表2。
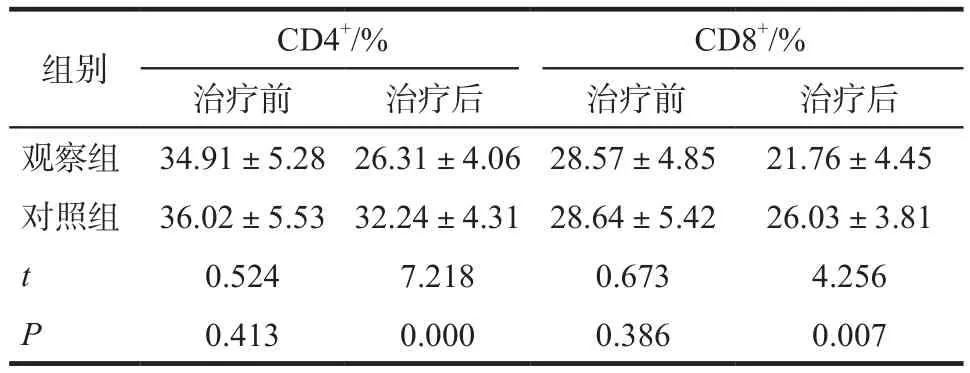
表2 两组免疫指标对比. n = 50Tab 2 Comparison of immune indicators between the two groups. n = 50
2.4 治疗效果
经联合化疗后,观察组达到CR 26例(52.00%),PR 13例(26.00%),治疗有效率为78.00%;对照组达到CR 25例(50.00%),PR 14例(28.00%),治疗有效率为78.00%,两组无统计学差异(χ2= 0.016,P=0.891)。
2.5 不良反应
经联合化疗后,观察组患者各项不良反应发生率均低于对照组,其中观察组血小板减少发生率与对照组相比差异具有统计学意义(P< 0.05),见表3。
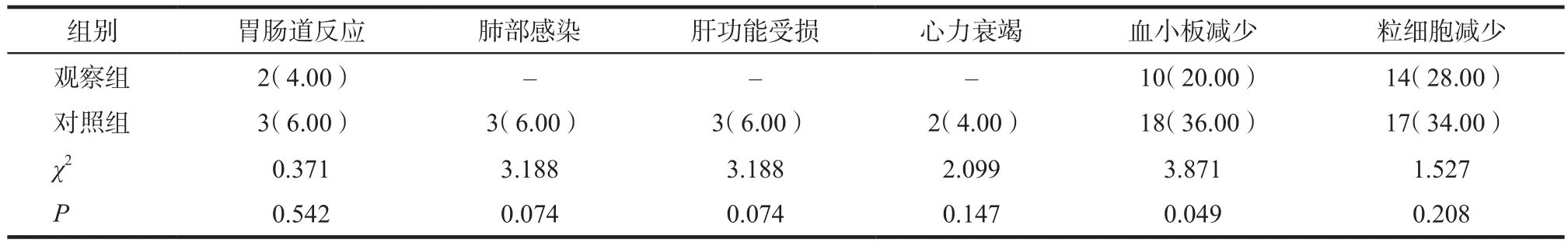
表3 两组不良反应对比. n = 50,例次(%)Tab 3 Comparison of adverse reactions between the two groups. n = 50, case(%)
2.6 预后
患者结束治疗,观察组患者18个月总生存率为78.00%,对照组18个月总生存率为68.00%,差异具有统计学意义(χ2= 5.96,P= 0.041)。
3 讨论
强化化疗和造血干细胞移植在年轻AML患者中效果较好,但老年患者很容易出现化疗后骨髓发育不良时间延长和细胞毒药物耐药,且老年患者抵抗力较低,往往接受不了标准剂量化疗,造成并发症较多、预后差[10-12]。CAG化疗是目前老年AML患者临床治疗的主要方式[13-14],与地西他滨联合使用可显著诱导AML细胞的凋亡,改善疾病进展[15]。地西他滨是唯一被FDA批准应用于临床的DNA甲基化转移酶抑制剂,可以通过胞苷类似物5位嘧啶环修饰逆转DNA甲基化过程,激活抑癌基因进而抑制肿瘤细胞的增殖[16-18]。目前有研究显示采用标准剂量的CAG化疗在治疗高龄AML患者时可诱发较高的血液毒性,并可能由于延长骨髓抑制期引发患者死亡。而低剂量的CAG方案可以在保证疗效的同时有效降低上述不良反应发生率[3]。但关于地西他滨联合不同剂量CAG化疗在老年AML患者中的疗效对比研究仍较少,尤其是CAG化疗的具体剂量一直存在争议。
本研究结果显示,治疗后观察组患者中的血红蛋白含量显著高于对照组,提示地西他滨联合低剂量CAG与标准方案相比对老年AML患者的血液毒性作用更低。同时,治疗后观察组患者血清中的CD4+和CD8+细胞数量显著低于对照组,提示地西他滨联合低剂量CAG能够更好的恢复患者的免疫功能,低剂量的CAG化疗可能更适用于老年AML患者。在疗效方面,两组各项治疗指标对比无显著性差异,提示地西他滨联合低剂量CAG与标准方案相比疗效相当。这可能是由于联合治疗时地西他滨和CAG化疗起到了协同作用,不仅降低了单一使用CAG容易产生耐药的风险,而且地西他滨可以通过胞苷类似物5位嘧啶环修饰逆转DNA甲基化过程,并最终激活抑癌基因抑制肿瘤细胞增殖。观察组18个月生存率明显高于对照组。此外,观察组患者的不良反应发生率较低,尤其是血小板减少发生率显著低于对照组,这些都提示了地西他滨联合低剂量CAG与标准方案相比可以明显改善患者预后,且不良反应更少。这与以往研究[3,7]结果类似。这一研究成果提供了一种全新的CAG化疗用量参考,丰富了CAG化疗在老年AML患者治疗中的临床用药经验。
综上所述,相较于地西他滨联合标准剂量CAG化疗,联合低剂量CAG化疗治疗老年AML患者,在疗效得到保证的同时,不良反应发生率更低且预后较好,可为临床在治疗老年AML时的给药剂量选择提供一定循证依据。
